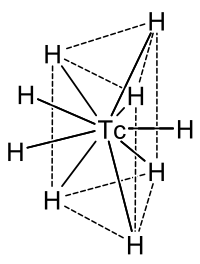Technetium
| eiendommer | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Som regel | ||||||||||||||||||||||||||||||||||||||||||||||
| Navn , symbol , atomnummer | Technetium, Tc, 43 | |||||||||||||||||||||||||||||||||||||||||||||
| Elementkategori | Overgangsmetaller | |||||||||||||||||||||||||||||||||||||||||||||
| Gruppe , periode , blokk | 7 , 5 , d | |||||||||||||||||||||||||||||||||||||||||||||
| Se | sølvgrå metallic | |||||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | 7440-26-8 | |||||||||||||||||||||||||||||||||||||||||||||
| EF-nummer | 231-136-0 | |||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.305 | |||||||||||||||||||||||||||||||||||||||||||||
| Massedel av jordens konvolutt | 1,2 · 10 −15 spm | |||||||||||||||||||||||||||||||||||||||||||||
| Atomisk | ||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 98,9063 u | |||||||||||||||||||||||||||||||||||||||||||||
| Atomeradius (beregnet) | 135 (185) pm | |||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 147 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfigurasjon | [ Kr ] 4 d 5 5 s 2 | |||||||||||||||||||||||||||||||||||||||||||||
| 1. Ioniseringsenergi | 7..11938 (3) eV ≈ 686.92 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||
| 2. Ioniseringsenergi | 15..26 eV ≈ 1 472 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||
| 3. Ioniseringsenergi | 29.55 eV ≈ 2 851 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||
| 4. Ioniseringsenergi | 41.0 (1,7 eV) ≈ 3 956 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||
| 5. Ioniseringsenergi | 57.0 (1,9) eV ≈ 5 500 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||
| Fysisk | ||||||||||||||||||||||||||||||||||||||||||||||
| Fysisk tilstand | fast | |||||||||||||||||||||||||||||||||||||||||||||
| Krystallstruktur | sekskantet | |||||||||||||||||||||||||||||||||||||||||||||
| tetthet | 11,5 g / cm 3 (25 ° C ) | |||||||||||||||||||||||||||||||||||||||||||||
| magnetisme | paramagnetisk ( Χ m = 3,9 10 −4 ) | |||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 2430 K (2157 ° C) | |||||||||||||||||||||||||||||||||||||||||||||
| kokepunkt | 4538 K (4265 ° C) | |||||||||||||||||||||||||||||||||||||||||||||
| Molar volum | 8,63 · 10 −6 m 3 · mol −1 | |||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 550 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||
| Fusjonsvarme | 23 kJ mol −1 | |||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk ledningsevne | 4.54 · 10 6 A · V −1 · m −1 | |||||||||||||||||||||||||||||||||||||||||||||
| Termisk ledningsevne | 51 W m −1 K −1 | |||||||||||||||||||||||||||||||||||||||||||||
| Kjemisk | ||||||||||||||||||||||||||||||||||||||||||||||
| Oksidasjonstilstander | -3 til 7 | |||||||||||||||||||||||||||||||||||||||||||||
| Normalt potensiale | 0,272 V (TcO 2 + 4 e - + 4 H + → Tc + 2 H 2 O) |
|||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1.9 ( Pauling-skala ) | |||||||||||||||||||||||||||||||||||||||||||||
| Isotoper | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| For andre isotoper, se listen over isotoper | ||||||||||||||||||||||||||||||||||||||||||||||
| Fare- og sikkerhetsinformasjon | ||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktivt | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
|
Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er oppgitt, gjelder opplysningene standardbetingelser . | ||||||||||||||||||||||||||||||||||||||||||||||
Technetium er et kjemisk element med grunnstoffsymbolet Tc og atomnummeret 43. Det forekommer naturlig på jorden, om enn i veldig små mengder. Technetium var den første kunstig produserte element og dermed fikk sitt navn avledet fra det gamle greske ordet τεχνητός technētós ( "kunstig").
Det er et av overgangsmetallene , i det periodiske systemet er det i 5. periode og 7. undergruppe (gruppe 7) eller mangangruppe . Oppdagelsen av elementet av Walter Noddack , Ida Tacke og Otto Berg , som ga det navnet Masurium , hadde allerede blitt rapportert i 1925 . I noen eldre bøker forkortes derfor teknetium til “Ma”.
Alle technetium isotoper er radioaktiv , noe som betyr at alle atomkjerner som inneholder 43 protoner er ustabile og forråtnelse. Technetium og tyngre prometium (61) er de eneste elementene med et mindre atomnummer enn vismut (83) som har denne egenskapen.
historie
I mange år var det et gap mellom elementene molybden (42) og ruthenium (44) i det periodiske tabellen over elementene foreslått av den russiske kjemikeren Dmitri Mendeleev , noe som indikerer et tidligere uidentifisert element. Mendeleev selv ga det navnet Eka-Mangan og spådde med god tilnærming blant annet massen. I perioden som fulgte forsøkte mange forskere å oppdage det manglende elementet; sin posisjon i det periodiske systemet forsterket antagelsen om at det var lettere å finne enn andre hittil uoppdagede elementer med høyere atomnummer.
Mislyktes funn
Antallet påståtte bevis på elementet, samt oppdagelsene knyttet til elementet, er uvanlig stort. Den første antatte oppdagelsen som var assosiert med technetium er Polinium i 1828 av Gottfried Osann . Han mente at i tillegg til den faktiske oppdagelsen av ruthenium , hadde han også oppdaget et element som han kalte polinium. Det viste seg imidlertid snart at funnet var urent iridium . På grunn av sin posisjon i det periodiske systemet , som ennå ikke var fullstendig kjent , ble oppdagelsen assosiert med teknetium.
Det neste antatte elementet antatt å være det som senere skulle bli teknetium, var ilmenium, oppdaget i 1846 . Om dette elementet , angivelig lik niob og tantal (det var sannsynligvis urent niob), ble oppdageren R. Hermann, 30 år etter oppdagelsen og tatt i betraktning det periodiske systemet, som siden har blitt oppfunnet, hevdet å være den manglende ekaen -mangan. Pelopium som angivelig ble funnet av Heinrich Rose i 1847 ble også forvekslet med technetium.
Den første falske oppdagelsen, der det manglende elementet med ordinalt nummer 43 faktisk ble søkt etter, var Davyum . I 1877 rapporterte den russiske kjemikeren at Serge kjernen oppdaget det manglende elementet i platina -Erz og ga det antatte elementet til den engelske kjemikeren Sir Humphry Davy ved navn Davyum . Funnet viste seg imidlertid å være en blanding av iridium , rodium og jern .
En annen antatt oppdagelse ble gjort i 1896 med Lucium , men det var yttrium . Til slutt konkluderte den japanske kjemikeren Masataka Ogawa fra en analyse av et mineral for tilstedeværelsen av nipponium (oppkalt etter Nippon , det japanske ordet for Japan ), som han mente var elementet med atomnummer 43. Senere analyser indikerte rhenium i stedet .
Feil bevis fra Noddack, Tacke og Berg
De tyske kjemikerne Walter Noddack , Ida Tacke og Otto Berg rapporterte om oppdagelsen av element 43 i 1925 og ga det navnet Masurium , avledet fra Masuria , hjemmet til Walter Noddack. På Physikalisch-Technische Reichsanstalt Berlin bombet gruppen mineralet columbite med en elektronstråle og konkluderte fra røntgenspektrene at element 43 var til stede. Det observerte signalet var imidlertid nær deteksjonsgrensen og kunne ikke reproduseres av andre arbeidsgrupper på den tiden. En forberedende ren representasjon - i samsvar med Mattauchs isobar-regel - var ikke vellykket . Funnet ble derfor ikke anerkjent. Så sent som i 1933 brukte en rekke artikler om oppdagelsen av elementene navnet Masurium for element 43.
I årene mellom 1988 og 2005 ble avvisningen av oppdagelsen gjentatte ganger satt i tvil. Fysikeren van Assche reviderte først den originale Noddacks-fotoplaten og kom til den konklusjonen at et bevis på naturlig forekommende technetium fra den spontane U-238-fisjonen i 1925 faktisk kunne ha vært vellykket. John T. Armstrong fra US National Institute of Standards and Technology simulerte senere eksperimentene med en datamaskin og kom til resultater som var sammenlignbare med Noddack, Berg og Tacke. Støtte kom fra et arbeid av David Curtis fra Los Alamos National Laboratory , som brukte metodene til Noddack, Tacke og Berg for å demonstrere den svært lave naturlige forekomsten av technetium. Debatten om den kontroversielle første oppdagelsen virket derfor kort åpen igjen. Litt senere ble den siste rapporten om en "rehabilitering" imidlertid trukket tilbake og de nylige feilene tydelig angitt. I mellomtiden hadde det blitt klart at deteksjonsgrensen for røntgenanalysemetoden til Noddacks ikke var tilstrekkelig til å registrere spor av teknetium.
Bevis fra Segrè og Perrier
I 1937, 66 år etter at Dmitri Mendeleev forutsa mange av egenskapene til technetium, ble elementet endelig bevist på en ubestridt måte. Emilio Segre og Carlo Perrier , både arbeids ved Universitetet i Palermo , isolert den nye element fra en deuteron- bombet molybden folie som Segre hadde mottatt i begynnelsen av året fra Ernest Lawrence av University of California, Berkeley , USA:
- Molybden omdannes til teknetium med deuteroner med nøytronutslipp .
Segrè og Perrier kåret det første kunstig produserte elementet etter det greske ordet τεχνητός (transkripsjon technētós ) for "kunstig" som technetium og svarte ikke på forespørsler fra de ansvarlige ved universitetet i Palermo, som i stedet kalte navnet etter det latinske ordet for Palermo , Hadde Panormus Panormium foreslått.
Nukleare medisin applikasjoner
Powell Richards publiserte den første studien om bruk av 99 m Tc (halveringstid 6 timer) i nuklearmedisin i juni 1960 . 99 m Tc oppnås fra de mer stabile 99 Mo (halveringstid 66 timer) ved hjelp av teknetium-99m generatorer . Den første metoden for økonomisk separasjon av 99 Mo og 99 m Tc ble utviklet på 1960-tallet av de amerikanske forskerne Walter Tucker og Margaret Green ved Brookhaven National Laboratory .
Hendelse
Fremmed forekomst
I 1952, den amerikanske astronomen Paul Willard Merrill pekte spektroskopisk i røde kjempestjerner av den S-; M- og N-klassene tilfører større mengder teknetium. Fordi disse stjernene er på slutten av utviklingen og er tilsvarende gamle, men den lengste halveringstiden til en technetiumisotop bare er litt mer enn 4 millioner år, var dette det første klare beviset for at teknetium og andre tunge elementer er produsert av kjernefusjon i stjerner oppstår. I hovedsekvensstjerner som solen er temperaturen inne i stjernen imidlertid ikke høy nok til syntese av grunnstoffer som er tyngre enn jern . Forhold som de som finnes i røde giganter er derfor avgjørende for syntesen av teknetium.
Jordisk forekomst
Helt siden et grunnstoff med atomnummer 43 ble antatt å eksistere, er det blitt søkt etter naturlige hendelser på jorden. Først i 1961 var det mulig å isolere omtrent 1 ng technetium fra 5,3 kg pitchblende fra Katanga i Afrika og å oppdage det spektrografisk. Den spontane fisjonen av 238 U-kjerner skaper elementet 43, hvorved 1 ng teknetium dannes fra 1 kg rent uran.
Alt teknetium som er naturlig tilstede på jorden er et midlertidig mellomprodukt av kjerneforfallet av tunge atomkjerner og forfaller seg igjen etter en stund. Forekomsten av dette elementet på jorden skal derfor ikke sidestilles med et stabilt element. Samlet sett er teknetiuminnholdet i jordskorpen bare litt høyere enn francium og astatin , begge er også radioaktive grunnstoffer som bare er tilstede på jorden i mikrogram.
I biosfæren forekommer teknetium utelukkende som et resultat av menneskelige aktiviteter. Over-bakken atomvåpenprøver produserte rundt 250 kg teknetium i atmosfæren fram til 1994, pluss rundt 1600 kg som ble frigitt fra opparbeidingsanlegg og atomreaktorer rundt om i verden frem til 1986 . Fra 1995 til 1999 ble omtrent 900 kg av metallet sluppet ut i Irskehavet fra anlegget i Sellafield i Storbritannia alene , men siden 2000 har lovens tillatte mengde vært begrenset til 140 kg per år.
Technetium kan bare oppdages i levende ting i unntakstilfeller, for eksempel hos hummer fra det sterkt forurensede Irske hav. Som regel finnes det bare i menneskekroppen hos pasienter som har gjennomgått en teknetiumbasert nuklearmedisinsk applikasjon.
Ekstraksjon og avhending
For medisinske formål oppnås vanligvis teknetium ved nøytronbombardering på 98 Mo:
De 99 Mo-kjernene oppløses i eksiterte (metastabile) 99 m Tc-kjerner mens de sender ut betastråling med en halveringstid på 2 dager og 19 timer :
I praksis er molybden ikke et element, men snarere i form av saltmolybdat (MoO 4 2− ) adsorbert på aluminiumoksydkolonner , utgangsmaterialet for produksjon av teknetium, slik at det ikke er elementært teknetium, men pertechnetationen (TcO 4 - ) som er laget i typiske konsentrasjoner på mellom 10 −6 og 10 −8 mol per liter. Dette blir først separert fra den gjenværende molybdat på sitt brukssted, før den kan reduseres til det rene element av hydrogengass H 2 i nærvær av egnede ligander , organiske stoffer som kombineres med technetium til å danne komplekser . Den kompleksbundet metastabile isotopen 99 m Tc endres på denne måten til grunntilstanden 99 Tc med en halveringstid på bare seks timer ved å avgi gammastråling :
Det er denne strålingen som brukes i medisinsk diagnostikk.
I tillegg produseres det flere tonn technetium hvert år i kjernefysiske reaktorer fra fisjonen av uranisotopen 235 U; de utgjør omtrent 6% av alle fisjonsprodukter av et brukt drivstoffelement. Den totale mengden metall som er produsert kunstig frem til begynnelsen av det 21. århundre er mer enn 78 tonn, noe som er langt over den naturlige forekomsten av teknetium.
Det meste av metallet som produseres av reaktoren danner bare uønsket radioaktivt avfall . Isotopen 99 Tc, som er ganske langvarig med en halveringstid på mer enn 200 000 år, og som er den dominerende strålekilden mellom rundt 10 000 og rundt 1 000 000 år etter generasjonen, må tas i betraktning når den lagres. For avhending, geologiske formasjoner som anses som stabile, slik som saltkupler, anses; Kritikere uttrykker imidlertid frykten for at elementet fortsatt kan vaskes ut av vann i miljøet. I tillegg vurderes også muligheten for transmutasjon , omdannelse av metallet til andre grunnstoffer gjennom nøytronbombardement.
For kommersiell bruk oppnås teknetium i kiloskala i opparbeidingsanlegg fra brukte kjernefysiske drivstoffstenger. For å gjøre dette, blir det først oksyderes til pertechnetat TcO 4 - og deretter separert fra uran, plutonium og andre forbindelser etter en nedbrytning periode på flere år i oppløst form ved ekstraksjon og ionebytteprosesser . Produktene ammonium pertechnetat NH 4 TcO 4 eller ammonium technetium -heksaklorid (NH 4 ) 2 TcCl 6 kan deretter reduseres til elementært technetium ved høye temperaturer ved termisk dekomponering i hydrogengass H- 2 . Alternativt kan metallet bli oppnådd ved elektrolyse av ammonium pertechnetat i svovelsyre (H 2 SO 4 ) anriket med hydrogenperoksid (H 2 O 2 ) .
eiendommer
Fysiske egenskaper
Technetium er et radioaktivt metall som virker matt grå i vanlig pulverform. Som et makroskopisk fast stoff har den derimot en sølvgrå farge og ligner dermed elementet platina . Karakteristiske spektrale linjer av technetiumatomer er ved 363, 403, 410, 426, 430 og 485 nanometer .
Både smelte- og kokepunktene på 2157 og 4265 ° C er mellom de tilsvarende verdiene til gruppen naboer mangan og rhenium . Technetium krystalliserer seg i det sekskantede krystallsystemet (sekskantet nærpakning av kuler, magnesiumtype ) i romgruppen P 6 3 / mmc (romgruppe nr. 194) med gitterparametrene a = 275,3 pm og c = 440 pm samt to formelenheter per celleenhet .
Metallisk technetium er litt paramagnetisk , dvs. dets magnetiske følsomhet Χ m er positiv, de magnetiske dipolene inne i materialet justeres parallelt med et eksternt magnetfelt og stoffet trekkes inn i det. Ved temperaturer under 7,7 Kelvin er det rene elementet en superleder av 2. type , så det mister sin elektriske motstand ; Imidlertid øker selv de minste urenhetene denne temperaturen til 11,2 Kelvin. Inntrengningsdybden til magnetfelt i superledende tilstand er den nest største av alle metaller for teknetium etter niob . Kjernemagnetisk resonansundersøkelser med teknetium er mulig på grunn av den høye følsomheten til isotopen 99 Tc.
Kjemiske egenskaper
I det periodiske systemet er teknetium i sin gruppe mellom de to grunnstoffene mangan og rhenium , men dets kjemiske egenskaper ligner bare sistnevnte.
Teknetiumatomet har syv valenselektroner , to av dem i 5s orbital , de resterende fem i 4d orbital, maksimal oksidasjonstilstand er derfor + VII. De første tre ioniseringsenergiene på 702, 1472 og 2850 kilojoule per mol (kJ / mol) er alle under de tilsvarende verdiene til den lettere gruppen nabo , mangan , som kvalitativt kan tilskrives den større avstanden mellom valenselektronene og kjernen og deres reduserte elektriske samhandlingsenergi. Spesielt er forskjellen mellom den andre og tredje ioniseringsenergien på 1378 kJ / mol signifikant mindre enn den for mangan på 1739 kJ / mol. I motsetning til dette elementet, hvis kjemi hovedsakelig er det med det dobbelt positivt ladede Mn 2+ ionet, blir technetium ofte funnet i andre oksidasjonstilstander. De viktigste er + IV, + V og + VII, i tillegg til at det er forbindelser der technetium har oksidasjonstallet −I, 0, + I, + III eller + VI, mens + II-tilstanden så karakteristisk for mangan bare sjelden forekommer.
I fuktig luft sverter metallet sakte på grunn av oksidasjon . I tillegg til å være brannfarlig, er pulverformen generelt mer reaktiv og kombinerer voldsomt med halogener . Technetium bare oppløses i oxyderende syrer som konsentrert svovelsyre (H 2 SO 4 ) eller salpetersyre (HNO 3 ), men ikke i saltsyre (HCl (aq) ) eller hydrofluorsyre (HF (aq) ); Metallet er stabilt i gassformet klor og hydrogenfluorid .
Isotoper
Så langt er 34 isotoper med massetall mellom 85 og 118 kjent for technetium . Den lengstlevende av disse er 98 Tc med en halveringstid på 4,2 millioner år , etterfulgt av 97 Tc med en halveringstid på 2,6 millioner år og 99 Tc med en halveringstid på 211 100 år. Sistnevnte er også den vanligste og økonomisk viktigste isotopen, og med en aktivitet på 620 millioner Becquerel per gram , frigjør den en myk beta-stråling av energien 293,6 kiloelektron volt (keV).
Forfallsmekanismen for isotoper med massetall under 98 er elektronfanging , slik at molybdenisotoper dannes; med tyngre technetiumisotoper, forekommer imidlertid beta- forfall og dannelsen av ruthenium-isotoper . Det eneste unntaket er 100 Tc, som kan passere inn i et annet element via begge dekomponeringsveiene.
I tillegg til isotoper, som er differensiert med antall nøytroner, er det en rekke eksiterte, metastabile tilstander som 95 m Tc, 97 m Tc og 99 m Tc, som med halveringstider på (i denne rekkefølgen) 61 dager, 90 dager og 6,01 timer i tilhørende bakketilstand passerer. Den viktigste metastabile isotopen er 99 m Tc, som spiller en viktig rolle i nuklearmedisin .
Ustabiliteten til technetium kan forklares med kjernefysikk ved at atomnummeret er merkelig, og de nærliggende elementene molybden og ruthenium har veldig mange stabile isotoper ( Mattauchs isobar-regel ).
bruk
Bare små mengder teknetium brukes økonomisk; Den største andelen brukes i medisin som en komponent i radiofarmaka , men den brukes også som korrosjonsbeskyttelse og som en beta-strålingskilde.
Atommedisin
På grunn av sin korte halveringstid, den utstrålte gammastrålingen med en energi på 140 keV og dens evne til å feste seg til mange aktive biomolekyler , er metastabile 99 m Tc den klart viktigste nukliden som brukes som sporstoff for scintigrafisk , dvs. bildeskapende , undersøkelser av nukleærmedisin . For dette formål blir organiske ligander med høy tendens til å binde seg til celler i organet som skal undersøkes, eller monoklonale antistoffer , proteiner i immunsystemet som fester seg til utvalgte antigener av tumorceller, koblet til technetium og injisert intravenøst i pasientens blod . Metallet konsentreres på denne måten i de ønskede organer og vev eller svulsten som skal undersøkes; den karakteristiske gammastråling kan da med thallium dopede natriumjodid - detektorer registrert og for ikke-invasiv diagnose, slik som det merkede antistoff ved hjelp av tumoren, blir brukt. På denne måten kan hjernen , skjoldbruskkjertelen , lungene , leveren , galleblæren , milten , nyrene , beinvevet , men også deler av tarmen som er vanskelig tilgjengelige, undersøkes. Koblingen av technetiumtinnforbindelser til erytrocytter , de røde blodcellene, muliggjør en diagnose av sykdommer i blodkarsystemet; Binding av technetium -pyrofosfater til kalkavleiringer i hjertemuskelvevet er brukt i diagnostisering av hjerteinfarktpasienter.
Den høyenergiske gammastrålingen fra 99 m Tc muliggjør lav dosering. Etter undersøkelsen utskilles det meste av teknetium som absorberes under en nuklearmedisinsk diagnose. De resterende 99 m Tc brytes raskt ned til 99 Tc. Dette har en lang halveringstid på 212 000 år, og på grunn av den relativt myke betastrålingen som frigjøres når den forfaller, bidrar den bare til en liten ekstra strålingseksponering i løpet av den gjenværende levetiden. I USA er diagnostiske formål omtrent syv millioner individuelle doser per år for 99 m administrert Tc.
Technetium for nukleærmedisin er vanligvis hentet fra technetium-99m generatorer på grunn av den korte 6-timers halveringstiden . Imidlertid er det bare fem reaktorer i verden der molybden-99 blir oppnådd som modernuklid av technetium-99 (tre i Europa, en i Sør-Afrika og en i Canada). På grunn av den høye alderen til de fleste av disse reaktorene og de tekniske problemene knyttet til dem, har det nylig oppstått flere reaktorfeil, noe som har begrenset produksjonen av teknetium sterkt. I mellomtiden (mai 2010) er det frykt i nuklearmedisin at disse reaktorproblemene snart kan føre til en alvorlig mangel på isotopen, noe som er viktig for tumordiagnose.
Andre bruksområder
Den ikke-eksiterte isotopen 99 Tc i seg selv brukes som en økonomisk levedyktig kilde for betastråler . Det gir fordelen at ingen gammastråling oppstår når den forfaller, slik at bare relativt små sikkerhetsforholdsregler er nødvendige.
I tillegg er teknetium i form av salter en av de beste rusthemmere: ammonium eller kaliumperteknetat kan brukes som korrosjonsbeskyttelse for stål . En tilsetning av 55 ppm (milliontedeler av en del) kaliumperteknetat (KTcO 4 ) i luftet avionisert vann beskytter dette materialet mot korrosjon opp til en temperatur på 250 ° C. På grunn av radioaktiviteten til teknetium er dets potensielle anvendelse begrenset til systemer som er isolert fra miljøet, for eksempel reaktorer med kokende vann .
Pertechnetates fungerer som viktige utgangsmaterialer innen teknetiumkjemi og spiller også en viss rolle som katalysatorer i uorganisk kjemi.
Forbindelser og reaksjoner
→ Kategori: Technetiumforbindelse
I motsetning til mangan danner technetium knapt noen kationer . I denne forbindelse, så vel som i sin lavere reaktivitet og i evnen til å inngå kovalente bindinger, ligner den den andre gruppen nabo, rhenium. I motsetning til dette er imidlertid de høye oksidasjonstilstandene noe mindre motstandsdyktige mot reduksjon, overgangen til en lavere oksidasjonstilstand gjennom (formell) opptak av elektroner.
Hydrido kompleks
Når technetium reagerer med hydrogen , dannes det anioniske , dvs. negativt ladede hydridokomplekset [TcH 9 ] 2− , hvis sentrale technetiumatom ligger i et trigonal prisme av hydrogenatomer, som vist motsatt; det er også et annet hydrogenatom hver vinkelrett på midten av de tre sideflatene. Ladningen kan balanseres, for eksempel med to natrium- (Na + ) eller to kalium- (K + ) -ioner .
Oksider
Det er to forskjellige teknetiumoksider (TcO 2 og Tc 2 O 7 ). Ved temperaturer på rundt 400–450 ° C reagerer metallet direkte med oksygen for å danne blekgult ditechnetiumheptoksid:
Molekylet består av to technetium-atomer forbundet med hverandre via et oksygenatom, som i sin tur er bundet til de gjenværende oksygenatomer med tre dobbeltbindinger og er anhydrid av den pertechnetic syre HTCO 4 , som dannes når oksydet oppløses i vann.
Det svarte technetiumdioksidet (TcO 2 ) kan produseres ved å redusere ditechnetium heptoxide med elementært technetium eller hydrogen.
Pertechnetic syre
Pertechnetic syre (HTCO 4 ) er dannet når technetium heptoxide oppløses i vann eller technetium i oksyderende syrer så som salpetersyre , konsentrert svovelsyre eller kongevann , en blanding av salpetersyre og saltsyre. Den mørkerøde, vanntiltrekkende (hygroskopiske) substansen er en av de sterke syrene og er sterkt dissosiert i vann , så protonen overføres nesten alltid til et vannmolekyl.
Den gjenværende perteknetatanionen TcO 4 - består av et technetiumatom, som ligger i midten av et tetraeder , ved de fire hjørnene som oksygenatomene befinner seg i. I motsetning til permanganatet ion MnO 4 - det er forholdsvis stabil overfor reduksjon, slik at farveløse salter så som kalium (KTCO 4 ) eller ammonium-pertechnetat (NH 4 TCO 4 ) er bare forholdsvis svake oksydasjonsmidler . Natrium , magnesium og kalsiumperteknat er bra, barium og ammoniumperteknat er moderat, mens kalium og talliumperteknat bare er lett oppløselig i vann.
Pertechnetate kan reduseres til technetate [TcO 4 ] 2− (lilla) ved å bruke et reduksjonsmiddel .
Halogenider og oksidhalogenider
I tillegg til teknetiumhalogenidene hvor teknetium er bundet til halogenatomer , er det kjent mange teknetiumoksidhalogenider der, i tillegg til halogenatomer, også oksygen er bundet.
De to fluorforbindelser, den gule technetium pentafluoride (TCF 5 ) og technetium heksafluorid (TCF 6 ) av den samme farge, er dannet ved direkte reaksjon av utgangsmaterialene . De to klorforbindelser, den grønne technetium-heksaklorid (TcCl 6 ) og den røde technetium tetrakloridet (TcCl 4 ), kan også syntetiseres direkte . Sistnevnte er paramagnetisk, og er i polymerisert form, dvs. som en kjede av TcCl 4 subenheter i en rad , og kan også fremstilles ved omsetning av technetium heptoxide (Tc 2 O 7 ) med karbontetraklorid (CCl 4 ). Viktige salter av teknetiumhalogenid dannes av de to anionene [Tc 2 Cl 8 ] 2− og [TcCl 8 ] 3− . Den viktigste bromforbindelsen er det rødbrune teknetiumtetrabromidet TcBr 4 , og det er også anionet [Tc 2 Br 8 ] 2− .
Den Technetiumoxidhalogenide er fluorforbindelser Technetiumfluoridtrioxid TcO 3 F, Technetiumtrifluoriddioxid TcO 2 F 3 , Technetiumpentafluoridoxid TCOF 5 og Technetiumtetrafluoridoxid TCOF 4 , karakterisert ved at metallet i de oksydasjonstilstander + VII og + VI oppstår klorforbindelser Technetiumchloridtrioxid TcO 3- Cl, Technetiumtetrachloridoxid TcOCl 4 og technetium trikloridoksid TcOCl 3 med oksidasjonstilstandene + VII, + VI og + V og for brom og jod har de analoge forbindelsene teknetiumbromidtrioksid TcO 3 Br og teknetiumjodidtrioksid TcO 3 I. Med sistnevnte stoffer har det sentrale technetiumatomet maksimalt oksidasjonsnummer + VII. Technetium-trifluorid dioksyd TcO 2 F 3 , som technetium-triklorid oksid TcOCl 3 og technetium-bromid oksid TcOBr 3, er i polymerisert form.
Alle halogen-oksygenforbindelser i teknetium nedbrytes lett ved kontakt med vann til perteknetat og teknetiumdioksid. Spesielt sterkt fluorerte forbindelser slik som technetium pentafluoride oksid TcOF 5 kan bare fremstilles ved hjelp av sterke fluoreringsmidler, slik som xenon heksafluorid Xef 6 eller krypton-difluorid KrF 2 , som følgende reaksjonstrinn viser ved hjelp av et eksempel:
- Ditechnetium heptoxide reagerer med hydrogenfluorid for å danne technetium fluoride trioxide, oxoniumioner og hydrogendifluoride (-1).
- Teknetiumfluoridtrioksid reagerer med xenonheksafluorid og danner teknetiumtrifluordioksid og xenontetrafluoridoksid.
- Technetium trifluoride dioksid reagerer med kryptondifluorid for å danne technetium pentafluoride oksid, elementært krypton og oksygen.
Sulfider, selenider, tellurider
Technetium danner to forskjellige sulfider med svovel . Mens technetium disulfid TCS- 2 fremstilles ved direkte omsetning av utgangsmaterialene, den sorte ditechnetium heptasulfide Tc 2 S 7 kan representeres som følger:
- Pertechnetic syre reagerer med hydrogensulfid og danner ditechnetium heptasulfide og vann.
I dette tilfellet reduseres ikke technetium , i motsetning til i den analoge reaksjonen av mangan, der det stabile Mn 2+ ionet dannes fra MnO 4 - . Termisk nedbrytning av heptasulfid fører til en nedbrytning i disulfid og elementært svovel:
Med selen og tellur danner teknetium de analoge stoffene til teknetiumdisulfid, dvs. technetiumdiselenid (TcSe 2 ) og technetium ditellurid (TcTe 2 ).
Klynge
Det er to viktige technetium- klynger , Tc 6 og Tc 8- klyngen. I begge er to technetiumatomer knyttet til hverandre ved en trippelbinding. Disse parene er ordnet parallelt med hverandre og bundet til hverandre vinkelrett på justeringen av trippelbindingen, slik at posisjonen til enkeltbindingene resulterer i to parallelle ligesidige trekanter for Tc 6- klyngen og to parallelle firkanter for Tc 8- klyngen . I sistnevnte tilfelle er en ekstra enkeltbinding justert langs en diagonal av disse rutene. Technetiumatomer fra begge klynger danner alle seks bindinger; Manglende bindinger kan oppfylles av halogenatomer som klor eller brom.
Komplekse forbindelser
Technetium er en del av mange komplekse forbindelser som har blitt relativt godt undersøkt på grunn av elementets betydning for nukleærmedisin.
Et eksempel er technetium Tc-komplekset karbonyl 2 (CO) 10 , som danner et hvitt, fast stoff. Den inneholder to teknetiumatomer som er svakt bundet til hverandre og er omgitt av fem karbonylligander hver i oktaedrisk symmetri , som man kan se på motsatt side . Bindelengden på 303 pm er karakteristisk større enn avstanden mellom to nærliggende atomer i metallisk technetium. Isostrukturelle komplekser, dvs. de med samme struktur, finnes også i de to nærliggende elementene mangan og rhenium. Et teknetiumkarbonylkompleks der teknetium forekommer i negativ oksidasjonstilstand −I er [Tc (CO) 5 ] - , mens det oktaedriske akvakomplekset [Tc (H 2 O) 3 (CO) 3 ] + dannes i vann .
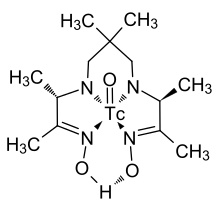
Et eksempel på et kompleks med en organisk ligand som brukes i praksis i bildebehandlingsprosesser i nuklearmedisin er gitt nedenfor og er preget av et technetiumatom som ligger i sentrum av en karbon - nitrogenkjede og koblet via fire nitrogenatomer, som er karakterisert ved en dobbeltbinding er bundet til et oksygenatom. I de såkalte nitridokompleksene kan denne teknetium-oksygen-enheten erstattes av en teknetium-nitrogen-enhet der det er en trippelbinding mellom et nitrogen og et technetiumatom.
sikkerhetsinstruksjoner
Klassifisering i henhold til CLP-forskriften er ikke tilgjengelig fordi de bare inkluderer kjemisk fare og spiller en underordnet rolle sammenlignet med farene basert på radioaktivitet . Sistnevnte gjelder også bare hvis mengden stoff som er involvert er relevant.
Forholdsregler
I følge kunnskapen til dags dato har technetium bare lav kjemisk toksisitet . Alle isotoper av elementet er radioaktive og må lagres i strålebeskyttelsesbeholdere i henhold til deres strålingsintensitet og merkes som radioaktivt materiale. Betastrålingen til den vanligste isotopen, 99 Tc, er allerede stoppet av glass; stråleeksponeringen fra den myke røntgenstrålingen som frigjøres som bremsstrahlung anses å være lav hvis en sikkerhetsavstand på 30 centimeter opprettholdes. Teknetiumstøv som inhaleres og legger seg i lungene, øker derimot risikoen for kreft. Laboratoriearbeid må derfor foregå under avtrekksvifte ; I tillegg anbefales øyevern og bruk av hansker.
litteratur
- Klaus Schwochau: Technetium: Kjemi og radiofarmaka. Wiley-VCH, Weinheim 2000, ISBN 3-527-29496-1 .
- CE Housecroft, AG Sharpe: Uorganisk kjemi. 2. utgave. Pewson / Prentice Hall, 2005, ISBN 0-13-039913-2 , kapittel 22.8a, s. 666.
- RB King (red.): Encyclopedia of Inorganic Chemistry. Volum 8, Wiley, 1994, ISBN 0-471-93620-0 , s. 4094.
- Eric Scerri : En fortelling om syv elementer , Oxford University Press, Oxford, 2013
weblenker
Individuelle bevis
- ↑ Harry H. Binder: Leksikon av de kjemiske elementene. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Verdiene for eiendommene (infoboks) er hentet fra www.webelements.com (Technetium) , med mindre annet er oppgitt .
- ↑ a b c d e entry on technetium in Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Red.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Hentet 11. juni 2020.
- ↑ a b c d e entry on technetium at WebElements, https://www.webelements.com , åpnet 11. juni 2020.
- ^ NN Greenwood, A. Earnshaw: Elementets kjemi. 1. utgave. VCH, Weinheim 1988, ISBN 3-527-26169-9 , s. 1339.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, s. 4-142-4-147. Verdiene der er basert på g / mol og er gitt i cgs-enheter. Verdien gitt her er SI-verdien beregnet ut fra den, uten en måleenhet.
- ↑ Farene som følger av radioaktivitet hører ikke til egenskapene som skal klassifiseres i henhold til GHS-merkingen. Når det gjelder andre farer, har dette elementet ennå ikke blitt klassifisert, eller en pålitelig og sitabel kilde har ennå ikke blitt funnet.
- ↑ a b c B. T. Kenna: The Search for Technetium in Nature. I: Journal of Chemical Education . 39 (2), 1962, s. 436-442; doi: 10.1021 / ed039p436 .
- ^ A b Norman E. Holden: Historie om kjemiske elementers opprinnelse og deres oppdagere. Brookhaven National Laboratory; Hentet 5. mai 2009.
- ^ Frederik AA de Jonge, Ernest KJ Pauwels: Technetium, det manglende elementet. I: European Journal of Nuclear Medicine . 23 (3), 1996, s. 336-344; doi: 10.1007 / BF00837634 .
- ↑ Serge-kjerne: LE NOUVEAU MÉTAL "LE DAVYUM". I: La Nature . Nr. 234, 24. november 1877, s. 401-402.
- Y HK Yoshihara: Oppdagelse av et nytt element 'nipponium': revaluering av banebrytende verk av Masataka Ogawa og hans sønn Eijiro Ogawa. I: Spectrochimica Acta Del B: Atomic Spectroscopy . 59 (8), 2004, s. 1305-1310; doi: 10.1016 / j.sab.2003.12.027 .
- ↑ Hans Zettler: Masurium - et navn som ingen nevner lenger. Hvorfor element 43 kalles technetium. Rehabilitering av W. Noddack og I. Tacke. I: FAZ . 22. februar 1989.
- ^ A b Peter van der Krogt: Elementymology and Elements Multidict, "Technetium". Hentet 5. mai 2009 .
- ^ A b John T. Armstrong: Technetium. I: Chemical & Engineering News. 2003.
- ↑ Kevin A. Nies: Ida Tacke og krigføring bak oppdagelsen av fisjon. 2001, åpnet 5. mai 2009.
- ^ Mary Elvira Uker: Oppdagelsen av elementene, XX: Nylig oppdagede elementer. I: Journal of Chemical Education . 10, 1933, s. 161-170; doi: 10.1021 / ed010p161 .
- ^ Pieter HM Van Assche: Den ignorerte oppdagelsen av elementet Z = 43 ; Nuclear Physics A , 1988, 480 (2), s. 205-214; doi: 10.1016 / 0375-9474 (88) 90393-4 .
- ^ Roberto Zingales: Fra Masurium til Trinacrium: The Troubled Story of Element 43. I: Journal of Chemical Education . 82, 2005, s. 221-227; doi: 10.1021 / ed082p221 .
- ^ Fathi Habashi: The History of Element 43 - Technetium og svar av Roberto Zingales i: Journal of Chemical Education . 83, 2006, s. 213; doi: 10.1021 / ed083p213.1 .
- ^ PK Kuroda: En merknad om oppdagelsen av Technetium ; Nuclear Physics A , 1989, 503 , s. 178-182; doi: 10.1016 / 0375-9474 (89) 90260-1 .
- ^ Günter Herrmann: Technetium eller masurium - en kommentar til historien til element 43 ; Nuclear Physics A , 1989, 505 , s. 352-360; doi: 10.1016 / 0375-9474 (89) 90379-5 .
- ^ A b c John Emsley: Nature's Building Blocks: An AZ Guide to the Elements. Oxford University Press, New York 2001, ISBN 0-19-850340-7 , s. 422-425.
- ^ C. Perrier, E. Segrè: Technetium: Element of Atomic Number 43. I: Nature . 159, 1947, s. 24; doi: 10.1038 / 159024a0 .
- ^ S. Paul, W. Merrill: Spectroscopic Observations of Stars of Class S. I: The Astrophysical Journal . 116, 1952, s. 21-26; doi: 10.1086 / 145589 .
- ↑ a b K. Schwochau: Technetium: Chemistry and Radiopharmaceuticals. 2000, s. 7-9.
- ↑ a b c David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, s. 4-35.
- ^ Charlotte E. Moore: Technetium in the Sun. I: Vitenskap . 114, nr. 2951, 1951, s. 59-61; doi: 10.1126 / science.114.2951.59 ; PMID 17782983 .
- ^ Paul Dixon, David B. Curtis, John Musgrave, Fred Roensch, Jeff Roach, Don Rokop: Analyse av naturlig produsert teknetium og plutonium i geologiske materialer. I: Analytisk kjemi . 69 (9), 1997, s. 1692-1699; doi: 10.1021 / ac961159q .
- ↑ D. Curtis: Naturens uvanlige elementer: plutonium og technetium. I: Geochimica et Cosmochimica Acta . 63 (2), 1999, s. 275-285; doi: 10.1016 / S0016-7037 (98) 00282-8 .
- ↑ a b c d K. Yoshihara: Technetium in the Environment. I: K. Yoshihara, T. Omori (red.): Technetium and Rhenium - Deres kjemi og dens applikasjoner. (= Emner i nåværende kjemi . Vol. 176). Springer-Verlag, Berlin / Heidelberg 1996, ISBN 3-540-59469-8 .
- ↑ Keiko Tagami: Technetium-99 Behavior in the Terrestrial Environment - Field Observations and Radiotracer Experiments. ( Memento fra 16. juli 2011 i Internet Archive ) I: Journal of Nuclear and Radiochemical Sciences . 4, 2003, s. A1-A8.
- ↑ John D. Harrison, Alan Phipps: Tarmoverføring og doser fra miljøteknetium. I: J. Radiol. Prot. 21, 2001, s. 9-11; doi: 10.1088 / 0952-4746 / 21/1/004 .
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Atomic, Molecular, and Optical Physics, s. 10-75.
- ↑ K. Schubert: En modell for krystallstrukturene til de kjemiske elementene. I: Acta Crystallographica B . 30, 1974, s. 193-204; doi: 10.1107 / S0567740874002469 .
- ↑ a b c S. J. Rimshaw: The Encyclopedia of the Chemical Elements . Red.: Cifford A. Hampel. Reinhold Book Corporation, New York 1968, s. 689-693 .
- ^ SH Autler: Technetium som et materiale for AC-superledningsapplikasjoner. I: Proceedings of the 1968 Summer Study on Superconducting Devices and Accelerators. åpnet 5. mai 2009 (PDF)
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s.96.
- ↑ a b Technetium, Nuclides / Isotopes. Hentet 5. mai 2009 .
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Nuclear and Particle Physics, s. 11-106.
- ↑ K. Schwochau: technetium radiofarmasøytika: Fundamentals, syntese, struktur og utviklings. I: Angewandte Chemie International Edition . 33 (22), 1994, s. 2258-2267; doi: 10.1002 / anie.199422581 .
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s. 414.
- ^ A b Joseph F. Smith: Technetium hjerteskanning. ( Minne 8. september 2002 i Internet Archive )
- ↑ Jonathan R. Dilworth, Suzanne J. Parrott: Den biokjemiske kjemi technetium og rhenium. I: Chemical Society Reviews . 27, 1998, s. 43-55; doi: 10.1039 / a827043z .
- ↑ Flaskehalser i svulstmedisin. Kreftleger går tom for diagnostiske verktøy. I: Der Spiegel. 11. mai 2010.
- ^ Norbert Lossau: Kreftdiagnose: Det er en trussel om mangel på teknetium-99. I: welt.de . 2. august 2017, åpnet 7. oktober 2018 .
- ↑ EPA: 402-b-04-001b-14-finale. (PDF; 1,6 MB) Marlap, juli 2004, åpnet 4. august 2008 .
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s.91.
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s. 127-136.
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s. 104.
- ↑ B. Krebs: Technetium (VII) oksyd: En overgangsmetall-oksyd med en molekylstruktur i fast tilstand. I: Angewandte Chemie . 81 (9), 1969, s. 328-329; doi: 10.1002 / anie.19690810905 .
- ^ AY Herrell, RH Busey, KH Gayer, K. Schwochau, S. Gutzeit: Technetium (VII) Oxide. I: Uorganiske synteser . Vol. XVII, 1977, ISBN 0-07-044327-0 , s. 155-158; doi: 10.1002 / 9780470132487.ch41 .
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s. 108.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Lærebok for uorganisk kjemi . 102. utgave. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1623.
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s. 112-113.
- ↑ KE German, SV Kryutchkov: Polynuclear technetium Halide-klynge. I: Russian Journal of Inorganic Chemistry . 47 (4), 2002, s. 578-583.
- ↑ JC Hileman, DK Huggins, HD Kaesz: teknetiumkarbonyl. I: Journal of the American Chemical Society . 83 (13), 1961, s. 2953-2954; doi: 10.1021 / ja01474a038 .
- ^ Marcia F. Bailey, Lawrence F. Dahl: Krystallstrukturen til Ditechnetium Decacarbonyl. I: Uorganisk kjemi . 4 (8), 1965, s. 1140-1145; doi: 10.1021 / ic50030a011 .
- ^ D. Wallach: Enhetscelle og romgruppe av teknetiumkarbonyl, Tc 2 (CO) 10 . I: Acta Crystallographica . 15, 1962, s. 1058-1058; doi: 10.1107 / S0365110X62002789 .
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s. 286, 328.
- ↑ Silva Jurisson, EO Schlemper, DE Troutner, LR Canning, DP Nowotnik, RD Neirinckx: Syntese, karakterisering og røntgenstrålestrukturbestemmelser av technetium (V) -oxo-tetradentat aminoksimkomplekser. I: Uorganisk kjemi . 25 (4), 1986, s. 543-549; doi: 10.1021 / ic00224a031 .
- ↑ K. Schwochau: Technetium: Kjemi og Radiofarmaka. 2000, s. 40.






![\ mathrm {^ {99} _ {39} Y \ \ xrightarrow [1 {,} 47 \, s] {\ beta ^ {-}} \ ^ {99} _ {40} Zr \ \ xrightarrow [2 {, } 1 \, s] {\ beta ^ {-}} \ ^ {99} _ {41} Nb \ \ xrightarrow [15 {,} 0 \, s] {\ beta ^ {-}} \ ^ {99} _ {42} Man \ \ xrightarrow [65 {,} 94 \, h] {\ beta ^ -} \ ^ {99} _ {43} Tc \ \ xrightarrow [211100 \, a] {\ beta ^ {-} } \ ^ {99} _ {44} Ru}](https://wikimedia.org/api/rest_v1/media/math/render/svg/70963d83d65b0763fa88e9b7f7880a3fbe0762c3)