salpetersyre
| Strukturell formel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Generell | ||||||||||||||||
| Etternavn | salpetersyre | |||||||||||||||
| andre navn |
|
|||||||||||||||
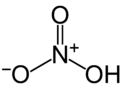
| Molekylær formel | ØNH 3 | |||||||||||||||
| Kort beskrivelse |
i sin rene form fargeløs væske, delvis nedbrutt av lys eller varme til nitrogenoksider med gul til rød farge |
|||||||||||||||
| Eksterne identifikatorer / databaser | ||||||||||||||||
| ||||||||||||||||
| eiendommer | ||||||||||||||||
| Molarmasse | 63,01 g mol −1 | |||||||||||||||
| Fysisk tilstand |
væske |
|||||||||||||||
| tetthet |
1,51 g cm −3 (20 ° C) |
|||||||||||||||
| Smeltepunkt |
−42 ° C |
|||||||||||||||
| kokepunkt |
86 ° C |
|||||||||||||||
| Damptrykk |
56 hPa (20 ° C) |
|||||||||||||||
| p K S- verdi |
−1.37 |
|||||||||||||||
| løselighet |
Blandbar med vann i alle proporsjoner, voldsom reaksjon med etanol |
|||||||||||||||
| sikkerhetsinstruksjoner | ||||||||||||||||
| ||||||||||||||||
| MAK |
|
|||||||||||||||
| Toksikologiske data | ||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . | ||||||||||||||||
Salpetersyre (HNO 3 ), også kjent som septisk væske , er den mest kjente og mest stabile oksygensyren av nitrogen . Syren har blitt produsert i industriell skala siden 1908 ved hjelp av Ostwald-prosessen ved katalytisk oksidasjon av ammoniakk. Ammoniakken ble tidligere produsert av atmosfærisk nitrogen og hydrogen ved hjelp av Haber-Bosch-prosessen .
De salter av salpetersyre kalles nitrater . Navnet salpetersyre er avledet fra de vanlige navnene på noen alkaliske og jordalkaliske salter av syren, som ender med navnet salpetersyre som f.eks. F.eks. Natriumnitrat (Chile nitrat), kaliumnitrat (pottaske nitrat), ammoniumnitrat ( ammonium nitrat), kalsiumnitrat (kalk nitrat eller Mason -nitrat ), bariumnitrat (barytt nitrat ). Fram til 1908 ble salpetersyre oppnådd fra de forskjellige typer salpetersyre ved å tilsette en sterk, lite flyktig syre (svovelsyre). Navnet på salter av salpetersyre nitrater blir svært ofte brukt for å navngi noen organiske forbindelser med salpetersyre - nemlig estere av salpetersyre. Så z. For eksempel kalles metylesteren av salpetersyre metylnitrat (se også nitrater ), selv om bindingsforholdene i estrene er helt forskjellige fra de i salter. Å komplisere situasjonen og øke forvirringen er det faktum at noen spesielle estere av salpetersyre verken riktig blir referert til som estere eller feilaktig som nitrater på dagligspråket. B. Nitroglyserin (riktig navn: tris-salpetersyre-glyserolester) eller nitrocellulose eller cellulosenitrat .
Som en sterk uorganisk syre blir salpetersyre i stor grad dissosiert i vandig løsning og er en av mineralsyrene . Den rene syren er fargeløs og har en skarp, skarp lukt. Den brukes blant annet til å produsere gjødsel, fargestoffer og eksplosiver.
historie
I skrivingen De invente veritatis fra 1100-tallet nevnes det at allerede den 9. århundre brukte den arabiske alkymisten Geber rå salpetersyre ("Aqua dissolutiva") ved tørr oppvarming av saltpeter ( lat. Sal petrae = bergsalt; KNO 3 ), Cyprian Vitriol (CUSO 4 · 5 H 2 O) og alun (KAL (SO 4 ) 2 · 12 H 2 O) er sagt å ha blitt oppnådd. På 1200-tallet skal Albertus Magnus ha brukt salpetersyre til å skille gull og sølv (skille vann, aqua fortis ). Imidlertid ble mange skrifter tilskrevet Albertus Magnus bare for å gi dem større vekt, sannsynligvis inkludert de som brukte salpetersyre. Senere, salpeter ble oppvarmet med jern vitriol (FeSO 4 · 7 H 2 O), noe som ga høyere utbytter ved lavere temperaturer.
På midten av 1600-tallet oppnådde JR Glauber ren spiritus nitri ved å omdanne og destillere salpetersyre med svovelsyre , en laboratorieprosess som fortsatt brukes i dag for produksjon av salpetersyre, som i middelalderen også ble kalt aqua fortis eller aqua valens og ble i den engelsktalende verden kalt sterkt vann . I midten av 1700-tallet anerkjente AL Lavoisier de kjemiske elementene nitrogen og oksygen som komponenter i salpetersyre . Den nøyaktige sammensetningen ble bestemt av Henry Cavendish , som også lyktes i å syntetisere den fra nitrogenet i luften ved hjelp av elektrisk utladning .
Effektiv produksjon begynte ikke før på begynnelsen av 1800-tallet, da billig svovelsyre og Chile-nitrat var tilgjengelig i tilstrekkelige mengder. Forbrenning av luft i en elektrisk lysbue ble også utviklet til en storstilt prosess ( Birkeland-Eyde-prosessen , etter Kristian Birkeland og Sam Eyde ), men den var bare konkurransedyktig i land med billig strøm . Den katalytiske oksidasjonen av ammoniakk over platina ble oppdaget av CF Kuhlmann (1838). Inntil oppfinnelsen av ammoniakk-syntese av Haber og Bosch , forble ammoniakk imidlertid for dyrt sammenlignet med Chiles nitrat. På begynnelsen av 1900-tallet utviklet Wilhelm Ostwald produksjonen av salpetersyre fra ammoniakk til industriell modenhet. Den billige ammoniakkoksidasjonen har nå erstattet alle andre store prosesser.
Produksjon

Salpetersyre har blitt produsert teknisk siden 1908 ved hjelp av Ostwald- prosessen. Det er den katalytiske oksidasjonen av ammoniakk . Ammoniakk-luft-blandingen føres raskt (1/1000 s kontakttid) gjennom varme platina - rodium- nettverk ( katalysator ). Ved 800 ° C dannes nitrogenmonoksid , som når det avkjøles, reagerer med overflødig oksygen for å danne nitrogendioksid og deretter i dryppetårn med vann for å danne rundt 60% salpetersyre. 60% salpetersyre kan konsentreres ved destillasjon opp til 68%, noe som tilsvarer azeotropen med et kokepunkt maksimalt (122 ° C). Høyere konsentrasjoner kan oppnås ved likeretting (dehydratisering) med svovelsyre (H 2 SO 4 ) eller med vandig magnesiumnitratløsning (Mg (NO 3 ) 2 ), eller ved behandling av nitrøse tetroksyd (N 2 O 4 ) med den støkiometrisk nødvendige mengde oksygen (eller luft) og vann.
På laboratorieskala kan salpetersyre produseres ved å reagere konsentrert svovelsyre med nitrater . Før 1908 ble salpetersyre oppnådd ved denne prosessen ved bruk av natriumnitrat ( Chiles nitrat ).
Ofte forurensning av syren med halogener eller hydrogenhalogenider kan fjernes ved å tilsette sølvnitrat og påfølgende destillasjon. Vannfri salpetersyre oppnås med utgangspunkt i en syre som er sterkt konsentrert ved destillasjon, ved å passere gjennom inert gass eller ved destillasjon over fosforpentoksyd eller oleum .
eiendommer
Salpetersyre er fargeløs i ren tilstand. Konsentrert salpetersyre brytes imidlertid lett ned (spesielt når det utsettes for lys) og har ofte en gulaktig eller rødaktig fargetone på grunn av nitrogendioksydet (NO 2 ) oppløst i den .
Ren salpetersyre som inneholder gratis nitrogendioksid kalles fuming salpetersyre. Den inneholder over 90% HNO 3 , har en sterk oksidasjonseffekt og kan antenne noen meget brannfarlige stoffer; derfor betraktes salpetersyre fra 70% som oksiderende . Salpetersyre, som er farget gul av oppløst nitrogendioksid, kan misfarges av en liten mengde urea eller, bedre, ureanitrat .
Salpetersyre er både en sterk oksidasjonsmiddel og en sterk syre . Ikke-metalliske elementer som karbon , jod , fosfor og svovel oksyderes av konsentrert salpetersyre til deres oksider eller oksosyrer med dannelse av nitrogendioksid , for eksempel
I tillegg oksyderes mange forbindelser av salpetersyre. Saltsyre oksyderes til klor og klordioksid .
Nitrater , saltene av salpetersyre, dannes når metaller eller deres oksider , hydroksider eller karbonater reagerer med salpetersyre. De fleste nitrater er vannløselige, og salpetersyre brukes hovedsakelig til å lage oppløselige metallnitrater.
Salpetersyre reagerer med de fleste metaller for å danne vannløselige nitrater. Unntak er edle metaller gull , platina og iridium . Også aluminium , titan , zirkonium , hafnium , niob , tantal og wolfram tåler salpetersyre- passivering . Videre, som et resultat av passivering , er jern motstandsdyktig mot kulde, og krom er også motstandsdyktig mot varm salpetersyre. Et tett vedheftende, ugjennomtrengelig oksydlag dannes på metallet. Siden gull og sølv kunne skilles fra på denne måten, pleide det å bli kalt skillevann . Blandinger av salpetersyre med saltsyre ( aqua regia ) eller selsyre reagerer også med gull og platina.
Salpetersyre farger proteiner som inneholder aromatiske aminosyrer som L- fenylalanin eller L- tyrosingult ved nitrering av benzenringen . Denne xantoproteinreaksjonen kan brukes til å oppdage aromatiske aminosyrer og proteiner.
| Vekt% HNO 3 | 0 | 10 | 20. | 30. | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Tetthet (g / cm 3 ) |
1.00 | 1.05 | 1.12 | 1.18 | 1.25 | 1.31 | 1.37 | 1.42 | 1.46 | 1.48 | 1,513 |
|
Viskositet (mPas) |
1.00 | 1.04 | 1.14 | 1.32 | 1.55 | 1,82 | 2.02 | 2.02 | 1,84 | 1.47 | 0,88 |
| Smeltepunkt (° C) | 0 | −7 | −17 | −36 | −30 | −20 | −22 | −41 | −39 | −60 | −42 |
| Bp (° C) | 100,0 | 101.2 | 103.4 | 107,0 | 112.0 | 116.4 | 120.4 | 121.6 | 116,6 | 102,0 | 86,0 |
| p (HNO 3 ) (mbar) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,3 | 1.2 | 3.9 | 14.0 | 36,0 | 60,0 |
| p (H 2 O) (mbar) | 23.3 | 22.6 | 20.2 | 17.6 | 14.4 | 10.5 | 6.5 | 3.5 | 1.2 | 0,3 | 0,0 |
| HNO 3 (mol / l) | 1.7 | 3.6 | 5.6 | 7.9 | 10.4 | 13.0 | 15.8 | 18.5 | 21 | 24.01 |
bruk
Salpetersyre er en av de viktigste råvarene i kjemisk industri. Hun serverer:
- for produksjon av nitrater og gjødsel ,
- som separerende vann for separering ( kvartering ) av gull og sølv (sølv reagerer og danner løselig sølvnitrat ),
- i blandinger med saltsyre som aqua regia for oppløsning av gull, så vel som for forgylling og for påvisning av gull,
- for beising og forbrenning av metaller (grafisk og galvanisk teknologi),
- for nitrering av organiske stoffer i produksjonen av fargestoffer , medisiner , desinfeksjonsmidler og eksplosiver som nitroglyserin eller bomullspistol ,
- for produksjon av celluloid- , nitro-lakk og zapon-lakk ,
- for å skifte fett (vannløselighet) for rengjøringsformål,
- for polering av metaller,
- i rakettdrivstoff som oksidasjonsmidler ( WFNA og RFNA ).
bevis
Som nitrater kan salpetersyre påvises i laboratoriet ved hjelp av ringtesten og Lunges reagens .
sikkerhetsinstruksjoner
Salpetersyre er etsende for hud, luftveier og slimhinner. Innånding av damper kan føre til giftig lungeødem . Denne faren oppstår spesielt ved oppvarming eller med konsentrert syre. I høye konsentrasjoner er det et sterkt oksidasjonsmiddel og har en brannfremmende effekt. Salpetersyre reagerer med de fleste metaller for å danne giftig nitrogendioksid . Når du arbeider med salpetersyre, vernebriller eller ansiktsskjerm, må du bruke passende vernehansker og en lukket arbeidsfrakk. Hvis det er fare for at salpetersyredamp eller nitrogenoksider frigjøres i et rom, må det brukes et pusteapparat. Av denne grunn er salpetersyre ikke egnet til rengjøring av husholdningen. Arbeid i laboratoriet gjøres alltid i et avtrekksskap. En teflonhette anbefales for flasker med konsentrert salpetersyre.
Se også
- Salpetersyre (HNO 2 )
weblenker
- Skolrelevant informasjon om salpetersyre på www.seilnacht.com, som underviser i naturvitenskap .
Individuelle bevis
- ↑ Innføring av salpetersyre. I: Römpp Online . Georg Thieme Verlag, åpnet 12. november 2014.
- ↑ a b c d e f g h Oppføring av salpetersyre i GESTIS stoffdatabase til IFA , åpnet 8. januar 2021. (JavaScript kreves)
- ↑ CCI ETH: pK s tabell
- ↑ Dataark 100% salpetersyre (PDF) fra Merck , tilgjengelig 23. januar 2018.
- ↑ Oppføring av salpetersyre ...% i klassifiserings- og merkelisten til European Chemicals Agency (ECHA), tilgjengelig 24. januar 2017. Produsenter eller distributører kan utvide den harmoniserte klassifiseringen og merkingen .
- ↑ Utvalget for farlige stoffer (AGS) av den føderale instituttet for Occupational Safety and Health (BAuA) : Tekniske Regler for farlige stoffer (TRGS) 900 ( PDF ), nås den 10. juni 2014.
- ↑ Swiss Accident Insurance Fund (Suva): Grenseverdier - nåværende MAK- og BAT-verdier (søk etter 7697-37-2 eller salpetersyre ), tilgjengelig 2. november 2015.
- ↑ Sikkerhetsdatablad Bernd Kraft, fra 29. mai 2019. PDF , åpnet 20. januar 2020.
- ↑ Thomas Gleinser: Anna von Diesbachs Bernese 'Pharmacopoeia' i Erlacher-versjonen av Daniel von Werdts (1658), del II: Ordliste. (Medisinsk avhandling Würzburg), nå på Königshausen & Neumann, Würzburg 1989 (= Würzburg medisinsk-historisk forskning. Bind 46), s. 38.
- Bra G. Brauer (red.), Håndbok for preparativ uorganisk kjemi , 2. utg., Vol. 1, Academic Press 1963, s. 491-492.
- ↑ Erwin Riedel , Christoph Janiak : Uorganisk kjemi. 8. utgave. de Gruyter, 2011, ISBN 3-11-022566-2 , s. 458.
- ↑ M. Thiemann, E. Scheibler, KW Wiegand: Salpetersyre, salpetersyrlighet og nitrogenoksider i Ullmanns Enzyklopädie der Technischen Chemie , Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, doi : 10,1002 / 14356007.a17_293 .
- ↑ Thomas Seilnacht: undervisning i naturvitenskap , salpetersyre og Thomas Seilnacht: DVD-ROM-kjemi , Seilnacht Verlag & Atelier, Bern 2017.








