urea
| Strukturell formel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Generell | ||||||||||||||||||||||
| Etternavn | urea | |||||||||||||||||||||
| andre navn | ||||||||||||||||||||||
| Molekylær formel | CH 4 N 2 O | |||||||||||||||||||||
| Kort beskrivelse |
fargeløst og luktfritt, krystallinsk fast stoff |
|||||||||||||||||||||
| Eksterne identifikatorer / databaser | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Legemiddelinformasjon | ||||||||||||||||||||||
| ATC-kode | ||||||||||||||||||||||
| eiendommer | ||||||||||||||||||||||
| Molarmasse | 60,06 g mol −1 | |||||||||||||||||||||
| Fysisk tilstand |
fast |
|||||||||||||||||||||
| tetthet |
1,34 g cm −3 |
|||||||||||||||||||||
| Smeltepunkt |
133 ° C (spaltning) |
|||||||||||||||||||||
| Damptrykk |
1,6 · 10 −3 Pa (25 ° C) |
|||||||||||||||||||||
| p K s verdi |
|
|||||||||||||||||||||
| løselighet |
veldig bra i vann:
|
|||||||||||||||||||||
| sikkerhetsinstruksjoner | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toksikologiske data | ||||||||||||||||||||||
| Termodynamiske egenskaper | ||||||||||||||||||||||
| ΔH f 0 |
−333,1 kJ mol −1 |
|||||||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er oppgitt, gjelder opplysningene standardbetingelser . | ||||||||||||||||||||||
Urea ( latin og engelsk urea , ikke å forveksle med urinsyre ), kjemisk er diamidet av karbonsyre , en organisk forbindelse . Det spiller en viktig rolle i mange biologiske prosesser som metabolismen av proteiner . Hos pattedyr er urea en metabolitt som krever urin og utskilles hovedsakelig med urinen og i mindre grad med svetten .
Ren urea er et hvitt, krystallinsk, luktfritt, giftfritt og hygienisk ufarlig fast stoff som oppløses godt i vann. Med et produksjonsvolum på rundt 200 millioner tonn per år, er det en av de mest produserte kjemikaliene. Urea er en mye brukt nitrogengjødsel og råvare for den kjemiske industrien , for eksempel for produksjon av ureaharpikser , som brukes som lim , for impregnering eller isolasjon . Urea fungerer også som grunnlag for syntesen av melamin , barbitursyre , koffein , hydrazin og andre kjemikalier.
I kostholdet til drøvtyggere kan urea brukes som en nitrogenkilde for dannelse av proteiner. Den liste over uunnværlige narkotika av Verdens helseorganisasjon inkluderer urea som keratolytic og hud fuktighetsgivende middel som brukes i salver og kremer for tørr, sprukken og kløende hud forhold.
Produksjonen av urea fra uorganiske utgangsmaterialer var en viktig begrepsmessig milepæl i kjemi og anses å være fødselen til biokjemi . Denne syntesen viste at et metabolsk produkt kan lages i laboratoriet uten noen biologiske utgangsmaterialer, og til slutt førte til fallet av vitenlæren .
historie

Den nederlandske kjemikeren Herman Boerhaave oppdaget urea mens han undersøkte urinen i 1727, som han kalte sal nativus urinæ , det naturlige urinsaltet . Hilaire-Marin Rouelle lyktes også i å skaffe urea i 1773 ved å bruke et alkoholholdig ekstrakt fra urinrester. I 1797 viste William Cruickshank at urinen inneholdt et krystalliserbart stoff som kunne utfelles med salpetersyre. Med det hadde han representert urea. Louis-Nicolas Vauquelin (sammen med doktorveilederen A. F. de Fourcroy ) oppdaget urea i dyreurin og rapporterte om det i 1800. Han beviste også at stoffet funnet av Rouelle var identisk med et stoff som Carl Wilhelm Scheele hadde fått ved å behandle urin med konsentrert salpetersyre , og ga navnet stoffet urea. I 1812 laget zoologen John Davy , uten å vite hva reaksjonsproduktet var, kunstig urea fra fosgen og ammoniakk. William Prout bestemte den kjemiske sammensetningen av urea i 1817.
Friedrich Wöhler først produsert urinstoff i 1828 ved reaksjoner av sølv cyanat (AgOCN) og ammoniumklorid (NH 4 Cl)
eller fra blycyanat (Pb (OCN) 2 ) og flytende ammoniakk .
Han anerkjente mellomforbindelsen ammoniumcyanat (NH 4 OCN) som den faktiske kilden til urea.
Urea anses å være den første organiske forbindelsen som er syntetisert fra uorganiske råvarer. Dette stred mot forestillingen som var utbredt på den tiden at organiske stoffer i utgangspunktet bare kunne produseres av levende vesener gjennom den såkalte vis vitalis (livskraft). Strengt tatt ga Wöhler bevis allerede i 1824 gjennom hydrolyse av dicyan til oksalsyre for at syntesen av organiske molekyler ikke krever "livskraft".
I 1868 beskrev Alexander Basaroff først den kommersielt anvendelige produksjonen av urea fra ammoniumkarbamat , som er tilgjengelig under trykk fra ammoniakk og karbondioksid.
Carl Bosch lyktes i å implementere denne prosessen i industriell skala i 1922 etter at ammoniakk var tilgjengelig i store mengder takket være Haber-Bosch-prosessen og den nødvendige høytrykksteknologien. Med den verdensomspennende konstruksjonen av Haber-Bosch-anlegg etter andre verdenskrig økte produksjonen av urea raskt parallelt med produksjonen av ammoniakk.
Hendelse

Syntetisk eller biologisk urea som kommer ut i miljøet blir vanligvis raskt omdannet av bakterier til ammonium- , nitritt- og nitrationer og blir dermed en del av nitrogensyklusen . Sammen med urinsyre er urea en del av utskillelsen av fugler og flaggermus og forekommer i flaggermus guano (kiropteritt) og i små mengder i guano .
Som mineral er urea bare stabil under tørre forhold. Urea ble funnet i 1973 som et naturlig sekundært mineral ved Toppin Hill ved Rason-sjøen (Western Australia), assosiert med ammoniumnaftitalitt , ammoniumfosfater og Weddellite . Det har blitt anerkjent som et eget mineral av International Mineralogical Association (IMA) . I følge systematikken til mineraler i henhold til Strunz (9. utgave) er disse oppført som "Diverse organiske forbindelser" under systemnr. "10.CA.35". Systematikken til mineraler i følge Dana , som også er vanlig i engelskspråklige land , lister opp mineralet under systemnr. "50.4.6.1".
Produksjon

Urea kan produseres i laboratorieskala ved å reagere ammoniakk med fosgen eller karbonsyreestere eller ved hydrolyse av cyanamid . Urea produseres industrielt i store mengder, rundt 184 millioner tonn over hele verden i 2012. I følge International Fertilizer Industry Association (IFA) forventes det en ytterligere økning i produksjonskapasiteten på 41 millioner tonn mellom 2013 og 2018, hvorav 5 millioner tonn vil være i USA. Kapasitetsutvidelsen i USA skyldes utvidelse av skifergassproduksjon .
Store planter brukes til å produsere urea, som først produserer ammoniakk og til slutt urea fra naturgass , luft og vann ved hjelp av Haber-Bosch-prosessen. To tredjedeler av karbondioksidet som tidligere ble separert under hydrogenproduksjon , er bundet under produksjonen av urea.
Den industrielle produksjonen av urea i høytrykksprosess går tilbake til Carl Bosch og Wilhelm Meiser. I 1922 bestilte BASF det første produksjonsanlegget der ammoniumkarbamat (NH 4 CO 2 NH 2 ) ble dannet i en høytrykksreaktor ved 150 bar i en eksoterm reaksjon på −117 kJ mol −1 :
Ammoniumkarbamat reagerer i en endoterm reaksjon på +15,5 kJ mol −1 for å danne urea og vann:
Det er en likevektsreaksjon. Det brukes et overskudd av ammoniakk for å optimalisere utbyttet. Gasser som returneres til prosessen, bør være så fri for vann som mulig, siden vann forskyver likevekten til ammoniumkarbamatsiden. Den generelle reaksjonen er eksoterm. Et av biproduktene er isocyaninsyre .
Reaksjonen kan undertrykkes ved å arbeide i et overskudd av ammoniakk. BASF brukte opprinnelig overflødig ammoniakk til å produsere ammoniumsulfat og ammoniumnitrat . På slutten av 1920-tallet ble prosessen forbedret og overflødig ammoniakk ble returnert til produksjonsprosessen. Ulike totale syklusprosesser utviklet seg fra dette, for eksempel fra DuPont , Pechiney eller Stamicarbon .
Prosessene er forskjellige i typen dekomponering av ammoniumkarbamat, separering og utvinning av karbondioksid og ammoniakk, og prosessering av urea. Reaksjonstemperaturene er mellom 170 og 220 ° C, avhengig av prosessen, og reaksjonstrykket mellom 125 og 250 bar. Alle moderne industrielle prosesser har det til felles at overflødige gasser føres tilbake i reaktoren, hvorved strippingsprosesser brukes.
For å produsere ett tonn urea kreves 0,58 tonn ammoniakk og 0,76 tonn karbondioksid. Avhengig av prosessen kreves mellom 85 og 160 kWh elektrisk energi og mellom 0,9 og 2,3 tonn damp.
Et viktig hensyn i prosessutformingen er begrensningen av innholdet av biuret , som dannes fra urea når det utsettes for temperatur og som er til stede som en urenhet i industrielt produsert urea. Innholdet av biuret i urea må være begrenset, vanligvis mindre enn 1,0%, siden biuret har en hemmende effekt på utviklingen av frø og sunn plantevekst.
Urea, som opprinnelig forekommer i oppløsning, blir tradisjonelt omdannet til et finkornet bulkmateriale med en kornstørrelse på omtrent to millimeter ved prilling, også kjent som spraykrystallisering, og selges i sekker eller løse. For dette formål deles en flytende urea-smelte i små dråper i et tårn og får fritt fall; Store vifter på toppen av tårnet suger inn kald, frisk luft i motstrøm, og får væsken til å stivne til faste kuler når den faller. Smelting og avkjøling resulterer i et relativt lite overflateareal, noe som blant annet gjør urea mindre hygroskopisk og opprettholder strømningsegenskapene over flere måneder. Siden prills har ulemper, spesielt når det gjelder størrelse og styrke, granuleres fast urea nesten utelukkende i nyere gjødselanlegg, med spraygranulering i en fluidisert seng som den mest moderne teknologien og nesten utelukkende brukt i nye planter. De største plantene i verden produserer rundt 4000 tonn urea per dag i en produksjonslinje.
Urea med lavere biuretinnhold kan oppnås fra moderluten ved krystallisering . Biuretten forblir i den vandige fasen og kan således separeres. Videre bearbeiding kan også gjøres ved prilling.
eiendommer
Fysiske egenskaper
Urea er et fargeløst krystallinsk fast stoff med en tetthet på 1,32 g / cm 3 i henhold til standardbetingelser . Den smelter i området fra 132,5 til 134,5 ° C med nedbrytning. Damptrykket ved 75 ° C er 0,2 Pascal . Urea oppløses veldig godt i vann og andre polare løsningsmidler; ett gram urea oppløses i 1,5 ml vann, 10 ml etanol, 6 ml metanol eller 2 ml glyserin.
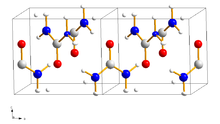
Urea krystalliserer i tetragonal krystallsystem med romgruppen P 4 2 1 m (romgruppe nr. 113) med gitterparametrene a = 564,6 pm, c = 470 pm og et forhold på a : c = 1: 0,833. Den utvikler fargeløse til lysegule eller lysebrune, nåleformede krystaller. Fast urea har to N - H - O hydrogenbindinger på oksygenatomet, avstanden mellom oksygen og hydrogenatomer er 299 pikometer og 304 pikometer. De eksisterende hydrogenbindinger brytes under høyt trykk og nye bindinger dannes. Fra et trykk på 4800 bar, dannes en ortorhombisk fase med romgruppen P 2 1 2 1 2 1 (romgruppe nr. 19) .
Krystallstrukturen består av bånd i form av en helix, som kan lagre organiske forbindelser som gjestemolekyler. I disse klatratene holdes de organiske gjestemolekylene i kanalene som dannes av interpenetrerende helixer av hydrogenbundne ureamolekyler. Denne oppførselen kan brukes til å skille lineære og forgrenede hydrokarbonblandinger , for eksempel i ureaekstraktiv krystallisering .
Kjemiske egenskaper
- Urea oppløses lett i vann og etanol , men ikke i dietyleter eller benzen . Den vandige løsningen reagerer nøytralt. Den protonerte formen [NH 2 C (OH) NH 2 ] + er dannet med syrer . Urea-saltene av salpetersyre er eksplosiver . Når den vandige løsningen oppvarmes med syrer, brytes urea ned til karbondioksid og ammoniumsalter ; når den varmes opp med alkalier, brytes den ned i karbonater og ammoniakk.
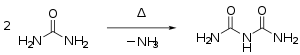
- Ved oppvarming over smeltepunktet kondenserer urea til å begynne med til å danne isocyaninsyre , hvor ammoniakk blir splittet , som deretter reagerer med urea for å danne biuret :
Ved høyere temperaturer dannes andre kondensprodukter som triuret , guanidin og melamin .
Disse transamideringene er viktige reaksjoner for den generelle representasjonen av ureaderivater:
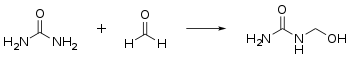
- Urea reagerer med formaldehyd i en tilleggsreaksjon for å danne metylolurinstoffer , som har hydroksymetylgrupper :
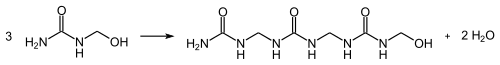
Disse reagerer i en kondensasjonsreaksjon med frigjøring av vann og dannelsen av metylengrupper for å danne ureaharpikser :
- Urea danner et hydrogenperoksid-urea-addukt med hydrogenperoksid , karbamidperoksidet . Dette er et vannløselig krystallinsk addukt som dannes når urea omkrystalliseres med konsentrert hydrogenperoksidoppløsning. Den inneholder rundt 35% hydrogenperoksid.
Hydrogenet kan delvis eller fullstendig erstattes av andre substituenter gjennom forskjellige reaksjoner. Med benzoylklorider, for eksempel, imider slik som benzoylurinstoff dannes , og sulfonylurea-forbindelser er dannet ved omsetning med sulfonyl -klorid .
Ved oppvarming til rundt 200 til 300 ° C dannes cyanurinsyre .
- Ved å introdusere klor i en 20% ureaoppløsning og deretter tilsette 20% natriumhydroksydoppløsning , blir hydrazin produsert i 50% utbytte i en Hofmann-omlegging .
- Urea brytes ned til ammoniakk og karbondioksid ved veldig høye temperaturer
Den resulterende ammoniakken er i SNR-metoden brukt til informasjonen som finnes i avgasser fra kraftverk og forbrenningsmotorer, nitrogenoksider til elementært nitrogen for å redusere
Molekylære egenskaper
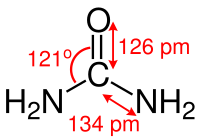
Urea-molekylets karbonatom er koordinert på en trigonal plan måte (omtrent: sp 2- hybridisert ), karbon-nitrogenbindinger har en signifikant dobbeltbindingskarakter og, sammenlignet med karbon-nitrogenbindinger i alkylaminer , er de omtrent 10 pikometer kortere. Atomavstanden mellom nitrogen og hydrogen er 105 pikometer, avstanden mellom nitrogen og karbon er 134 pikometer, og avstanden mellom karbon og oksygen er 126 pikometer. N - C - O vinkelen er 121 °. Molekylet har samlet C 2v- symmetri .
Strekkvibrasjonen v N - H er i det infrarøde området for spekteret ved et bølgetall på 3396 cm −1 og dermed høyere enn ammoniakkens, som har et bølgetall på 3372 cm −1 . Ν C = O strekkvibrasjon er 1687 cm -1 og indikerer en resonans mellom karbonyl- og alkoholatstruktur. Ν C-N- strekkvibrasjonen er 1465 cm −1 .
bruk
En industriell bruk av urea er produksjonen av melamin , som f.eks. B. behandles med formaldehyd til syntetiske harpikser, og urea-formaldehydharpikser ( ureaharpiks , såkalte UF-harpikser ), z. B. brukes til produksjon av sponplater . Ellers brukes urea hovedsakelig som nitrogengjødsel eller som reduksjonsmiddel for nitrogenoksider i SNCR- prosessen. Etterspørselen etter urea økte jevnt over årene, bare mellom 1960 og 1970 tredoblet etterspørselen og produksjonskapasiteten. Mellom 1990 og 2010 vokste etterspørselen jevnt med litt over 3% årlig, med installert kapasitet som overstiger etterspørselen med rundt 10 til 20%. En ytterligere økning i etterspørselen kan være drevet av økende krav til nitrogenoksidreduksjon i veitrafikk samt utvidelse av kapasitet for biodrivstoff .
Nitrogengjødsel

Med 46,63% har urea det høyeste nitrogeninnholdet av alle konvensjonelle nitrogengjødsel; ammoniumnitrat, som også ofte brukes, har et nitrogeninnhold på 35%. Mange jordbakterier har enzymet urease , som katalyserer omdannelsen av urea til ammoniakk eller ammoniumioner og hydrogenkarbonationer .
For ikke å gå tapt som en gass i atmosfæren, må ammoniakk festes til ammoniumionen med vann eller en syre:
Ammoniakk-oksyderende nitritt bakterier som nitrosomonas oksyderer dem til nitritt i den såkalte nitrifikasjon prosess med energigevinst :
Nitritt oksydasjonsmidler slik som nitrobacter ytterligere å oksydere den dannede nitritt til nitrat :
Planter absorberer lett ammoniumioner og nitrat; de danner de dominerende kildene til nitrogen for plantevekst.
Urea er den mest brukte nitrogengjødsel verden over, beregnet på grunnlag av nitrogeninnholdet. I forskjellige regioner, som Asia, var andelen over 50% i 1997.
| Andel av ulike nitrogengjødsel i det globale forbruket (basert på nitrogen; 1997) | |
|---|---|
| gjødsel | Prosentdel |
| urea | 44.22 |
| Ammonium Nitrat | 9.52 |
| ammoniakk | 5.67 |
| Ammoniumnitrat ureaoppløsning | 4,96 |
| Kalsiumammoniumnitrat | 4.31 |
| Ammoniumsulfat | 3.06 |
| Annen | 28.26 |
Forbruket økte spesielt sterkt i asiatiske land. I 2013 var India, Kina og Pakistan verdens største forbrukere av urea.
| Liste over de ti landene med høyest ureaforbruk | ||
|---|---|---|
| land | år |
Forbruk i millioner av tonn |
| India | 2013 | 30.60 |
| Kina | 2012 | 28.50 |
| Pakistan | 2013 | 5,89 |
| forente stater | 2013 | 5.60 |
| Indonesia | 2013 | 4,77 |
| Brasil | 2013 | 4.56 |
| Canada | 2013 | 3.38 |
| Thailand | 2013 | 2.37 |
| Egypt | 2013 | 1,93 |
| Iran | 2013 | 1,84 |
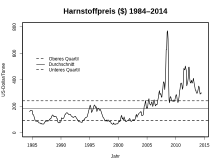
Ureaprisen lå lenge rundt US $ 100 / tonn, men steg raskt fra 2003 til toppen i august 2008 på $ 770 / t. Den falt da igjen og var i underkant av $ 200 / t i juni 2016.
Medisinske applikasjoner
På apotek brukes urea som et keratolytisk middel (dvs. som en aktiv ingrediens som løser horn ). Denne egenskapen brukes i forskjellige oppskrifter. For eksempel fungerer den i en høykonsentrert (40%) pasta sammen med et soppdrepende middel ( antimykotisk ) mot neglesopp (onykomykose), hvor urea myker neglen slik at den infiserte neglesubstansen kan fjernes stykke for stykke. Det brukes også som fuktighetskrem i salver for å bekjempe atopisk eksem og lavsykdommer . Tidligere ble urea i en vandig løsning foreskrevet som et vanndrivende middel mot pleuritt og skrumplever .
Urea brukes i førstehjelp som en del av kaldpakninger for å avkjøle stammer eller blåmerker. Disse består av to separate områder, hvorav det ene er urea og det andre er vann. Hvis separasjonen brytes, oppløses urea i vannet. Siden gitterenergien er større enn hydratiseringsenergien, trekker oppløsningsprosessen energi fra omgivelsene og kjøler den ned.
Administrering av 13 C-merket urea og påfølgende påvisning av 13 C-merket karbondioksid ved hjelp av en 13 C-urea-pustetest muliggjør påvisning av Helicobacter pylori i magen. Det frigjorte karbondioksidet indikerer tilstedeværelsen av enzymet urease, som bakterien bruker til å produsere ammoniakk fra urea og dermed øke pH i mage miljøet. Bakterien er en av årsakene til sår .
Noen derivater av urea er aktive ingredienser i legemidler og plantevernmidler. Barbiturinsyre og barbiturater er derivater av urea, som kan fås fra dietylmalonat og dets derivater og urea.
Sulfonylurinstoffer brukes som orale antidiabetiske midler , og de danner også en viktig gruppe herbicider .
Urea-konsentrasjonen i blodet eller urinstoffet i blodet knyttet til det med en faktor på 0,467 er blant parametere for nyreretensjon som er bestemt som medisinske indikatorer i nefrologi for å vurdere ytelsen til nyrene . Forhøyede verdier kan indikere nedsatt nyrefunksjon, men påvirkes på mange måter, for eksempel av proteininntak.
Den urea Reduksjonsforholdet (urinstoff reduksjonsforhold (URR)) er et mål for eliminering av oppløste stoffer under hemodialyse . Urea-reduksjonsforholdet er brøkdelen av urea-konsentrasjonen i blodet som fjernes i forhold til den totale blodurea-konsentrasjonen under hemodialysebehandling.
miljøvern
Urea brukes til å redusere nitrogenoksider i avgassen fra kraftverk og forbrenningsmotorer. SNCR-prosessen ( selektiv ikke-katalytisk reduksjon ) brukes i kraftverk , hovedsakelig i mindre systemer . I den såkalte SCR-prosessen ( selektiv katalytisk reduksjon ), som brukes i kraftverk og i økende grad innen kjøretøyteknologi, injiseres urea eller ammoniakk i den varme eksosstrømmen. Ureaen spaltes til ammoniakk, noe som reduserer nitrogenoksidene i en nedstrøms katalysator . I bilteknikk brukes en vandig løsning med et 32,5% ureainnhold, som er standardisert under betegnelsen AUS 32 . Forbruket av ureaoppløsning er omtrent 2 til 8% av drivstofforbruket.
Matproduksjon
Urea tilsettes maten som en stabilisator . I EU er det kun godkjent som tilsetningsstoff med betegnelsen E 927b for tyggegummi uten tilsatt sukker. Det fungerer som en syreregulator i munnen ved å dele opp ammoniakk.
Urea spiller en rolle som nitrogenkilde i storfeoppdrett . Urea gir nitrogen for næring, men kua trenger også energi og mineraler i vommen for å produsere proteiner fra den. Teoretisk produserer 100 gram urea 2875 gram råprotein. Siden 2008, kan urea bare benyttes for supplerende mating hvis husdyr eieren oppfyller visse krav i henhold til den mate hygiene ordning.
Tilsetning av urea i høyere konsentrasjoner til vandige oppløsninger fører til en denaturering av proteiner , slik at urea fungerer som en denatureringsmiddel eller som en kaotropisk forbindelse . Imidlertid kan lave konsentrasjoner av urea ha motsatt effekt, for eksempel øke den hydrofobe effekten og dermed stabilisere proteinstrukturen.
Ureainnholdet i stråler og haier betyr at de må gjæres i flere uker før de kan konsumeres for å bryte ned ureaen til ammoniakk og for å gasse den av. Fermenterte skøyter og grønlandshaier , under navnet Gammel stråler og Hákarl kjent som ansett som islandske spesialiteter.
Andre bruksområder
Urea brukes som erstatning for veisalt , men dette gjøres bare i spesielle tilfeller på grunn av den høyere prisen, for eksempel for avisning av bevegelsesområder på flyplasser . I Sveits er bruk kun tillatt på flyplasser.
Urea er i ureaekstraksjonskrystalliseringen , en prosess for å separere lineære parafiner fra hydrokarbonblandinger gjennom dannelsen av urea og paraffin - klatrater som brukes. Hensikten med separasjonen er å senke flytepunktet for mineraloljeprodukter; n- parafiner med høy renhet oppnås som biprodukter . Metoden kan brukes til separering av fettsyrer og fettalkoholer .
Denatureringseffekten av urea på proteiner brukes i urea-PAGE , urea- polyakrylamidgelelektroforese . De anvendte urea-konsentrasjonene er i størrelsesorden 4 til 8 molar . I motsetning til SDS-PAGE endrer Urea-PAGE praktisk talt ikke ladningen av proteinene, noe som muliggjør separasjon av proteiner med samme molekylvekt, men forskjellige ladninger. Det effektive volumet til de enkelte proteinmolekylene er større med urea-PAGE enn med native-PAGE , og aggregatene av proteinmolekylene brytes ned til underenhetene. Hvis proteinmolekylene eller deres aggregater stabiliseres av disulfidbroer , tilsettes reduserende tioler til urea-PAGE , i likhet med SDS-PAGE.
På grunn av den høye vannbindende kapasiteten brukes urea ofte som en fuktighetsfaktor i kosmetikk , vanligvis erklært som urea .
Et brannslukningspulver basert på kaliumhydrogenkarbonat bruker urea som en komponent. Pulveret brukes til å bekjempe branner i BCE-brannen . Bruk er ikke tillatt i Tyskland.
Benzoylurinstoff er insekticider det opptre som en kitin-inhibitor .
I den direkte urea brenselcellen (DUFC), tjener urea som en hydrogen leverandør. I tillegg til å generere energi, er prosessen også egnet for å fjerne urea fra avløpsvannet.
Biologisk betydning
Mange virveldyr , som blekksprut som haier og stråler , amfibier og pattedyr, produserer urea som et sluttprodukt av metabolismen av nitrogenforbindelser som aminosyrer . Det er et av stoffene som er urinert . Nedbrytningen av aminosyrer produserer først ammoniakk, som har en toksisk effekt på celler i tilsvarende høye konsentrasjoner .
Dannelsen av urea foregår i leveren gjennom reaksjonen av to ammoniakkmolekyler med ett molekyl karbondioksid i urea-syklusen . Den transporteres fra leveren til nyrene og skilles ut i urinen. Omtrent halvparten av innholdet av faste stoffer i urinen består av urea. Urea-syklusfeil er arvelige metabolske sykdommer som er forbundet med en forstyrrelse av ammoniakkomdannelse. De fører til et økt nivå av ammoniakk i blodet, noe som skader nerveceller. Små mengder urea utskilles hos mennesker gjennom svette og tarmsekresjoner. Menneskekroppen produserer rundt 20 til 30 gram urea per dag. Ulike levende ting bruker urea som et biogent frostvæske . Haier og stråler utskiller ikke all urea, men bruker den til å regulere osmose .
Et høyt proteininntak fører til økte urea-nivåer selv med normal nyrefunksjon, noe som gjør det til en dårlig nyreparameter. Sykdommer som akutt eller kronisk nyresvikt samt diabetisk nedsatt nyrefunksjon kan føre til økte urea- nivåer i serum / plasma (normalverdi: 10–50 mg / dl). Ved (pre-) terminal nyreinsuffisiens er urea- konsentrasjonen i serum bedre egnet til å vurdere alvorlighetsgraden av uremi enn serumkreatininkonsentrasjonen .
Den melk ureainnholdet er innholdet av urea i milligram per liter melk, og er et viktig mål for den optimale protein og energiforsyning av kua. Ureainnholdet i melken bestemmes av tilførsel av råprotein per dyr og dag, innholdet av gjennomstrømningsprotein og karbohydratene som er gjærbare i vommen og fungerer som et mål for utnyttelsen av det rå fôrproteinet. En relativ over- eller underforsyning av råprotein indikerer forvaltningsfeil som utgjør en trussel for dyrehelsen.
toksikologi
Urea er å anse som praktisk talt giftfri. Ingen toksisitet ble funnet i fôringseksperimenter med rotter i en dose på 20 gram per kilo kroppsvekt, eller når smågris ble matet opptil 4 gram per kilo kroppsvekt i flere dager. Ingen innflytelse av ureaadministrasjon på utviklingen av fostre hos rotter og mus kunne bestemmes.
Oral administrering av høydose urealøsninger til hunder i flere dager forårsaket svakhet, tap av matlyst, oppkast og gagging, diaré og redusert kroppstemperatur, som alle førte til koma. I eksperimenter med nakenmus der ren urea ble påført huden, ble det ikke funnet noen endringer i huden. Imidlertid øker urea hudinntrengningen til andre stoffer.
Bekreftelsesprosedyre
Nedbør som ureanitrat er egnet for kvalitativ bevising . I eddiksyreoppløsning kan urea omdannes til dixanthylurea med xanthydrol og utfelles. Urea kan brytes ned enzymatisk i karbondioksid og ammoniakk ved hjelp av urease . Matanalyse bruker denne spaltningen for kvantitativ påvisning av ammoniakk ved hjelp av det blåfargede indofenolionet i Berthelot-reaksjonen .
litteratur
- Dieter Fromm, Dietrich Lützow: Moderne prosesser i storskala kjemi: urea. I: Kjemi i vår tid . 13. år nr. 3, 1979, s. 78-81, doi: 10.1002 / ciuz.19790130303 .
- Jozef Meessen: Urea. I: Ullmann's Encyclopedia of Industrial Chemistry . Vol. 37, Wiley-VCH Verlag, Weinheim 2012, s. 657-695, doi : 10.1002 / 14356007.a27_333.pub2 .
- Jozef Meessen: Urea-syntese. I: Chemical Engineer Technology . 86. år nr. 12, 2014, s. 2180–2189, doi: 10.1002 / cite.201400064 . (Gjennomgå artikkel om historie, termodynamikk og nåværende produksjonsprosesser).
weblenker
- Litteratur av og om urea i katalogen til det tyske nasjonalbiblioteket
Individuelle bevis
- ↑ Oppføring på UREA i CosIng-databasen til EU-kommisjonen, åpnet 28. desember 2019.
- ↑ Oppføring på E 927b: Karbamider i den europeiske databasen om tilsetningsstoffer, tilgjengelig 27. juni 2020.
- ↑ a b Oppføring av urea. I: Römpp Online . Georg Thieme Verlag, åpnet 26. mai 2014.
- ↑ a b c d e f Oppføring av urea i GESTIS stoffdatabase til IFA , åpnet 19. desember 2019. (JavaScript kreves)
- ↑ Walter Klöpffer: oppførsel og nedbrytning av miljøkjemikalier Fysisk-kjemiske baser . John Wiley & Sons, 2013, ISBN 3-527-67212-5 , pp. 574 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ Bordwell pK a -Tabell
- ↑ pKa Data , samlet av R. Williams (PDF, 78 kB).
- ↑ a b David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Analytical Chemistry, s. 8-120.
- ↑ Oppføring av urea i ChemIDplus- databasen til United States National Library of Medicine (NLM), åpnet 17. oktober 2016.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, s. 5-20.
- ↑ Oppføring på svette. I: Römpp Online . Georg Thieme Verlag, åpnet 5. november 2019.
- Sh Peter Shaw, Ephraim Chambers: A New Method of Chemistry. Volum 2, J. Osborn og T. Longman, London 1727, ( s. 193: Prosess LXXXVII. Online ).
- Rosen Louis Rosenfeld: William Prout: Lege-kjemiker fra begynnelsen av 1800-tallet. I: Klinisk kjemi. 49, 2003, s. 699-705, doi: 10.1373 / 49.4.699 .
- ↑ Resultatene av forsøk med forskjellige syrer, og noen andre stoffer, i behandlingen av Lues Veneres etc. av William Cruickshank . I: John Rollo († 1809): En beretning om to tilfeller av diabetes mellitus ... London 1797, del II, s. 141–225 ( digitalisert versjon ).
- ^ William Coulson: Om sykdommene i blæren og prostatakjertelen . John Churchill, London 1857, s. 15 ( digitalisert versjon ).
- ↑ a b Peter Dilg: Urea-syntese. I: Werner E. Gerabek , Bernhard D. Haage, Gundolf Keil , Wolfgang Wegner (red.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4 , s. 535.
- Pro William Prout: Observasjoner om naturen til noen av de nærmeste prinsippene for urin; med noen få bemerkninger om virkemidlene for å forhindre disse sykdommene, forbundet med en sykelig tilstand av væsken. I: Medikokirurgiske transaksjoner. Volum 8, 1817, s. 521-544, 596-7-596-9. PMID 20895332 , PMC 2128986 (fri fulltekst).
- ↑ Friedrich Wöhler: Om kunstig dannelse av urea. I: Annaler for fysikk og kjemi. 88, 1828, s. 253-256, doi: 10.1002 / andp.18280880206 .
- ^ Burchard Franck: 250 års kjemi i Göttingen. I: Hans-Heinrich Voigt (red.): Naturvitenskap i Göttingen. En serie foredrag. ( Göttinger Universitätsschriften . Bind 13). Vandenhoeck + Ruprecht, Göttingen 1988, ISBN 3-525-35843-1 , s. 72. ( begrenset forhåndsvisning i Google- boksøk )
- ↑ H. Kolbe, Dr. Wilm, Dr. Wischin, Mr. Irelan, Alexander Basaroff, Dr. Theilkuhl: XXV. - Kjemiske bidrag. I: J. Chem. Soc. 21, 1868, s. 192-197, doi: 10.1039 / JS8682100192 .
- ↑ a b Patent US 1429483 : Fremstillingsprosess for urea. Publisert 19. september 1922 , oppfinnere: Carl Bosch, Wilhelm Meiser.
- ^ Oppføring på guano. I: Römpp Online . Georg Thieme Verlag, åpnet 22. mai 2012.
- ↑ Michael Fleischer: Nye mineraler. I: American Mineralogist. 59, 1974, s. 874-875.
- ^ PJ Bridge: Urea, et nytt mineral og neotype fosfamitt fra Vest-Australia. I: Mineralogical Magazine 39, 1973, s. 346-348.
- ↑ Ceresana: Urea-markedsstudie , åpnet 17. mai 2013.
- ^ Food and Agriculture Organization of the United Nations: World fertilizer trends and outlook to 2018. Roma 2015, ISBN 978-92-5-108692-6 , s. 16.
- ↑ a b c d e f g James A. Kent (red.): Riegels håndbok for industriell kjemi . Van Nostrand Reinhold, 1974, ISBN 0-442-24347-2 , s. 104-111.
- ↑ a b c d e f g h i j Jozef Meessen: Urea. I: Ullmann's Encyclopedia of Industrial Chemistry . Vol. 37, Wiley-VCH Verlag, Weinheim 2012, s. 657-695, doi: 10.1002 / 14356007.a27_333.pub2 .
- ↑ a b Jozef Meessen: Urea-syntese. I: Chemical Engineer Technology. 86, 2014, s. 2180-2189, doi: 10.1002 / cite.201400064 .
- ^ ARC Haas, JN Brusca: Biuret, Giftig form for nitrogen. I: California Agriculture. 8, 1954, s.11.
- ↑ Rudolf Gaedeke, Friedrich Wolf, Rita Otto: Å påvirke strukturen til ureaprills ved å avkjøle smeltedråper under definerte utslippsforhold Del 1. I: Hercynia-Ökologie und Umwelt i Mitteleuropa. 20, 2014, s. 403-410.
- ↑ Patent US3025571 : Fremgangsmåte for fremstilling av prilled uea med lavt biuretinnhold. Publisert 20. mars 1962 , oppfinnere: Jack E. Beecher, Robert J. Kallal et al.
- ^ Remington: The Science and Practice of Pharmacy. Lippincott Williams & Wilkins Verlag, 2006, ISBN 0-7817-4673-6 , s. 1424.
- ↑ a b c d P. Vaughan, J. Donohue: Strukturen til urea. Interatomiske avstander og resonans i urea og relaterte forbindelser. I: Acta Crystallographica. 5, 1952, s. 530-535, doi: 10.1107 / S0365110X52001477 .
- ↑ a b mindat: Urea: Urea mineral information and data . Hentet 13. mai 2013.
- ↑ Anna Olejniczak, Kinga Ostrowska Andrzej Katrusiak: H-Bond Breaking i høytrykks urea. I: The Journal of Physical Chemistry C. 113, 2009, s. 15761-15767 doi: 10.1021 / jp904942c .
- ↑ Kenneth DM Harris: Fundamental and Applied Aspects of Urea and Thiourea Inclusion Compounds. I: Supramolecular Chemistry. 19, 2007, s. 47-72, doi: 10.1080 / 10610270600977706 .
- ↑ MJ Janssen: Strukturen til protonerte amider og urea og deres thio-analoger. I: Spectrochimica Acta. 17, 1961, s. 475, doi: 10.1016 / 0371-1951 (61) 80102-1 .
- ^ Christian Nitschke, Günter Scherr: Urea Derivatives. I: Ullmann's Encyclopedia of Industrial Chemistry . Vol. 38, Wiley-VCH Verlag, Weinheim 2010, s. 1-12, doi: 10.1002 / 14356007.o27_o04 .
- ↑ H. Heaney, F. Cardona, A. Goti, AL Frederick: Hydrogen Peroxide-urea . e-EROS Encyclopedia of Reagents for Organic Synthesis, 2013, doi: 10.1002 / 047084289X.rh047.pub3 .
- ^ Klaus Huthmacher, Dieter Most: Cyanuric Acid and Cyanuric Chloride. I: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005. doi : 10.1002 / 14356007.a08_191
- ↑ Patent DE578486 : Produksjon av hydrazin. Publisert 18. oktober 1933 , oppfinnere: Egon Ihwe, Otto Seuffert.
- ↑ Mansel Davies, Leslie Hopkins: Binde i urea og i den urea-ionet. I: Transaksjoner fra Faraday Society. 53, 1957, s. 1563-1569, doi: 10.1039 / TF9575301563 .
- ^ Z. Piasek, T. Urbanski: Det infrarøde absorpsjonsspekteret og strukturen til urea. I: Bull. Pol. Acad. Sci-tech. X, 1962, s. 113-120.
- ↑ Bernd Tieke: Makromolekylær kjemi: En introduksjon . Verlag Wiley-VCH, 2014, ISBN 978-3-527-33216-8 , s. 42-45.
- ↑ a b c Beskrivelse av forskjellige teknologier og deres utviklingspotensiale for reduksjon av nitrogenoksider i avgassen fra avfallsforbrenningsanlegg og erstatningskraftverk med hensyn til ytelse, kostnader og energiforbruk , brosjyre fra Federal Environment Agency, 71. 2011 (online)
- ↑ Samuel L. Tisdale, Werner L. Nelson, James D. Beaton: Jordfruktbarhet og gjødsel. Macmillian, 1985, ISBN 0-02-420830-2 , s. 161-168.
- ^ KL Marsh, GK Sims, RL Mulvaney: Tilgjengelighet av urea til autotrofiske ammoniakkoksiderende bakterier som er relatert til skjebnen til 14C- og 15N-merket urea tilsatt jord. I: Jordens biologi og fruktbarhet. 42, 2005, s. 137, doi: 10.1007 / s00374-005-0004-2 .
- ↑ Georg Fuchs: Generell mikrobiologi. George Thieme Verlag, 2014, ISBN 978-3-13-444609-8 , s. 40.
- ↑ a b U.S. International Trade Commission: Ammonium Nitrate: En sammenlignende analyse av faktorer som påvirker global handel . Undersøkelse nr. 332-393, oktober 1998, s. 2.
- ↑ a b Urea månedlig pris - amerikanske dollar per tonn. IndexMundi, åpnet 8. juli 2016 .
- ↑ Urea, forbruk (tonn) - for alle land , (online)
- ↑ Hellmut Ruck: Håndbok for medisinsk fotpleie . Karl F. Haug Verlag, 2012, ISBN 978-3-8304-7569-9 , s. 121.
- Kl G. Klemperer, E. Rost: Håndbok for generell og spesiell medisin resept teori for leger . Springer Verlag, 1929, s. 710. (Opptrykk: ISBN 978-3-642-52556-8 )
- ↑ Robert T. Sataloff: Sataloffs Comprehensive Textbook of Otolaryngology. Jaypee Brothers, 2016, ISBN 978-93-5152745-9 , s. 412.
- Gang Wolfgang F. Caspary, Manfred Kist, Jürgen Stein: Infektiologi i mage-tarmkanalen . Springer Medizin Verlag, 2006, ISBN 3-540-41359-6 , s. 166.
- ^ Adolf Baeyer: Undersøkelser av urinsyregruppen. I: Annaler for kjemi og farmasi. 131, 1864, s. 291-302, doi: 10.1002 / jlac.18641310306 .
- ↑ Hans G. Drobny, Martin Schulte, Harry J. Strek: 25 år med sulfonylurea ugressmidler - noen få gram forandret verden av kjemiske ugrasbekjempelse. I: Julius Kühn Archive. Volum 434, 2012, s. 21-33, doi: 10.5073 / jka.2012.434.002 .
- ^ Walter H. Hörl: Dialyseprosedyre i klinikk og praksis: teknologi og klinikk. Thieme Verlag, 2003, ISBN 3-13-497706-0 , s. 17.
- ↑ Lynda Anne Szczech, Edmund G. Lowrie, Zhensheng Li, Nancy L. Lew, J. Michael Lazarus, William F. Owen: Endring av hemodialysepasienter terskler for optimal overlevelse. I: Kidney International. 59, 2001, s. 738-745, doi: 10.1046 / j.1523-1755.2001.059002738.x .
- ^ Robert Bosch GmbH: Kraftfahrtechnisches Taschenbuch. Springer Vieweg, 2014, ISBN 978-3-658-03800-7 , s. 719.
- ↑ Robert Ebermann, Ibrahim Elmadfa: Lærebok om matkjemi og ernæring. Springer, 2008, ISBN 978-3-211-48649-8 , s. 663.
- ↑ Katrin Mahlkow-Nerge: feed urea i melk storfe - forsiktig bruk er viktig.
- ↑ M. Holz, M. Mayele: Influence of tilsetningsstoffer på Hydrofob Association i Polynary vandige blandinger. I: DFG Research Report. Termodynamiske egenskaper til komplekse væskeblandinger. Wiley-VCH, 2004, ISBN 3-527-27770-6 , s. 150-183.
- ↑ Ralf Quibeldey: Vikings Christmas. I: Spiegel online. 25. desember 2004. (online)
- ↑ Forordning om reduksjon av kjemisk risiko , vedlegg 2.7 , fra 1. januar 2016.
- ↑ F. Bengen, W. Schlenk: Om nye tilsetningsforbindelser av urea. I: Experientia. 5, 1949, s. 200, doi: 10.1007 / BF02172488 .
- ^ Wilhelm Keim , Arno Behr, Günter Schmitt: Grunnleggende om industriell kjemi. Tekniske produkter og prosesser. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 250.
- ^ R. Rigamonti, V. Riccio: Separasjon av fettsyrer og triglyserider ved hjelp av urea-tilsetningsforbindelser. I: Fett og såpe. 54, 1952, s. 193, doi: 10.1002 / lipi.19520540402 .
- ↑ Roger W. Floyd, Marie P. Stone, WK Joklik: Separasjon av enkelt-trådede ribonukleinsyrer av akrylamid-agarose-urea-gel-elektroforese. I: Analytisk biokjemi. 59, 1974, s. 599-609, doi: 10.1016 / 0003-2697 (74) 90313-3 .
- ↑ Marina Bährle-Rapp: Springer Lexicon Cosmetics and Body Care . Springer Verlag, 2013, ISBN 978-3-642-24687-6 , s. 255.
- ^ Jürgen Falbe, Manfred Regitz: Römpp Lexikon Chemie . Thieme Verlag, 1997, ISBN 3-13-734710-6 , s. 1330.
- ↑ James E. Wright, Arthur Retnakaran: Chitin og Benzoylphenyl Ureas . Dr W. Junk Publishers, 1987, ISBN 94-010-8638-9 , s. 101-110.
- ^ Wei Xu, Huimin Zhang, Gang Li, Zucheng Wu: Nikkel-kobolt bimetallanode katalysatorer for direkte urea brenselcelle. I: Vitenskapelige rapporter. 4, 2014, s. 5863, doi: 10.1038 / srep05863 .
- ↑ Neil Hazon, Alan Wells et al: Urea basert osmoregulering og endokrine kontroll i elasmobranch fisk med spesiell referanse til euryhalinity. I: Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 136, 2003, s. 685-700, doi: 10.1016 / S1096-4959 (03) 00280-X .
- ↑ Ulrich Kuhlmann: nefrologi: patofysiologi - klinikk - nyreerstatningsprosedyre . Georg Thieme Verlag, 2008, ISBN 978-3-13-700205-5 , s. 563.
- ^ R. Oltner, H. Wiktorsson: Urea-konsentrasjoner i melk og blod påvirket av fôring av forskjellige mengder protein og energi til melkekyr. I: Livdyrproduksjon. 10, 1983, s. 457-467, doi: 10.1016 / 0301-6226 (83) 90073-8 .
- ↑ a b Sluttrapport om sikkerhetsvurderingen av urea. I: International journal of toxicology. Volum 24, Suppl 3, 2005, s. 1-56. PMID 16422263 .
- ↑ Martina Baumgartner, Martina Flöck, Petra Winter: Evaluering av analyse av strømningsinjeksjon for bestemmelse av urea i sauemelk og kumelk. I: Acta Veterinaria Hungarica. 50, 2002, s. 263, doi: 10.1556 / AVet.50.2002.3.2 .







![{\ displaystyle {\ ce {2NH_3 + CO2 -> [H2NCOO] NH4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/064180d2da392465a849de890745ec6f33f85852)
![{\ displaystyle {\ ce {[H2NCOO] NH4 <=> H2NCONH2 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3e33168def5964a52242ceb4fd51bafcf34fecc5)