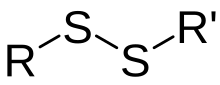Disulfide bro
I kjemi betegner en disulfidbro , disulfidbinding eller disulfidbinding en kovalent binding mellom to svovelatomer hvis eneste frie valens er mettet med en organylradikal . I biokjemi er disulfidbindingen den kovalente bindingen (en atombinding ) mellom svovelatomene i to cysteinmolekyler som vises i aminosyresidekjeden til et protein .
To cysteinrester i proteiner koblet ved hjelp av en disulfidbinding er også kjent som cystinbroer .
funksjon
Disulfidbroer dannes og stabiliserer den tredimensjonale proteinstrukturen (tertiær struktur) gjennom dannelse av løkker i aminosyrekjedene eller kobler flere aminosyrekjeder for å danne et funksjonelt protein . Som kovalente bindinger har disulfidbroer en betydelig mer fikserende effekt enn for eksempel hydrogenbindinger som også forekommer i molekylet og som anses å være mindre valensbindinger .
Dannelsen av disulfidbindinger kan være et separat trinn i brettingen av et protein uten å forsinke påfølgende foldetrinn .
Eksempler
Disulfidbindinger er typiske for sekretoriske proteiner fordi de ikke kan dannes i cytosolen.
insulin
Dermed blir proteohormone insulin fra to forskjellige kjeder av aminosyrer, som er referert til som A- og B-kjeden, A-kjeden intrachenar av og interchenar er koblet til B-kjeden av to disulfidbindinger.
Lipase
En lipase , et lipolytisk enzym fra bukspyttkjertelen ( bukspyttkjertelen ) hos grisen, har syv disulfidbroer.
GPCR-er
G-proteinkoblede reseptorer er membranbundne proteiner som stabiliseres av en disulfidbro mellom den tredje transmembrane spiralen og den andre ekstracellulære sløyfen. Mutasjonsstudier viser at reseptoren ikke lenger uttrykkes når en av de involverte cysteinene blir mutert til serin .
Obligasjonsdannelse
reaksjon
De funksjonelle gruppene som er involvert i dannelsen av en disulfidbinding kalles tiolgrupper (merkaptogrupper). I forenklede termer kan dannelsen av en slik SS-binding forstås som oksidasjon (frigjøring av hydrogen eller elektroner):
Oksidasjon: R-SH + HS-R '→ RSSR' + 2 H + + 2e -
Reduksjon: 2 Fe 3+ + 2 e - → 2 Fe 2+
I biokjemi betegner R og R 'cysteinene på peptidet / proteinet. De to overskytende hydrogenatomer er bundet av en hydrogenakseptor (betegnelsen [H] gjør det klart at de ikke frigjøres som hydrogengass). De kan til slutt overføres til oksygen , for eksempel .
- 4 [H] + O 2 → 2 H 2 O
tid
Disulfidbroer settes inn i proteinene under translasjon hvis deler av disse allerede er i endoplasmatisk retikulum (ER) (i eukaryoter) under syntesen , eller etterpå, hvis de er helt i ER eller en annen membranbelagt celleorganell , hva representerer deretter en post-translationell modifikasjon . Når det gjelder prokaryoter, gjelder dette analogt med oversettelse til periplasma.
Siden dannelsen av en disulfidbro fra to merkaptogrupper er en oksidasjon, kan reaksjonen bare finne sted i et oksidativt miljø. Cytoplasmaet er et reduserende miljø, så cytoplasmatiske proteiner inneholder vanligvis ikke disulfidbroer.
Enzymer
Dannelsen av disulfidbindinger er ikke en spontan prosess; det er en redoksreaksjon som krever en passende reaksjonspartner for elektronoverføring. Formasjonen er enzymkatalysert. Hvis et protein også har mer enn to cysteiner, er det mulig at kobling av "feil" cysteiner vil resultere i disulfidbroer som ikke tilsvarer den opprinnelige tilstanden til proteinet. Feil disulfidbroer må bindes på nytt ( blandes om ).
Proteindisulfidisomeraser
Eukaryoter har proteindisulfidisomeraser (PDI) i deres endoplasmatiske retikulum (ER ). Den progressive brettingen bringer sakte cysteiner som hører sammen i romlig nærhet, noe som gjør korrekte lenker stadig mer sannsynlige.
Thio-disulfide oksidasoreduktaser
Det prokaryote motstykket til proteindisulfidisomerasene er det periplasmatiske og indre membran-permanente Dsb-systemet (dsb fra disulfidbinding), som styrer disulfiddannelse og isomerisering.
GSH / GSSG-system
Glutation (GSH) er et isopeptid som er tilstede i cytoplasmaet til både prokaryoter og eukaryoter og deltar i dannelsen av disulfidbroer. Det reagerer i en disulfidutvekslingsreaksjon:
R og R 'er igjen cysteinene i proteinets ryggrad, GSSG er GSH- dimeren med en disulfidbro (uttrykt med svovelatomene "SS" skrevet ved siden av hverandre).
- R-SH + GSSG → RSSG + GSH
Venstre av de to produktene kalles blandet disulfid. Det vil fortsette å bli implementert:
- RSSG + HS-R '→ RSSR' + GSH
I cytosolen holdes den (enzymatisk) i redusert form (GSH). Man snakker om å "redusere forholdene".
Disse forholdene kan illustreres ved de relative konsentrasjonsforholdene mellom GSH og den tilsvarende disulfid-broede dimeren GSSG:
| Celle rom | GSH | GSSG |
|---|---|---|
| Cytosol | 60 | 1 |
| HAN | 1 | 2 |
Forholdene i ER tilsvarer det ekstracellulære miljøet i nærvær av oksygen (lumenet til ER er topologisk ekvivalent med det ytre rommet).
GSH spiller også en rolle i oksidativt stress .
Viktigheten for rekombinant proteinuttrykk
Disulfidbroer i proteiner begrenser deres rekombinante uttrykk, dvs. H. deres bioteknologiske produksjon.
I eukaryoter dannes disulfidbroer i endoplasmatisk retikulum. Imidlertid er uttrykkssystemer ofte prokaryoter som ikke har ER. Hvis proteinet blir oversatt til cytosolen, kan det ikke dannes noen disulfidbroer (se GSH / GSSG-systemet).
Dannelse av inklusjonsorganer
Uten disulfidbroer forstyrres brettingen av proteinet. I tillegg til proteolytisk nedbrytning, kan overdreven produksjon (overekspresjon) av proteinet, som er ønsket av hensyn til utbytte, føre til dannelse av inklusjonslegemer ( proteinaggregering for å danne det såkalte inklusjonslegemet ). Det indre av inklusjonslegemet er beskyttet mot reduksjon og danner derfor vilkårlige disulfidbroer til andre proteiner. Både feilfolding og dannelse av inklusjonslegemer gjør ytterligere arbeidstrinn nødvendige for rensing av proteinet og gir i noen tilfeller bare en begrenset mengde funksjonelt protein.
Resolubilisering med reduksjonsmidler
DTT (ditiotreitol) , merkaptoetanol , tris (2-karboksyetyl) fosfin og DTE (ditioerytritol) er reduksjonsmidler for disulfidbindinger. De brukes i biokjemi for å bryte opp de vilkårlig dannede disulfidbindinger i inklusjonslegemer.
Dette gjøres ved å redusere dem, som vist på bildet. De individuelle proteinene skilles derved fra hverandre og oppløses igjen. Man snakker om resolubilisering (engelsk løselig = løselig) av proteinene.
Reoksidering med glutation
Proteinene fra denne prosessen inneholder bare reduserte disulfidbindinger. For å oppnå funksjonelt protein, må proteinet brettes riktig. For å gjøre dette, må disulfidbindingene re-etableres og dette på en kontrollert måte slik at bare de "ønskede" cysteinparene binder seg til hverandre.
For å oppnå dette behandles proteinene med glutation (GSH). Disulfidbindingene blir oksidert til sin opprinnelige tilstand (= "tilbake-oksidasjon" til bindingstilstanden til dette proteinet gitt av naturen). Under denne prosessen må forskjellige forhold tilpasses og overholdes for å unngå fornyet proteinaggregering (se dannelse av inklusjonslegemer). For dette formål varieres og optimaliseres protein- og GSH-konsentrasjonene, pH-verdien til løsningen, temperatur og reaksjonstid.
Det er også mulig å tilsette brettende tilsetningsstoffer som arginin, som også støtter riktig dannelse av disulfidbindinger. Med det som er kjent som puls renaturering , ikke alle av proteinet tilsettes til renaturering oppløsningen ved begynnelsen av renaturering . I stedet, etter å ha tilsatt små porsjoner, er det en kort ventetid for å gi proteinene som allerede er i løsningen tid til å brette seg. Brettede proteiner samler seg ikke lenger, noe som reduserer risikoen for at utfoldede proteiner kolliderer og danner inklusjonslegemer med hverandre.
Uttrykk i periplasma
I periplasmaet til prokaryoter, i motsetning til i cytosolen, hersker oksiderende forhold. Her eksisterer ikke et GSG / GSSG-system, for den ytre membranen er proteiner som er mindre enn 500 Da, permeable (GSH har en molær masse på bare 307,3 g / mol). Oksygen kan også diffundere gjennom den ytre membranen. Det rekombinante uttrykket av proteiner med disulfidbindinger blir derfor også undersøkt med periplasma som et mål.
Individuelle bevis
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: aminosyrer, peptider, proteiner , Verlag Chemie, Weinheim, s. 101, 1982, ISBN 3-527-25892-2 .
- ^ Creighton, TE. Proteinfolding koblet til dannelse av disulfidbinding. Biol Chem . 1997 Aug, 378 (8): 731-744.
litteratur
- W. Thieman, M. Palladino: Bioteknologi. Pearson Studium, Tyskland, 2007, ISBN 978-3-8273-7236-9