Denaturering (biokjemi)

Denaturering beskriver en strukturell endring i biomolekyler som proteiner eller deoksyribonukleinsyre (DNA), som i de fleste tilfeller er forbundet med et tap av den biologiske funksjonen til disse molekylene, selv om deres primære struktur forblir uendret. Denaturering kan skyldes fysiske eller kjemiske påvirkninger.
prinsipp

Ekstern påvirkning kan forårsake strukturelle endringer i biopolymerer som proteiner eller nukleinsyrer i henhold til prinsippet om den minste begrensningen . Når et protein er denaturert, endres den sekundære og tertiære strukturen (og dermed muligens også den kvaternære strukturen ) uten å endre sekvensen til aminosyrene , dens primære struktur . Imidlertid mister proteinet sin opprinnelige brettform , som også er kjent som den opprinnelige konfigurasjonen eller konformasjonen av polypeptidkjeden. Med tapet av folden går også funksjonen til proteinet tapt, med unntak av de iboende ustrukturerte proteinene . Prosessen med denaturering kan være irreversibel (irreversibel) eller reversibel (reversibel), avhengig av om den opprinnelige formen også representerer den energisk mest gunstige tilstanden. Den omvendte prosessen med denaturering kalles også renaturering . Siden mange proteiner kan renatureres og funksjonen deres kan gjenopprettes, ble det antatt at proteinfolding skjer under proteinbiosyntese fordi den opprinnelige formen vanligvis representerer den mest energisk gunstige tilstanden ( Anfinsen dogma ).
Slike reversible endringer i den molekylære strukturen forekommer for eksempel i tilfelle av varmedenaturering av DNA når det brytes opp i enkle tråder ved oppvarming - for eksempel for en polymerasekjedereaksjon (PCR) - og deretter avkjøles igjen. Dobbeltstrenget DNA og RNA holdes sammen under baseparing av hydrogenbindinger , som brytes reversibelt når denatureres. På den annen side, etter en irreversibel endring i molekylstrukturen, kan den opprinnelige romlige strukturen til molekylet ikke gjenopprettes. Et frokostegg gjennomgår for eksempel slike endringer når det kokes, som ikke kan konverteres til sin forrige tilstand ved å kjøle seg ned, når det først har blitt et "hardt egg", eller ved videre tilberedning. Denaturering av proteiner fører vanligvis til at molekylet inaktiveres, noe som betyr at det knapt eller ikke lenger kan oppfylle sin biologiske funksjon . Dette er grunnen til at denaturering også brukes til desinfisering .
Alle denatureringsprosesser har til felles at kovalente bindinger ikke blir delt (bortsett fra disulfidbroene i proteiner), og dermed blir den primære strukturen beholdt. Kjedestrukturen og dermed sekvensen til byggesteinene som den primære strukturen beholdes. Tilførsel av energi får imidlertid individuelle byggesteiner, nukleotider og aminosyrer eller til og med hele molekylkjeden til å vibrere så mye at andre bindingskrefter ( ioniske , polære og van der Waals-interaksjoner , hydrogenbindinger, hydrofobe effekter ) mellom forskjellige områder av molekylære kjeder blir kansellert og slike bånd blir brutt. Disulfidbroer i proteiner spaltes for det meste ved reduksjon med sulfhydryler. Når det gjelder proteiner, observeres ofte en reduksjon i løselighet i tilfelle denaturering , noen ganger ledsaget av dannelsen av proteinaggregater . Denaturering øker også følsomheten for nedbrytning av proteaser .
Konformasjonsendringer i biopolymerer kan måles ved bruk av FTIR , dobbel polarisasjonsinterferometri , sirkulær dikroisme , QCM-D , NMR-spektroskopi og multiparametrisk overflateplasmonresonansspektroskopi .
Denaturering på grunn av fysisk påvirkning
De vanligste denatureringene under fysisk påvirkning er varmedenaturering og strålingsdenaturering. I fysiske termer kan denaturering også være forårsaket av høyt trykk, kraftig omrøring, risting, ved virkning av ultralyd og ved grensesnittabsorpsjon.
Varme denaturering
Varme eller varmedenaturering er en type denaturering der en endring i molekylstrukturen oppstår ved å øke temperaturen. I de fleste tilfeller blir ingen kovalente kjemiske bindinger ødelagt eller dannet av varmen , så den primære strukturen forblir uendret. I stedet er hydrogenbindinger brutt eller nylig dannet, som vanligvis er bindinger mellom kjedeseksjoner, noe som ofte resulterer i en endring i den tertiære strukturen til enzymer og andre proteiner. Dette resulterer vanligvis i tap av biologisk aktivitet og reduksjon i løselighet. Sistnevnte blir da merkbar som "flokkulering" eller "koagulasjon". Siden i proteinfolding og hydrofobe effekter spiller en rolle, genereres denatureringen også av reduksjon av den hydrofobe effekten med økende temperatur. En varmedenaturering (som andre denatureringer) kan være reversibel hvis strukturendringene ennå ikke er for dype, men det er ofte irreversibelt (irreversibelt). Imidlertid er en reversering mulig under laboratorieforhold ved hjelp av sentrifuger og tilsetning av urea . På grunn av skjærkreftene som oppstår , kan kyllingegg for eksempel delvis "kokes". Temperaturen der denatureringen av proteinene begynner er veldig forskjellig avhengig av struktur og organisme. Enzymene ifølge hyper- termofil archaea behøver å motstå temperaturer godt over 80 ° C. Denaturering ved oppvarming økes i lett sur løsning. Den termiske denatureringen av proteiner foregår vanligvis i et relativt smalt temperaturområde, og det ble derfor antatt at et kooperativ som utfolder seg under denatureringen, dvs. H. en utvikling favoriserer andre.
Ved autoklavering være patogener til gjenstander ved hjelp av denaturering av viktige biopolymerer inaktiverte. Ved autoklavering må en temperatur over 100 ° C med økt trykk opprettholdes i en spesifisert tid for å sterilisere trygt .
Nukleinsyrer denatureres innenfor et meget smalt temperaturområde, også kjent som " smeltepunktet ", som vanligvis er over 80 ° C. Denatureringen er reversibel. Når nukleinsyrene avkjøles, monteres enkeltstrengene igjen. Denne prosessen brukes i molekylærbiologi for å utføre PCR for å replikere visse gener fra en organisme in vitro: ekstrahert DNA smeltes i en reaksjonskar ved høye temperaturer på rundt 95 ° C (denaturering). Deretter senkes temperaturen igjen til en viss temperatur. Denne glødetemperaturen avhenger av grunningene og er vanligvis 2-3 ° C under deres respektive smeltepunkt (for det meste 50 til 65 ° C). Primerne i løsningen fester seg til enkeltstrengene av DNA (kalt annealing eller primer hybridisering). Strengene fullføres deretter igjen (forlengelse) ved en temperatur på 68 til 72 ° C ved hjelp av en Taq-polymerase . Syklusen med denaturering, gløding og forlengelse starter på nytt. Omtrent 25 til 50 sykluser utføres. Den reversible denatureringen av DNA brukes opptil 50 ganger for å replikere et ettertraktet gen i en organisme. Ved denaturering øker utryddelsen av DNA med omtrent 40% ved en bølgelengde på 260 nm.
Denaturering ved trykk
Siden reaksjonsvolumene i proteinfolding er veldig små, må du vanligvis bruke et trykk på flere 1000 bar for å brette ut proteiner. Likevel blir høytrykksbehandling av mat mer og mer viktig i praksis. For dette formålet legges maten, for det meste pakket i folier, i et trykkmedium, som f.eks B. vann, og trykket påføres dette mediet. I denne "ikke-termiske prosessen" inaktiveres en høytrykkspasteurisering , uønskede mikroorganismer og enzymer, og maten bevares. Tap av kvalitet, for eksempel når du bruker varme, unngås.
Generelt påvirkes proteinenes tertiære og kvaternære struktur av trykk, mens den sekundære strukturen knapt kan endres.
Denaturering ved stråling
Infrarød , mikrobølger eller annen langbølget stråling har en denaturerende effekt på grunn av temperaturøkningen. I tilfelle av ioniserende stråling ( ultrafiolett , gamma og røntgenstråler ) vil ytterligere kovalente bindinger, f.eks. B. brytes ned av nukleinsyrer og dermed føre til DNA-skade som kjedebrudd (depolymerisering). I tillegg kan det oppstå nye kovalente bindinger (for eksempel dimerisering i nukleinsyrer) som et resultat av bindingsspaltingen .
Denaturering på grunn av kjemisk påvirkning
Årsakene til proteinnedenaturering kan for eksempel være kjemiske stoffer som noen syrer , baser , salter (f.eks. Guanidiniumsalter ), vaskemidler eller urea . Proteinstrukturer kan også påvirkes av tungmetaller , da ionene danner komplekse strukturer med aminosyrerester og dermed endrer den biologisk aktive strukturen til proteinet.
Syre og alkali denaturering
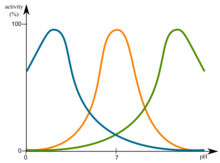
Avhengig av pH-verdien til det naturlige miljøet til proteinet, har proteiner en optimal pH. Dette optimale kan være i det sure pH-området, slik det er eksempelvis med lysosomale proteiner. I andre tilfeller kan dette imidlertid også være grunnleggende. Et protein er mest stabilt i området med optimal pH og denaturerer derfor ikke.
Syredenatureringen, for eksempel med 40% (V / V) eddiksyre, fører til ladningsskift mellom molekylene og til slutt til en gjenfolding av proteinet til den energisk mest gunstige tilstanden under de respektive betingelser. De sure frigir protoner (H + ) og dermed forårsaker ladning forandring i proteinstrukturen, slik at hydrogenbindingene blir delvis ødelagt, og de samme positive ladninger frastøte hverandre. I tillegg frigjør syren protoner (H + ) til karboksylatgruppen (COO - ) av aminosyrene aspartat og glutamat, slik at karboksygrupper –COOH dannes og deres tidligere negative ladninger forsvinner. Dette betyr at ioniske interaksjoner mellom karboksygruppen og de positive ladningene i proteinet ikke lenger er mulig.
Tilsvarende alkaliske løsninger kan også endre sammensetningen av ionene via pH-verdien , men aminogrupper deprotoneres av lysin eller arginin , noe som betyr at færre positive ladninger forekommer i proteinet som kan samhandle med negativt ladede grupper. I tillegg deprotoneres karboksylsyregrupper til karboksylater, hvorved hydrogenbindinger kan ødelegges og det oppstår flere negative ladninger i proteinet, som frastøter hverandre.
Med syre- eller alkalidenaturering kan hydrolyse av proteinet forekomme samtidig .
Når det gjelder pH er det isoelektriske punktet (pl) av et protein også viktig. På dette tidspunktet er et protein i nettoladningen uladet og faller derfor raskt ut av løsningen. Proteinet er derfor veldig følsomt ved pI.
Denaturering av kaotroper
Salter og andre kaotroper har også innflytelse på hydrofobe effekter og kan derfor forårsake denaturering, men avhengig av stoffet kan påvirkningen også gå i retning av renaturering. I forhold til nedbøren snakker man om “salting in” og “salting out”. Den relative innflytelsen til anionene og kationene som danner salter er beskrevet av " Hofmeister-serien ".
DNA representeres av formamid (70% V / V), dimetylformamid , guanidiniumsalter (6 M), natriumsalisylat , sulfoksid , dimetylsulfoksid (DMSO, 60% V / V), natriumhydroksid (1 M ), forskjellige alkoholer , propylen glykol og urea (6 M) denaturert, vanligvis i kombinasjon med varme. Dette resulterer i en senking av smeltetemperaturen til dobbeltstrenget DNA.
Denaturering med vaskemidler
Noen overflateaktive stoffer fører til denaturering. Dette er fordi de fester seg over hele proteinet og derved lineariserer det. Joniske vaskemidler denaturerer mest, f.eks. B. en en-prosent løsning av natriumlaurylsulfat (SDS). De fleste proteiner er allerede denaturert ved romtemperatur. I tillegg frigjøres også membranlipider fra cellemembranene , da miceller dannes fra overflateaktivt middel og membranen over en viss konsentrasjon . SDS-denatureringen er z. B. brukt i prøveutarbeidelse for SDS-PAGE .
Denaturering med etanol
Tilsvarende syredenaturering, etanol eller andre vannløselige, kan organiske løsningsmidler forstyrre hydrogenbindinger og hydrofobe interaksjoner som kreves i biopolymerer for å opprettholde strukturen ved å forstyrre som polære organiske løsningsmidler. 50 til 70 prosent etanol denaturerer de fleste proteiner. Siden membranproteinene også mister funksjonen på grunn av oppløsningen av membranlipidene og denatureringen av den romlige strukturen, og cellene i spørsmålet sprekker som en såpeboble, kan alkoholer med høyere prosentandel (f.eks. Etanol, isopropanol ) brukes til desinfisering: bakterier og soppceller er denaturert. Membranproteinene og perforeringen av cellemembranen inaktiveres irreversibelt, følgelig blir innhyllede virus også fratatt lipidhylsen , hvor de forankrende proteiner er lokalisert, samtidig som proteinene denatureres.
Denaturering med rent vann
Proteiner er i sitt naturlige miljø i nærvær av andre proteiner, oppløste salter , kofaktorer eller metabolitter, som stabiliserer den naturlige proteinstrukturen på en mer eller mindre kompleks måte. Hvis salter og andre mindre molekyler fjernes ved dialyse av en proteinoppløsning mot dobbeltdestillert vann - helst i kulde - kan man ofte oppnå selektiv (og reversibel) denaturering, spesielt av store proteiner, som utfelles under disse forholdene.
Denaturering gjennom modifikasjon og tverrbinding
Bruken av molekylære markeringer , fikseringsløsninger og garvemidler , kovalente tverrbindere (f.eks. Formaldehyd , paraformaldehyd eller glutaraldehyd ) og løsninger av tungmetallioner som danner stabile komplekser endrer av og til det katalytiske sentrum eller et bindingssted for et protein på en slik måte at noen funksjoner kan ikke lenger oppfylles. Proteinet brettes ikke ut her (som med termiske, kaotrope eller pH-avhengige denatureringer), men det kan endres eller fikses i en ikke-naturlig konformasjon og miste funksjoner. Hvis nødvendige funksjoner av proteinet forblir upåvirket av fiksering, kan andre egenskaper som den biologiske halveringstiden også endres ved tverrbinding . I løpet av antigenavmaskeringen blir det forsøkt å reversere effekten av fiksering.
Denaturering i levende ting
Proteiner brettes delvis ut i celler før membrantransport av chaperones og deretter brettes tilbake. Baseparringen av DNA brytes i seksjoner av forskjellige DNA-bindende proteiner , f.eks. B. i replikasjon eller transkripsjon . Plasseringen av starten på denaturering kalles denatureringsboblen og er beskrevet i Polen-Scheraga-modellen . Imidlertid er ikke DNA-sekvensen , stivhet og vridning inkludert. Levetiden til en denatureringsboble er mellom et mikrosekund og et millisekund.
Renaturering
Etter at et protein (f.eks. Et enzym ) har blitt denaturert under rensingen fra en proteinblanding, er det nødvendig å returnere proteinet til dets opprinnelige form for å måle den biologiske aktiviteten. Dette fungerer imidlertid bare med proteiner hvis naturlige konformasjon også representerer den energisk mest gunstige tilstanden under isotoniske forhold, men ikke med metastabile proteiner. Renaturering etter kjemisk denaturering kan oppnås ved langsomt å fortynne denatureringsmidlet, ledsaget av restaurering av kofaktorene og det isotoniske miljøet. Andre tilsetningsstoffer brukes noen ganger. En rekonstitusjon kan gjøres etterpå. I tilfelle termisk denaturering av nukleinsyrer hybridiserer disse igjen når temperaturen synker. Renatureringshastigheten for baseparringen av nukleinsyrer øker med andelen riktig baseparring.
Differensiering fra andre endringer
De strukturelle endringene som medieres av proteiner blir ikke referert til som denaturering:
- molekyler syntetisert , transformert eller nedbrutt av enzymer , aktiverings- og deaktiveringsreaksjoner; for eksempel koaguleres melkeprotein av løpeenzymer
- Konformasjonsendringer på grunn av chaperones eller prions .
Ved veldig høye temperaturer kan kovalente bindinger også splittes og dermed kjedebrudd ( depolymerisering ). Slike endringer i den primære strukturen regnes ikke som denatureringer. På samme måte kan syrer som baser føre til kovalente bindinger som bryter ved høye konsentrasjoner og reaksjonstemperaturer. Den primære strukturen endres deretter gjennom hydrolyse . Slike endringer i den primære strukturen er normale kjemiske reaksjoner og er ikke inkludert i denaturering.
Et borderline-tilfelle er spaltingen av disulfidbroer mellom to proteinstrenger. Selv om en kovalent kjemisk binding brytes, beholdes aminosyresekvensen i hver enkelt streng, og det er grunnen til at en slik reduktiv spaltning av disulfidbroer, som i prinsippet er reversibel, er en denaturering.
applikasjoner
Hos dyr blir proteiner denaturert i magen .
Denaturering brukes blant annet i produksjonen av proteinholdige matvarer , f.eks. B. når du lager mat og lager panir eller tofu . Denatureringen under tilberedningen gjør fordøyelsen lettere, i tillegg til å drepe mikroorganismer i maten og inaktivere virus . Ulike metoder for desinfisering og noen ganger også for konservering av matvarer (ved oppvarming eller tørking) bruker denaturering av proteiner fra uønskede mikroorganismer, som dreper dem. Når du lager en permanent bølge , denatureres håret for å endre form.
I biokjemi brukes denaturering til å brette ut proteiner, f.eks. B. kjemisk i SDS-PAGE eller proteinsekvensering . Når molekyler binder seg til et protein, kan den termiske stabiliteten til proteinet økes. Endringen i denatureringstemperaturen til et protein når et annet molekyl binder, kan måles med en termisk skift-analyse, og bindingen kan således påvises. For nukleinsyrer brukes PCR, DNA-sekvensering , Southern og Northern blot , in situ hybridisering , TGGE med termisk denaturering, mens DGGE og urea - eller formamid - polyakrylamidgelelektroforese med kjemisk denaturering brukes. Denaturering brukes også til å inaktivere enzymer i en DNA-ekstraksjon eller en RNA-ekstraksjon .
litteratur
- Friedrich Lottspeich , Haralabos Zorbas: Bioanalytika . Spectrum Academic Publishing House, Heidelberg 1998, ISBN 978-3827400413 .
- Hubert Rehm , Thomas Letzel: The Experimenter: Protein Biochemistry / Proteomics . 6. utgave, Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3827423122 .
weblenker
- Animasjon: proteindenaturering
- DFG Senatskommisjon SKLM: Sikkerhetsvurdering av høytrykksprosessen (PDF; 188 kB)
Individuelle bevis
- ↑ Jane H. Dyson, Peter E. Wright: Egen ustrukturerte proteiner og deres funksjoner i: Natur anmeldelser Molecular Cell Biology. (2005), bind 6, utgave 3, s. 197-208. doi: 10.1038 / nrm1589 .
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: aminosyrer, peptider, proteiner , Verlag Chemie, Weinheim, 402, 1982, ISBN 3-527-25892-2 .
- ↑ a b c d e Philipp Christen, Rolf Jaussi, Roger Benoit: Biochemistry and Molecular Biology. Springer-Verlag, 2015, ISBN 978-3-662-46430-4 , s. 36, 37.
- ↑ CB Anfinsen : Prinsipper som styrer brettingen av proteinkjeder. I: Vitenskap. Volum 181, nummer 4096, juli 1973, s. 223-230, PMID 4124164 .
- ↑ Yoshinori gruve, Tatsushi Noutomi, Noriyuki Haga: Termisk induserte endringer i eggehvite proteiner. I: Journal of Agricultural and Food Chemistry. 38, 1990, s. 2122, doi : 10.1021 / jf00102a004 .
- ↑ Charles Tanford : Protein denaturering. I: Fremskritt innen proteinkjemi. Volum 23, 1968, s. 121-282, PMID 4882248 .
- ↑ a b H. Robert Horton et al.: Biochemistry. Pearson Deutschland GmbH, 2008, ISBN 978-3-827-37312-0 , s. 144-146.
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: Aminosyrer, peptider, proteiner , Verlag Chemie, Weinheim, 403, 1982, ISBN 3-527-25892-2 .
- ↑ Yuan et al.: Shear-Stress-Medied Refolding of Proteins from Aggregates and Inclusion Bodies. I: ChemBioChem . Nr. 16, 2015, s. 393-396.
- ^ A b Peter Karlson: Karlsons Biochemie und Pathobiochemie. Georg Thieme Verlag, 2005, ISBN 978-3-133-57815-8 , s. 35.
- ^ Gerhard Richter: Praktisk biokjemi. Georg Thieme Verlag, 2003, ISBN 978-3-131-32381-1 , s. 144, 195.
- ↑ E. Palou, A. Lopet-Malo, GV Barbosa-Canovas og BG Swanson: High Pressure Treatment in Food Preservation , Marcel Dekker, New York., 1999
- ↑ Hans-Dieter Jakubke, Hans Jeschkeit: aminosyrer, peptider, proteiner , Verlag Chemie, Weinheim, 403-404, 1982, ISBN 3-527-25892-2 .
- ↑ JP Lopez Alonso, M. Bruix, J. Font, M. Ribo, M. Vilanova, MA Jiménez, J. Santoro, C. González, DV Laurents: NMR-spektroskopi avslører at RNase A er hovedsakelig denaturert i 40% eddiksyre : implikasjoner for oligomerdannelse ved bytte av 3D-domene. I: Journal of the American Chemical Society. Volum 132, nummer 5, februar 2010, s. 1621-1630, doi : 10.1021 / ja9081638 , PMID 20085318 .
- ↑ Popova, E.: Fase likevekt i utfelling av proteiner fra vandige løsninger. 2007, åpnet 20. november 2019 .
- ↑ J. Marmur, PO Ts'o: Denaturering av deoksyribonukleinsyre av formamid. I: Biochimica et Biophysica Acta . Volum 51, juli 1961, s. 32-36, PMID 13767022 .
- ↑ a b c d Academic Press: PROG NUCLEIC ACID RES & MOLECULAR BIO. Academic Press, 1963, ISBN 978-0-080-86289-7 , s. 267.
- ↑ a b Hyone-Myong Eun: Enzymology Primer for Recombinant DNA Technology. Elsevier, 1996, ISBN 978-0-080-53113-7 , s.67 .
- ↑ a b X. Wang, HJ Lim, A. Sønn: Karakterisering av denaturering og renaturering av DNA for DNA-hybridisering. I: Miljøhelse og toksikologi. Volum 29, 2014, s. E2014007, doi : 10.5620 / eht.2014.29.e2014007 , PMID 25234413 , PMC 4168728 (fri fulltekst).
- ↑ François Sicard, Nicolas Destainville, Manoel Manghi: DNA-denatureringsbobler: Fritt energilandskap og nukleering / lukking . I: The Journal of Chemical Physics . 142, nr. 3, 21. januar 2015, s. 034903. arxiv : 1405.3867 . doi : 10.1063 / 1.4905668 .
- ^ Simon Lieu: Polen-Scheraga-modellen. (2015): 0-5. Massachusetts Institute of Technology, 14. mai 2015.
- ^ C. Richard, AJ Guttmann: Polen-Scheraga-modeller og DNA-denatureringsovergang. I: Journal of Statistical Physics. 115, 2004, s. 925, doi : 10.1023 / B: JOSS.0000022370.48118.8b .
- ↑ Grégoire Altan-Bonnet, Albert Libchaber, Oleg Krichevsky: Bubble Dynamics in Double-Stranded DNA . I: Physical Review Letters . 90, nr. 13, 1. april 2003. doi : 10.1103 / physrevlett.90.138101 .
- ↑ Winfried Storhas: Bioprosessutvikling. John Wiley & Sons, 2013, ISBN 978-3-527-67385-8 , s. 621.
- ^ Rolf Knippers: Molekylær genetikk. Georg Thieme Verlag, 2015, ISBN 978-3-131-68330-4 .
- ^ Brockhaus ABC Chemie , VEB FA Brockhaus Verlag Leipzig 1965, s. 274.
- ↑ Robert Ebermann: Lærebok matkjemi og ernæring. Springer-Verlag, 2011, ISBN 978-3-709-10211-4 , s.57 .
- ↑ Peter W. Atkins: Fysisk kjemi. John Wiley & Sons, 2006, ISBN 978-3-527-31546-8 , s. 754.