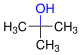Alkoholer

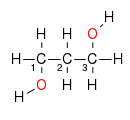
Alkoholer ( arabisk الكحول, DMG al-kuḥūl ) er organiske kjemiske forbindelser som har en eller flere hydroksylgrupper (–O - H) festet til forskjellige alifatiske karbonatomer .
Forskjellen mellom alkoholer og andre forbindelser med OH-grupper (for eksempel enoler , hemiacetaler eller karboksylsyrer ) som en del av den funksjonelle gruppen er som i alkoholer hvert karbonatom som bærer en OH-gruppe må være sp 3 -hybridized og bortsett fra at hydroksylgruppen kan bare være bundet til karbon- eller hydrogenatomer. Bare denne bindingstilstanden tilsvarer oksidasjonstilstanden til en normal alkanol .
Når hydroksylgruppen er bundet til et ikke-f 3- hybridisert karbonatom som er en del av en aromatisk ring , da disse forbindelser er referert til som fenoler og ikke hører til gruppen av alkoholer.
Mens alkoholer er mindre surt enn vann, og med en p- K- S- verdi på ca. 16 hører til de “meget svake syrer”, normale fenoler med et p- K- S -verdi på 10 tilhører det “svake syrer”.
etymologi
Ordet "alkohol" kommer fra det arabiske "kuhl" (arabisk: الكحل, romanisert: al-kuḥl), et pulver som brukes som eyeliner . "Al-" er den arabiske bestemte artikkelen, tilsvarende "the" på engelsk. Alkohol ble opprinnelig brukt til det meget fine pulveret som produseres ved å sublimere det naturlige mineralet stibnitt til antimontrisulfid Sb 2 S 3 . Det ble ansett essensen eller "ånden" til dette mineralet og ble brukt som et antiseptisk middel , eyeliner og kosmetisk middel . Betydningen av alkohol ble utvidet over tid til å omfatte destillerte stoffer generelt og ble deretter innsnevret til etanol når "spirit" var synonymt med sterk brennevin .
I sin oversettelse av Giovanni da Vigo fra 1543 var Bartholomäus Traheron den første til å introdusere ordet som et begrep for "fint pulver" brukt av "barbariske" forfattere. Vigo skrev: "de barbariske aukturene bruker alkohol, eller (som jeg finner det noen ganger sviktende) alkofoll, for mest finpudre." Arabiske kjemikere brukte også betegnelsen al-kuhl for andre stoffer som essenser som ble oppnådd ved destillasjon - en betydning som først ble brukt på engelsk til alkohol på 1600-tallet.
The Lexicon Chymicum av William Johnson fra 1652 ordbøker ordet som Antimonium sive stibium og refererte til en hvilken som helst væske ved destillasjon ble gjenopprettet, inkludert "vin alkohol", den destillerte essensen av vin. Libavius i Alchymia (1594) refererer til vini alkohol vel vinum alcalisatum . Johnson gloser alkohol vini som quando omnis superfluitas vini a vino separatur, ita ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat. Betydningen av ordet var begrenset til " vinånd " (kjemikaliet nå kjent som etanol) på 1700-tallet . Men selv på 1700-tallet ble alkohol ofte først definert som et pulver av fineste form og bare sekundært som alkohol. I organisk kjemi ble ordet utvidet til klassen av lignende forbindelser frem til 1808 (i en oversettelse av Lavoisiers "Elements of Chemistry" fra 1790 står alkoholholdig gass for "forbindelsen mellom alkohol og kalorier").
Nomenklatur og klassifisering
Navnet på enkle alkoholer er en kombinasjon av navnet på den opprinnelige alkanen og slutten "-ol" . I tillegg er posisjonen til OH-gruppen angitt med et foregående tall, for eksempel propan-2-ol . Et utdatert navn på alkoholer som var gyldig til 1957 er - ifølge et forslag fra Hermann Kolbe - karbinoler .
Stoffgruppen alkoholer er klassifisert i henhold til ulike kriterier (antall ikke-hydrogen naboer, valens, tilstedeværelse av dobbelt / trippelbindinger og kjedelengde).

Antall naboer som ikke er hydrogen
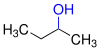
Det skilles mellom alkoholer i henhold til antall karbon- og hydrogenatomer på karbonatomet i den funksjonelle gruppen som hydroksylgruppen også er bundet til. Når det gjelder primære alkoholer, er to H-atomer bundet til dette karbonatomet i tillegg til ett karbonatom, i sekundære alkoholer i tillegg til to karbonatomer ett hydrogenatom og i tertiære alkoholer i tillegg til tre karbonatomer, ingen hydrogenatom. Et spesielt tilfelle er alkohol med bare ett karbonatom, metanol, som i tillegg til hydroksylgruppen bare har tre hydrogenatomer på karbonatomet i den funksjonelle gruppen.
Valens av alkoholer
Hvis det er mer enn én hydroksylgruppe på forskjellige karbonatomer i en alkohol -molekyl , er deres antall indikeres ved å innføre en gresk stavelse (di-, tri- etc.) før den ender -ol , som svarer til antallet av hydroksylgrupper , og man snakker om flerverdige alkoholer. En alkan- di- ol er etan-1,2-diol (trivielt navn etylenglykol ), en alkan- tri- ol , propan-1,2,3-triol (vanlig navn glyserol ). Tallet før slutten -ol indikerer posisjonen til den / de funksjonelle gruppene. Dette gjelder også monohydriske alkoholer, for eksempel propan-2-ol (vanlig navn isopropanol ).
Strukturformel av etanol
Strukturformel propan-1,2-diol
Strukturformel propan-1,3-diol
Dobbelt- eller trippelbindinger
Når det gjelder tilstedeværelsen av dobbelt- eller trippelbindinger i kjeden av karbonatomer, skilles det mellom alkanoler (avledet fra alkaner ), alkenoler (avledet fra alkener ) og alkynoler (avledet fra alkyner ). I tilfelle at OH-gruppen er bundet til et sp 2- hybridisert karbonatom, har man å gjøre med en annen oksidasjonstilstand og dermed med en annen gruppe stoffer, nemlig med de mest ustabile enolene .
Strukturell formel av allylalkohol ( 2-propen-1-ol )
Strukturformel av butynediol
Strukturformel av askorbinsyre , en eniol
Kjedelengde
Det skilles også mellom alkoholer basert på kjedelengden. Uttrykket fettalkoholer brukes for alkoholer med en terminal primær -OH-gruppe med rett kjede og en lengde på seks ( heksanol ) opp til 22 ( behenylalkohol ) karbonatomer. De er hovedsakelig hentet fra fettsyrer ved å redusere –COOH-gruppen . De høyere primære alkoholene med 24 til 36 karbonatomer kalles voksalkoholer .
Fysiske egenskaper
Alkoholer med lav molekylvekt er væsker som har en karakteristisk lukt og en brennende smak. Høyere alkoholer er for det meste faste forbindelser med bare en svak lukt. På grunn av intermolekylære hydrogenbindinger har alkoholene relativt høye smelte- og kokepunkter sammenlignet med hydrokarboner med samme molekylvekt . Den viktigste vanlige egenskapen til alkoholene er deres hydrofilisitet . Denne egenskapen avtar med økende lengde av alkylradikalet og øker med antall hydroksylgrupper. Spesielt kortkjedede alkoholer brukes ofte som løsemidler på grunn av deres amfifile karakter .
Høye kokepunkter

Oksygen er mer elektronegativ enn hydrogen og karbon; det vil si at den tiltrekker seg elektroner sterkere enn disse. Dette fører til en usymmetrisk fordeling av elektroner langs C-O-H-bindingen ; man snakker om en polær binding, en molekylær dipol dannes. Disse dipolene kan danne hydrogenbindinger med hverandre , noe som drastisk øker tiltrekningen mellom de enkelte molekylene. For alkoholer fører dette til relativt høye kokepunkter sammenlignet med homologene til deres moderforbindelser, som forlenges med en metylenenhet og har omtrent samme molare masse . For eksempel, den ikke-polare etan (C 2 H 6 ) (M = 30) har et kokepunkt på -89 ° C, mens metanol (CH 3 OH) (M = 32) bare når denne ved 65 ° C.
Oppsummert:
- Sammenlignet med alkaner med en tilsvarende molær masse, har alkoholer et høyere smelte- og kokepunkt fordi hydroksylgruppen (OH-gruppen) danner hydrogenbindinger .
- Jo flere hydroksylgrupper et molekyl har, jo flere hydrogenbindinger kan dannes og jo høyere kokepunkt.
- Van der Waals-krefter utvikler seg også mellom alkylradikalene . Derfor øker kokepunktet med lengden av alkylradikalet
- Siden styrken av Van der Waals-interaksjonene ikke bare avhenger av størrelsen på alkylradikalet, men også på overflaten, har svært forgrenede, ganske sfæriske molekyler med en sentral hydroksylgruppe et lavere kokepunkt enn rette, langstrakte, primære alkoholer.
Hydrofilisitet
OH-gruppen er også i stand til å danne hydrogenbindinger med vann. Det øker hydrofilisiteten , vannløseligheten, i forbindelsen. Organiske alkylradikaler i seg selv er ikke vannløselige, dvs. hydrofobe . Vannløseligheten avtar derfor med størrelsen på den organiske fraksjonen og øker med antall hydroksylgrupper. Propanolene og tert- butanol er fremdeles blandbare med vann i et hvilket som helst forhold ved romtemperatur. Alle langkjedede alkoholer oppløses bare i stadig mindre mengder. Større mengder oppløste uorganiske salter kan også føre til at kortkjedede alkoholer fasesepareres ("saltbelastning").
Oppsummert:
- Hydroksylgruppen i en alkohol er polær på grunn av den ujevne ladningsfordelingen. Dermed er også dets evne til å danne hydrogenbindinger med polære vannmolekyler ansvarlig for den gode løseligheten til kortkjedede alkoholer.
- Jo flere hydroksylgrupper en alkohol har, jo flere hydrogenbindinger kan den danne med vannet. Derfor, jo større antall hydrofile hydroksylgrupper, jo større vannløselighet.
- Imidlertid motvirkes denne effekten av den hydrofobe, dvs. vannavstøtende, ikke-polare alkylradikalen: jo lenger den er, desto lavere er vannoppløseligheten til alkoholen.
Surhet og deprotonering
Med en p- K- S- verdi (syrestyrke) på rundt 16, alkoholer er mindre surt enn vann og dermed reagere tilnærmet nøytral i vandig oppløsning. Surheten til alkoholene synker i serien fra metanol gjennom primære, sekundære og tertiære alkoholer. Det er mulig å bruke alkoholer med sterke baser som f.eks. B. å deprotonere hydridanioner eller ved reaksjon med natrium med utvikling av hydrogen. De resulterende alkoholatene kan deretter brukes som sterkt nukleofile anioner for ytterligere reaksjoner.
Det er også mulig å protonere alkoholer til en viss grad med sterke syrer:
Spektroskopi
I IR-spekteret av alkoholer, det brede bånd av O - H strekking vibrasjon i området 3200-3650 cm -1 kan sees tydelig. Bredden på toppen er forårsaket av hydrogenbindinger med vannmolekyler og kan finnes i spektrene til vannfrie alkoholer i et smalere område på 3620–3650 cm −1 .
Kjemiske egenskaper
Reaksjon med konsentrert svovelsyre
Under 140 ° C, danner esteren svovelsyre .
Kondensasjonsreaksjonen for å danne en eter skjer ved ca. 140 ° C.
Over 170 ° C blir primære alkoholer dehydrert til alkener . ( Eliminering )
Eliminering av selenoksid
Den selen-eliminering er en mild variant av eliminering.
Forestring
Alkoholer reagerer med karboksylsyrer og danner estere og frigjør vann . Denne reaksjonen er også kjent som forestring . Denne reaksjonen katalyseres av syrer.
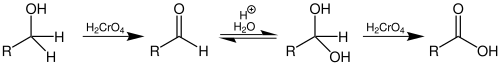
oksidasjon
Primære alkoholer kan oksideres til aldehyder og karboksylsyrer , sekundære alkoholer til ketoner . Tertiære alkoholer kan ikke oksyderes ytterligere med mindre karbonstrukturen blir ødelagt.
| Oksidasjon av alkoholer | ||||
| alkohol | hoved | sekundær | tertiær | |
| Oksidasjonsprodukt I | aldehyd | Keton | ingen reaksjon | |
| Oksidasjonsprodukt II | Karboksylsyre | ingen reaksjon | - | |
| Eksempel: Oksidasjonsprodukter av de strukturelt isomere butanolene | ||||
| Butanol | ||||
| Etternavn | Butan-1-ol | Butan-2-ol | 2-metylpropan-2-ol | |
| Oksidasjonsprodukt I | ingen reaksjon | |||
| Etternavn | Butanal (butyraldehyd) | Butanon (metyletylketon) | - | |
| Oksidasjonsprodukt II | ingen reaksjon | - | ||
| Etternavn | Butansyre (smørsyre) | - | - | |
| De funksjonelle gruppene er merket med blått . | ||||
For oksydasjon av primære alkoholer til karboksylsyre, kan krom (VI) -holdige oksidasjonsmidler brukes, slik som de brukes, for. B. funnet i Jones oksidasjonsapplikasjon . Vandig ruteniumtetroksid er tilgjengelig som et kromfritt, mindre giftig reagens .
Oksidasjonen av en primær alkohol kan også bare skje opp til nivået av aldehydet ved bruk av visse krom (VI) forbindelser som Collins-reagenset . Det er avgjørende at det brukes vannfrie løsemidler . Dersom vann ikke er tilstede, hydrering til geminal diol av aldehydet ( aldehyd-hydrater ) kan ikke finne sted.
Siden oppløselige kromater er svært giftige og har kreftfremkallende og mutagene egenskaper, er det utviklet alternative metoder for oksidering av alkoholer. En metode som ofte brukes er Swern-oksidasjon med aktivert dimetylsulfoksid . Nesten alle metoder er også egnet for oksidasjon av sekundære alkoholer til ketoner. Følgende liste gir en oversikt over de viktigste metodene.
Oksidasjon til karboksylsyre / til keton:
- Jones oksidasjon ( krom (VI) oksid i svovelsyre i nærvær av aceton )
- Kaliumdikromat i svovelsyre
- Ruthenium tetroxide
Oksidasjon til aldehyd / keton:
- Collinsreagens (CrO 3 py 2 i diklormetan )
- Corey-reagens (pyridiniumklorokromat (PCC))
- Cornforth-reagens (pyridiniumdikromat (PDC))
- Anelli oksidasjon (kat. TEMPO , stoich. NaOCl )
- Dess-Martin-oksidasjon ( Dess-Martin-Periodinan )
- Ley oksidasjon ( kat. TPAP , stoich. NMO )
- Pfitzner-Moffatt oksidasjon (DMSO, DCC )
- Sverne oksidasjon ( DMSO , oksalylklorid , NEt 3 )
Acetaldannelse
Alkoholer reagerer med aldehyder i nærvær av sure katalysatorer for å danne hemiacetaler eller acetaler .
bruk
Mange alkoholer er viktige løsningsmidler som brukes både i industrien og i hjemmet; det viktigste når det gjelder mengde er metanol , etanol , 2-propanol og n- butanol . I 2011 var rundt 6,4 millioner tonn av disse alkoholholdige løsemidlene etterspurt over hele verden.
bevis
Alcotest
Omdannelsen av alkoholer med dikromater i en svovelsyreoppløsning er egnet for kvantitativ påvisning av alkoholer og ble tidligere brukt i Alcotest- rørene:
Deteksjonsprinsippet er basert på fargeendring fra guloransje (sur dikromatoppløsning) til grønn (krom (III) ioner) og kan måles spektrofotometrisk.
Certest
En annen mulighet er reaksjonen med ammoniumcerium (IV) nitrat . Her blandes en konsentrert løsning av ammoniumcerium (IV) nitrat med en fortynnet løsning av det ukjente stoffet. Hvis det ukjente stoffet inneholder alkoholgrupper, blir blandingen rød (noen ganger også grønn). Hvis stoffet inneholder fenoler , skilles et brunt bunnfall ut. Årsaken til denne farreaksjonen er en kompleks formasjon , nærmere bestemt en ligandsubstitusjon der en alkohol / fenol koordinerer med oksygenatomet på cerium (IV). Ved å skifte ligandsfære, endres fargen på cerium (IV) fra lysegul til rød / grønn / brun. Lett oksiderbare alkoholer / fenoler kan resultere i en negativ påvisning av cerium (IV) til cerium (III) reduksjon .
Lucas prøve
Graden av substitusjon av en alkohol, dvs. om den er en primær, sekundær eller tertiær alkohol, bekreftes ved nukleofil substitusjon av OH-gruppen med klorid ved hjelp av Lucas-prøven . Substitusjonen har den konsekvens at det resulterende stoffet ikke lenger oppløses i vann og dermed danner sin egen fase . Hastigheten til denne fasedannelsen er avgjørende:
- Tertiære alkoholer reagerer umiddelbart ved romtemperatur.
- Sekundære alkoholer reagerer etter omtrent fem minutter.
- Primære alkoholer reagerer bare ved oppvarming.
Forutsetningen for denne testen er at den opprinnelige alkoholen oppløses i vann. Det må heller ikke være noen annen gruppe som kan erstattes under reaksjonsbetingelsene.
Spektroskopi og derivatisering
Den utvetydige identifikasjonen av en ukjent alkohol utføres enten ved spektroskopi eller ved syntese av et karakteristisk derivat som har et smeltepunkt som lett kan skilles fra smeltepunktene til de samme derivatene av lignende alkoholer. De blir ofte identifisert via estere av 4-nitrobenzoesyre eller 3,5-dinitrobenzoesyre . For dette formål reagerer stoffet som skal analyseres i nærvær av små mengder svovelsyre. Smeltepunktene til disse derivatene er vanligvis skarpe.
 |

|
| Påvisning av propan-2-ol (isopropanol) som et derivat av 4-nitrobenzoesyre: 4-nitrobenzoesyre-2-propylester (smeltepunkt: 100,5 ° C) |
Påvisning av propan-2-ol (isopropanol) som et derivat av 3,5-dinitrobenzoesyre: 3,5-dinitrobenzoesyre-2-propylester (smeltepunkt: 123 ° C) |
Derivatene av 3,5-dinitrobenzoesyre har generelt høyere smeltepunkter enn de for 4-nitrobenzoesyre . De foretrekkes når smeltepunktet for 4-nitrobenzoesyre er for lavt og en nøyaktig bestemmelse ikke lenger er mulig.
Liste over viktige alkoholer med smelte- og kokepunkter
| Homolog serie av envanns, primære, lineære, uforgrenede alkoholer | ||||||
|---|---|---|---|---|---|---|
| C-atomer |
Molar masse g mol −1 |
Systematisk navn | Vanlig navn |
Smeltepunkt ° C |
Koketemperatur ° C |
Løselighet g · l −1 |
| 1 | 32,0 | Metanol | Tresprit, metylalkohol | −97.8 | 64,7 | ∞ |
| 2 | 46.1 | Etanol | Alkohol, etylalkohol, alkohol | −114.1 | 78.3 | ∞ |
| 3 | 60.1 | Propan-1-ol | n- propylalkohol | −126.2 | 97.2 | ∞ |
| 4. plass | 74.1 | Butan-1-ol | n- butylalkohol | −89.3 | 117.3 | 79 |
| 5 | 88.2 | Pentan-1-ol | n -amylalkohol | −78.2 | 138 | 23 |
| Sjette | 102.2 | Hexan-1-ol | n- heksylalkohol | −48.6 | 157,5 | Sjette |
| 7. | 116.2 | Heptan-1-ol | −34.0 | 176 | 2 | |
| 8. plass | 130,2 | Octan-1-ol | −14.9 | 194.5 | 0,5 | |
| 9 | 144.3 | Nonan-1-ol | −6 | 214 | 0 | |
| 10 | 158.3 | Decan-1-ol | 7. | 230 | 0 | |
| 11 | 172.3 | Undecan-1-ol | 15.9 | 243 | 0 | |
| 12. | 186.3 | Dodecan-1-ol | Lauryl alkohol | 24 | 259 | 0 |
| 1. 3 | 200.4 | Tridecan-1-ol | 31.7 | 274 | 0 | |
| 14. plass | 214.4 | Tetradecan-1-ol | Myristylalkohol | 39-40 | 289 | 0 |
| 15. | 228.4 | Pentadecan-1-ol | 44 | 270 | 0 | |
| 16 | 242.4 | Hexadecan-1-ol | Cetylalkohol | 50 | 344 | 0 |
| ... | ||||||
| 18. | 270,5 | Octadecan-1-ol | Stearylalkohol | 56-59 | 336 | 0 |
| ... | ||||||
| 26. plass | 382,7 | Hexacosan-1-ol | Cerylalkohol | 79-81 | 240 (13 Pa) | 0 |
| ... | ||||||
| 30. | 438,8 | Triacontan-1-ol | Myricylalkohol | 88 | 0 | |
| Envanns alkoholer: sekundære og tertiære, hovedsakelig med forgrenede kjeder | ||||||
| C-atomer | Molar masse g mol −1 |
Systematisk navn | Vanlig navn | Smeltepunkt ° C |
Koketemperatur ° C |
Løselighet g · l −1 |
| 3 | 60.1 | Propan-2-ol | Isopropylalkohol, isopropanol | −88.5 | 82.3 | ∞ |
| 4. plass | 74.1 | Butan-2-ol | Sekundær butylalkohol | −114,7 | 99,5 | 125 |
| 4. plass | 74.1 | 2-metylpropan-1-ol | Isobutylalkohol | −108 | 108 | 100 |
| 4. plass | 74.1 | 2-metylpropan-2-ol | Tertiær butylalkohol, trimetylkarbinol | 25.5 | 82.3 | ∞ |
| 5 | 88.2 | Pentan-2-ol | sek - n- amylalkohol | −50 | 118,9 | 166 |
| 5 | 88.2 | Pentan-3-ol | Diethylkarbinol | −8 | 116.1 | 55 (30 ° C) |
| 5 | 88.2 | 2-metylbutan-1-ol | −70 | 129 | 36 | |
| 5 | 88.2 | 3-metylbutan-1-ol | Isoamylalkohol | −117 | 130,8 | 20. |
| 5 | 88.2 | 2-metylbutan-2-ol | −8.4 | 102 | ||
| 5 | 88.2 | 3-metylbutan-2-ol | 112.9 | |||
| 5 | 83.2 | 2,2-dimetylpropan-1-ol | neo- pentylalkohol, tertiær amylalkohol | −12 | 102 | 125 |
| Flerverdige alkoholer | ||||||
| C-atomer | Molar masse g mol −1 |
Systematisk navn | Vanlig navn | Smeltepunkt ° C |
Koketemperatur ° C |
Løselighet g · l −1 |
| 2 | 62.1 | Etan-1,2-diol | Etylenglykol, 1,2-glykol | −15.6 | 197.2 | ∞ |
| 3 | 76 | Propan-1,2-diol | Propylenglykol | −68 | 188 | ∞ |
| 3 | 76 | Propan-1,3-diol | Trimetylenglykol | −32 | 215 | ∞ |
| 4. plass | 90 | Butan-1,2-diol | 1,2-butylenglykol | −114 | 192 | ∞ |
| 4. plass | 90 | Butan-1,3-diol | 1,3-butylenglykol | <−50 | 207,5 | ∞ |
| 4. plass | 90 | Butan-1,4-diol | Tetrametylenglykol | 16 | 230 | ∞ |
| 4. plass | 90 | Butan-2,3-diol | 2,3-butylenglykol | 34 ( meso ) | 183 ( meso ) | ∞ |
| 5 | 104 | Pentan-1,5-diol | Pentametylenglykol | −16 | 241 | ∞ |
| Sjette | 118 | Heksan-1,6-diol | Heksametylenglykol | 39-42 | 253-260 | 5000 |
| 8. plass | 146 | Oktan-1,8-diol | Oktametylenglykol | 58-61 | 171–173 (27 hPa) | |
| 9 | 160 | Nonan-1,9-diol | Nonametylenglykol | 45-46 | 288 | 9 |
| 10 | 174 | Dekan-1,10-diol | Dekametylenglykol | 72 | 297 | 0,7 |
| 3 | 104 | Propan-1,2,3-triol | Glyserin , glyserol | 18. | 290 | ∞ |
| Andre alkoholer | ||||||
| C-atomer | Molar masse g mol −1 |
Systematisk navn | Vanlig navn | Smeltepunkt ° C |
Koketemperatur ° C |
Løselighet g · l −1 |
| 5 | 86,13 | Syklopentanol | −19 | 141 | 1. 3 | |
| Sjette | 100,2 | Sykloheksanol | 25.2 | 161,5 | 36 | |
| 3 = | 58 | Prop-2-en-1-ol | Allylalkohol | −129 | 97 | ∞ |
| 4 = | 71 | But-2-en-1-ol | Crotylalkohol | −30 | 118 | 166 |
| 4. plass | 70.09 | 3-butyn-1-ol | −63 | 128,9 | ||
| Sjette | 98,14 | 2-heksyn-1-ol | 66-67 | |||
| Sjette | 98,14 | 3-heksyn-1-ol | 63-64 | |||
| Sjette | 98,14 | 3-heksyn-2-ol | 79-80 | |||
| Sjette | 98,14 | 5-heksyn-1-ol | 73-75 | |||
| Sjette | 98,14 | 5-heksyn-3-ol | ||||
| 7. | 108,14 | Fenylmetanol, (hydroksymetyl) benzen | Benzylalkohol | −15 | 205.4 | 39 |
| 7. | 114,19 | Sykloheksylmetanol | 19. | 187-188 | ||
| 8. plass | 126,20 | 3-oktyn-1-ol | 880 | |||
| 8. plass | 126,20 | 7-oktyn-1-ol | 70 | |||
| 8. plass | 122,14 | 1-fenyletan-1-ol , (1-hydroksyetyl) benzen (C 6 H 5 CH (OH) CH 3 ) | α-fenyletylalkohol | 21 | 205 | 0 |
| 8. plass | 122,14 | 2-fenyletan-1-ol , (2-hydroksyetyl) benzen (C 6 H 5 CH 2- CH 2- OH) | β-fenyletylalkohol | −27 | 221 | 16 |
| 10 | 158,29 | 3-dekanol | 213 | |||
| 10 | 158,29 | 4-dekanol | −11 | 210-211 | ||
| 11 | 164,25 | 4-tert-butylbenzylalkohol | 139-140 | |||
| 1. 3 | 184,23 | Difenylmetanolforbindelse (C 6 H 5 ) 2- CHOH | Difenyltricarbinol, benzhydrol | 69 | 298 | 0 |
| 19. | 260,33 | Trifenylmetanol (C 6 H 5 ) 3 COH | Trifenylkarbinol | 162,5 | > 360 | 0 |
| Til sammenligning fenol og alkoholer med lignende molare masser | ||||||
| C-atomer | Molar masse g mol −1 |
Systematisk navn | Vanlig navn | Smeltepunkt ° C |
Koketemperatur ° C |
Løselighet g · l −1 |
| Sjette | 94.1 | fenol | Karbolsyre, benzen | 41 | 181.7 | 84 |
| 5 | 88.2 | Pentan-1-ol | n -amylalkohol | −78.2 | 128,0 | 23 |
| Sjette | 102.2 | Hexan-1-ol | n- heksylalkohol | −48.6 | 157.1 | Sjette |
| 5 | 86,13 | Syklopentanol | −19 | 141 | 1. 3 | |
| Sjette | 100,2 | Sykloheksanol | 25.2 | 161,5 | 36 | |
Kommentar:
- = Dobbeltbindinger
- * ved kokepunkt: stoffet brytes ned før det når kokepunktet. Verdier i parentes indikerer kokepunktet ved 20 hPa trykk.
- ∞ med løselighet: uendelig blandbar med vann.
Det kan være avvik i litteraturen for individuelle verdier.
Se også
Individuelle bevis
- ↑ Inntasting av alkohol . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.A00204 Versjon: 2.3.1.
- ^ Clayden, Greeves Warren, Wothers: Organic Chemistry . Oxford University Press Inc, New York 2001, ISBN 978-0-19-850346-0 , pp. 35-36 .
- Try Oppføring av fenoler . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.P04539 Versjon: 2.3.1.
- ^ Brockhaus ABC Chemie , VEB FA Brockhaus Verlag, Leipzig 1965, s.44.
- ↑ Inntasting av alkohol. I: Römpp Online . Georg Thieme Verlag, åpnet 23. mai 2014.
- ^ A b Thomas Nordegren: AZ Encyclopedia of Alcohol and Drug Abuse . Universal-Publishers, 2002, ISBN 978-1-58112-404-0 , pp. 38 ( begrenset forhåndsvisning i Google Book-søk).
- ^ Church of England temperance society: The Church of England temperance chronicle [afterw.] The Temperance chronicle . 1884, s. 69 ( begrenset forhåndsvisning i Google Book-søk).
- ^ A b William Johnson: Lexicon Chymicum Cum obscuriorum verborum et rerum hermeticarum ... 1652 ( begrenset forhåndsvisning i Google- boksøk ).
- ^ Henry Enfield Roscoe, Carl Schorlemmer: En avhandling om kjemi: Kjemien til hydrokarboner og deres derivater, eller organisk kjemi . Appleton, 1884, s. 285 ( begrenset forhåndsvisning i Google Book-søk).
- ^ Seth C. Rasmussen: The Quest for Aqua Vitae The History and Chemistry of Alcohol from Antiquity to Middelalderen . Springer Science & Business, 2014, ISBN 978-3-319-06302-7 , pp. 8 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ Online Etymology Dictionary: alkohol | Search Online Etymology Dictionary , åpnet 9. januar 2021
- ↑ Science Vision, Vol. 3, nr. 25, mars 2000 ( begrenset forhåndsvisning i Google-boksøk).
- Try Inntasting av fettalkoholer. I: Römpp Online . Georg Thieme Verlag, åpnet 10. januar 2013.
- ↑ Inntasting av voksalkoholer. I: Römpp Online . Georg Thieme Verlag, åpnet 8. september 2014.
- ^ Wissenschaft-Online-Lexika: Innføring av alkanoler / alkoholer i Lexikon der Chemie , åpnet 1. juli 2008.
- ↑ Paula Yurkanis Bruice: Organic Chemistry , Pearson Education Inc., 2007, 5. utgave, s 829, ISBN 978-3-8273-7190-4 .
- ↑ Paula Yurkanis Bruice: Organic Chemistry , Pearson Education Inc., 2007, 5. utgave, s. 830-831, ISBN 978-3-8273-7190-4
- ↑ Ceresana: Market study solvents, 2. utgave (UC-3505), april 2012.
- ↑ Paula Yurkanis Bruice: Organic Chemistry , Pearson Education Inc., 2007, 5. utgave, p 412, ISBN 978-3-8273-7190-4 .
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification , Third Edition, 1984, ISBN 0-8493-0303-6 .
- ↑ a b c d e f g h i j Siegfried Hauptmann : Organische Chemie , 2. utgave, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8 , s. 312.
- ^ Hans Beyer og Wolfgang Walter : Organische Chemie , S. Hirzel Verlag, Stuttgart, 22. utgave, 1991, s. 120, ISBN 3-7776-0485-2 .
- ^ A b Hans Beyer og Wolfgang Walter : Organische Chemie , S. Hirzel Verlag, Stuttgart, 22. utgave, 1991, s. 124, ISBN 3-7776-0485-2 .
- ^ A b Hans Rudolf Christensen: Fundamentals of Organic Chemistry , Verlag Sauerländer Aarau, 1. utgave, 1970, s. 166.
- ↑ a b Oppføring for CAS-nr. 143-08-8 i stoffdatabasen til GESTIS til IFA , åpnet 26. desember 2019. (JavaScript kreves)
- ↑ a b Oppføring for CAS-nr. 112-30-1 i GESTIS stoffdatabase til IFA , åpnet 26. desember 2019. (JavaScript kreves)
- ↑ a b David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-517.
- ↑ a b David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-496.
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-507, ISBN 0-8493-0740-6 .
- ↑ a b Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-301, ISBN 0-8493-0740-6 .
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-496, ISBN 0-8493-0740-6 .
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-355, ISBN 0-8493-0740-6 .
- ^ A b c Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, s. C-169, ISBN 0-8493-0740-6 .
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-446, ISBN 0-8493-0740-6 .
- ↑ a b Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-447, ISBN 0-8493-0740-6 .
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-396, ISBN 0-8493-0740-6 .
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , 1. studentutgave, 1988, CRC Press Baton Rouge, Florida, S. C-397, ISBN 0-8493-0740-6 .
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics , første Student Edition, 1988, CRC Press Baton Rouge, Florida, S. C-168, ISBN 0-8493-0740-6 .
- ↑ Oppføring av cyklopentanol i ChemIDplus- databasen til United States National Library of Medicine (NLM), åpnet 25. mars 2021.
weblenker
- Skoleeksperimenter om alkohol
- Læring sirkel alkoholer. (Ikke lenger tilgjengelig online.) I: ZUM-Wiki. Hovedkvarter for undervisning i media på Internett e. V. [TIL Internett e. V.], 28. desember 2009, arkivert fra originalen 28. desember 2009 ; Hentet 7. februar 2010 .