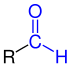
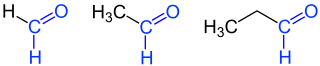
Aldehyder
Aldehyder (fra ny-latinsk al coholus dehyd rogenatus, "dehydrert alkohol " eller "alkohol som hydrogen er fjernet fra") er kjemiske forbindelser med den funksjonelle gruppen –CHO, også kjent som aldehydgruppen eller formylgruppen. I motsetning til ketonene har karbonylgruppen ( > C = O) av aldehydene et hydrogen- og en karbonsubstituent. Det enkleste aldehydmetanalet ( formaldehyd ), som har to hydrogensubstituenter , er et unntak . Aldehyder med en alkylradikal ( dvs. alkanderivater ) kalles alkanaler ; deres homologe serie er nomenklaturlig avledet fra den homologe serien av alkaner. Det er også flere aldehyder - som glyoksal , det enkleste dialdehydet.
nomenklatur
I henhold til IUPAC- nomenklaturen får aldehyder navnet på alkanet med samme antall karbonatomer med suffikset -al eller -carbaldehyd. Følgelig, den aldehyd avledet fra metan kalles metanal , det etanal avledet fra etan . Hvis en annen funksjonell gruppe har høyere prioritet, brukes prefikset “Formyl-”. Hvis forbindelsen derimot er et naturlig stoff eller en karboksylsyre, velges prefikset “Oxo-”.
Det vanlige navnet er avledet fra det latinske navnet på karboksylsyren som opprettes når et oksygenatom tilsettes . For metanal (H - CHO) dette er metansyre (latinsk acidum skjema icum, H - COOH), og dermed danner aldehyd, for etanal er det etansyre (latinsk acidum acetat icum, CH 3 COOH), derav acetaldehyd . De andre trivielle navnene er avledet tilsvarende. Dikarboksylsyrer der en karboksylsyregruppe har blitt redusert til en aldehydgruppe kalles noen ganger semialdehyder .
Homolog serie av alkanalene
| Antall (karbonatomer) |
IUPAC- navn |
Vanlige navn | Molekylær formel | Strukturell formel |
Kokepunkt i ° C |
|---|---|---|---|---|---|
| 1 | Methanal | formaldehyd | CH 2 O | −19.1 | |
| 2 | Ethanal | acetaldehyd | C 2 H 4 O | 20.1 | |
| 3 | Propanal | propionaldehyd propylaldehyd |
C 3 H 6 O | 48 | |
| 4. plass | Butanal | n- butyraldehyd | C 4 H 8 O | 74.8 | |
| 5 | Pentanal | Valeraldehyd amylaldehyd n- pentaldehyd |
C 5 H 10 O | 103 | |
| Sjette | Hexanal | Kapronaldehyd n- heksaldehyd |
C 6 H 12 O | 131 | |
| 7. | Heptanal | Enanthaldehyd heptyl n- Heptaldehyd |
C 7 H 14 O | 152,8 | |
| 8. plass | Octanal | Caprylaldehyd n- oktylaldehyd |
C 8 H 16 O | 171 | |
| 9 | Nonanal | Pelargonaldehyd n- nonylaldehyd |
C 9 H 18 O | 191 | |
| 10 | Decanal | Capric aldehyd n- desylaldehyd |
C 10 H 20 O | 208,5 | |
| 12. plass | Dodekanal | laurinaldehyd dodecyl |
C 12 H 24 O | 238 | |
| 14. | Tetradekanal | Myristylaldehyd tetradecylaldehyd |
C 14 H 28 O | 260 |
Den generelle formel for de alkanaler er C n H 2 n O ( n = 0, 1, 2, 3, 4, ...).
Det er også mange andre grupper av aldehyder som historiske navn mest brukes for:
- Akrolein er avledet fra propen - et alken .
- Benzaldehyd er avledet fra benzen , så det er et arylaldehyd.
- Furfural (furfural, furan-2-karbaldehyd) er avledet av furan og er derfor et heteroarylaldehyd.
eiendommer
Dipol- dipolkrefter oppstår mellom aldehydgruppene av alkanaler , siden C = O dobbeltbinding er veldig polær. Hydrogenbindinger dannes ikke fordi det ikke er noe oksygenbundet hydrogenatom. Derfor er kokepunktene til aldehyder mellom alkoholene og alkanene. Aldehyder kan danne hydrogenbindinger med vann fordi oksygenatomet har to frie elektronpar og er negativt polarisert. Dette er grunnen til at kortkjedede aldehyder er lett løselige i vann. Når det gjelder lengrekjede aldehyder, dominerer effekten av de ikke-polære alkylradikalene, noe som gjør forbindelsene uoppløselige i vann. Mange aldehyder har en karakteristisk lukt.
Hendelse
Aldehyder brukes mye som smakstilsetninger i matvarer som vin . Ofte oppstår disse i frukt og grønnsaker fra stoffer som inneholder oljesyre , linolsyre eller linolensyre under høsting, hakking eller tilberedning. Hexanal finnes f.eks. B. i epler, pærer, fersken og kirsebær. ( E ) -2 -Hexenal finnes i epler, fersken, kirsebær og plommer, det isomere ( Z ) -2-Hexenal finnes i epler, pærer, appelsiner og jordbær. ( Z ) -3-Nonenal forekommer i agurker i tillegg til ( E , E ) -2,4-Nonadienal, ( E , Z ) -2,6-Nonadienal og ( Z , Z ) -3,6-Nonadienal som en luktgivende smak.
Over en viss konsentrasjon blir slike karbonylforbindelser imidlertid ofte vurdert som harsk, fiskeaktig, metallisk eller som papplignende aromaer og forårsaker generelt en gammel smak.
Produksjon
Den milde oksidasjonen av primære alkoholer i et ikke-vandig medium produserer aldehyder. De kan ytterligere oksideres til karboksylsyrer .
- Etanol reagerer med kobberoksid i en redoksreaksjon for å danne acetaldehyd , kobber og vann .
Den teknisk viktigste prosessen for produksjon av aldehyder er oksosyntese , også kjent som hydroformylering . Et alken reageres med en blanding av karbonmonoksid og hydrogen i nærvær av en egnet katalysator:

|
| Hydroformyleringen av et alken produserer en blanding av n -aldehyd (midt) og i -aldehyd (til høyre). |
bruk
Formaldehyd (metanal) produseres i store mengder (21 millioner tonn over hele verden per år), mer enn noe annet aldehyd. Det brukes som et desinfeksjonsmiddel, som et konserveringsmiddel for lett bedervelige varer som kosmetikk (formalinløsning) og som råvare i kjemisk industri. De største mengdene ble bearbeidet til aminoplaster og fenoplaster i plastindustrien frem til 1990 . I medisin brukes metanal i en 4-8% oppløsning (formalin) som fiksativ i histoteknologi .
Aldehyder og ketoner brukes også til å lage plast , løsemidler , fargestoffer , tanniner , parfymer og medisiner. Med utgangspunkt i akrolein produseres DL metionin, et tilsetningsstoff i fôr , i mengder på mer enn 100.000 tonn per år.
I medisin brukes formaldehyd og glutaraldehyd som desinfeksjonsmiddel for overflater og instrumenter. Begge aldehyder er effektive mot mange forskjellige mikroorganismer . Spesielt kan ikke-innhyllede virus og sporedannende bakterier (f.eks. Miltbrann ), som bare er tilgjengelige for noen få desinfeksjonsmidler, nås på denne måten. Siden aldehyder har en irriterende effekt på hud og slimhinner og noen ganger forårsaker allergier, må disse midlene brukes forsiktig.
I parfymeriet brukes aldehyder siden 1921 ( Chanel nr. 5 ).
Fysiologisk betydning
Et antall aldehyder finnes i metabolismen av celler. En spesiell rolle spilles av acetaldehyd (ethanal), som produseres i løpet av nedbrytningen av etanol og er involvert i utviklingen av den såkalte alkoholbakrusen .
bevis
Aldehyde spektroskopi
I IR-spektrene av aldehyder og ketoner finner man det intense karakteristiske båndet til C = O-strekkvibrasjon i området 1690–1750 cm −1 .
I 13 C-NMR-spektra, er signalet til karbonylkarbonatomet av aldehyder og ketoner som finnes i et område på 195 og 210 ppm. Den tilsvarende proton av aldehyd-gruppen kan finnes i 1 'H-NMR-spektrene som et skarpt signal på rundt 10 ppm. Denne egenskapen gjør identifisering ved hjelp av NMR-spektroskopi spesielt enkel, siden bare noen få protoner har en resonans i dette høye området.
Reaksjoner
Aldehyder er reaktive forbindelser og kan lett oksideres til karboksylsyrer .
- C = O-bindingen til karbonylgruppen er sterkt polær med den delvis positive ladningen (δ +) på karbonatomet, som kan angripes av nukleofiler .
- Aldehyder med et hydrogenatom bundet til α-karbonatomet rett ved siden av karbonylgruppen kan være i keto- eller enolform - se keto-enol-tautomeri .
- Når det gjelder aldehyder, observeres det at hydrogenatomer på karbonatomet ved siden av karbonylgruppen er betydelig surere enn hydrogenatomer på "normale" karbonatomer. På den ene siden skyldes dette at karbonylkarbonet har svært lite elektron og har en −I-effekt på nabobindinger. På den annen side kan den negative ladningen delokaliseres på karbonylens oksygen etter deprotonering. gruppe ( −M effekt ).
Nukleofil tilsetning
Etter at nukleofilen har angrepet, går π- elektronparet helt til oksygenet , som nå er negativt ladet . I det protiske løsningsmidlet kompenseres dette for ved opptak av protoner, som skaper en OH-gruppe i stedet for karbonylgruppen.
Tilsetning av vann
Vann + aldehyd ⇒ aldehydhydrat ( geminal diol )
I vandig løsning er aldehyder i likevekt med tilsvarende gemdiol , dvs. et hydrokarbon med to hydroksylgrupper på ett karbonatom. Vanligvis er likevekten på siden av aldehydet. Når det gjelder trikloracetaldehyd, er likevekten imidlertid på siden av geminaldiolen.
Tilsetning av alkoholer
Alkohol + aldehyd ⇒ hemiacetal
Hemiacetal + alkohol ⇒ acetal + vann
Eksempel: ringlukking av druesukker (glukose)
Se også: acetaldannelse
Tilsetning av nitrogennukleofiler
Prim Amine + aldehyd ⇒ imine (Schiff base) + vann
Sek. Amin + aldehyd ⇒ enamin + vann
Oksidasjon til karboksylsyre (viktig for bevis)
Aldol-reaksjon
CH-surt H- atom i a- stilling kan deles av ved baser . Det resulterende enolatanionet tilfører karbonylkarbonet i et annet aldehydmolekyl. Resultatet er en aldol , et tilleggsprodukt av alkohol (OH-gruppe) og aldehyd. På denne måten kan CC-obligasjoner lages. Hvis aldolen som dannes blir dehydrert, kalles den aldolkondensasjon , noe som resulterer i α, β-umettede aldehyder.
Blandet aldolreaksjon
Blandede aldolreaksjoner kan vanligvis ikke utføres i en reaksjon med én pott, siden fire mulige produkter kan og dannes. Et unntak er når en av de to aldehydene ikke kan enoliseres, dvs. ikke har et CH-surt hydrogenatom. I dette tilfellet er bare en blandet aldol mulig. Et eksempel på ikke-enoliserbare aldehyder er aromatiske aldehyder (se: Benzaldehyd ). På denne måten oppnås cinnamaldehyd , en viktig duft , i en Knoevenagel-kondens .
Pinacol kobling
Substituering av aldehyder med et alkalimetall (for eksempel natrium ) på en måte danner et radikal - anion , den dimerisert raskt. Hydrolysen produserer en pinacol (tradisjonelt navn for en 1,2- diol , dvs. en diol med vicinale hydroksylgrupper ). Med utgangspunkt i et a, ω-dialdehyd oppnås sykliske 1,2-dioler analogt ved en intramolekylær reaksjon.
Individuelle bevis
- ↑ Duden, German Universal Dictionary, 4. utgave, Mannheim, 2001.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-1 - 3-523.
- ^ Siegfried Hauptmann : Organisk kjemi. 2. gjennomgått utgave, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, s. 565, ISBN 3-342-00280-8 .
- ↑ a b Wolfgang Legrum: Dufter, mellom stank og duft. Vieweg + Teubner Verlag (2011) s. 82-85, ISBN 978-3-8348-1245-2 .
- ↑ Werner Köhler, Rainer Ansorg: Medisinsk mikrobiologi. Elsevier, Urban & Fischer Verlag, 2001, ISBN 3-437-41640-5 , s. 92.
- ↑ KPC Vollhardt, NE Schore: Organisk kjemi . Red.: H. Butenschön. 4. utgave. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, ISBN 3-527-31380-X , s. 862-863 .