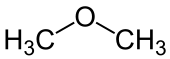
Ether
| Ether |
|---|

|
| R 1 og R 2 er organyl-grupper . Eterens oksygenatom er markert i blått . |
I kjemi, etere (også kalt etere ) er organiske forbindelser som har en etergruppe som en funksjonell gruppe - et oksygenatom som er substituert med to organyl-radikaler (R 1 -O - R 2 ). På språket refererer eter ofte også til dietyleter (H 5 C 2 –O - C 2 H 5 ), en av de viktigste og enkleste etrene. Hvis begge radikalene på oksygenbroen er alifatiske , blir disse etrene også referert til som alkoksyalkaner ifølge IUPAC .
Naturlig forekomst
Ethers er forbindelser som er utbredt i naturen. Den glykosidbinding av de polysakkarider som er et oksygen- bro mellom to karbonatomer; disse acetalene er faktisk intramolekylære , geminalt arrangerte di-etere. Mange andre naturlige stoffer , som B. de aromatiske stoffene anetol , 1,8-cineol , eugenol og vanillin , samt gruppene ubiquinoner og strobiluriner og mange medisinske stoffer er etere.
struktur
Generelt kan en eter brukes som
å være representert. R 1 og R 2 her er alkyl- eller aryl-radikaler som, i tilfelle av en cyklisk eter, er bundet til hverandre. Alkylaryletere er også mulig (se anisol og vanillin ). Bindingsforholdene i etere er lik de i alkoholer og i vann , som kan betraktes som den grunnleggende strukturen til disse to klassene av forbindelser. Karbon- og oksygenatomer er hver hybridisert sp 3 . Dette fører til et tetraedrisk arrangement av atomorbitalene rundt alle involverte atomer. Den bindingen vinkel av oksygenet blir utvidet til 112 ° på grunn av de mer voluminøse alkylsubstituenter i forhold til hydrogen (104,5 ° i H 2 O). Rundt klokken 143 er C - O-bindingene like lange som i alkoholer.
nomenklatur
I henhold til IUPAC- nomenklaturen , er alifatiske etere omtales som alkoksyalkaner: R 1 -O-R 2 , hvor gruppen O-R 2 behandles som en alkoksy-substituent med et alkan kjede R- 1 . Den underordnede substituent av kjettingen er det alkoksyradikal (-O - R 2 ), de høyere rangerte ett danner stammen av stoffet navn. Navn som også er godkjent av IUPAC, dannes ved å navngi de to alkylradikalene og slutteteren og er spesielt vanlige for små, alifatiske etere. Når det gjelder symmetriske etere, er betegnelsen da veldig enkelt mulig ved å sette en Di foran den [f.eks. F.eks.: Dietyleter (etoksyetan) eller dimetyleter (metoksymetan)]. Nesten alle sykliske og aromatiske etere er bare kjent under vanlige navn.
Rettkjedede og forgrenede etere
Navngivningen av alkoksyalkanene foregår tilsvarende. Eksempler:
- Forbindelsen H 3 C - O - CH 3 er sammensatt av en H 3 C - O substituent og metylradikalet (CH 3 ) som spindelen, selv om her begge radikaler er likeverdige. Følgelig kalles forbindelsen metoksymetan eller dimetyleter :
- H 3 C - O - CH (CH 3 ) 2 , kalles 2-metoksypropan eller isopropyl-metyleter. Den høyere rangerte propankjeden danner stammenavnet som en metoksy-substituent er festet til propylradikalets 2- (eller iso ) posisjon:
- FH 2 C-CH 2 -O-CH 2 -CH 3 er referert til som 1-etoksy-2-fluoretan . I prinsippet er begge kjedene av samme rang, men den fluorerte (og dermed mer substituerte) resten danner stammen av navnet:
Sykliske etere
Sykliske etere anses å være cykloalkaner der ett (eller flere) karbonatomer er erstattet av (et) oksygenatom (er). For å gjøre dette klart blir stavelsen " Oxa " satt inn i riktig posisjon i samsvar med Hantzsch-Widman-systemet . Eksempel:
Forbindelsen ledes nesten utelukkende under navnet tetrahydropyran , IUPAC-navnet er oksacykloheksan. Forbindelsen er syklisk ( cyklo ), har en ringstørrelse på 6 atomer ( heksan ) og i en posisjon er et karbonatom erstattet av et oksygenatom ( oxa ). Navnet 4-fluoroksacykloheksan eller mer vanlig brukes på følgende forbindelse tilsvarende: 4-fluortetrahydropyran [ heteroatom (oksygen, O) i ringen er tildelt posisjon 1].
eiendommer
De fleste etere er relativt inerte og brukes derfor ofte som løsemidler i preparativ organisk kjemi . Siden høyere etere kan danne dårlige hydrogenbindinger på grunn av økende steriske hindringer , reduseres løseligheten i vann raskt med økende størrelse av alkylradikalet .
| Utvalgte data fra noen åpne eter | |||||
|---|---|---|---|---|---|
| Ether | struktur | Smeltepunkt ° C | Bp ° C | Løselighet (i en liter H 2 O) | Dipole øyeblikk |
| Dimetyleter | H 3 C-O-CH 3 | −141,5 | −24.8 | 70 g (20 ° C) | 1.30 D. |
| Dietyleter | H 5 C 2 -O-C 2 H 5 | −116 | 35 | 69 g (20 ° C) | 1,14 D |
| Di- n- propyleter | H 7 C 3 -O-C 3 H 7 | −122 | 90 | 3,8 g (25 ° C) | 1,32 D |
I motsetning til dette er etere lett oppløselige i sterke syrer på grunn av protoneringen som skjer med dannelsen av oksoniumioner .
Ethers fysiske egenskaper skiller seg betydelig fra de tilsvarende alkoholene med en tilsvarende molær masse . Smelte- og kokepunktene for de etere er betydelig lavere enn for de tilsvarende alkoholene, se alkohol morfin ( smeltepunkt 253 ° C) og dets metoksy eter kodein ( smeltepunkt 157 ° C). I likhet med alkoholer, bestemmer den høye elektronegativiteten til oksygen i hovedsak egenskapene til etere. Spesielt når det gjelder sykliske etere, fører dette til dannelsen av et uttalt dipolmoment. I tillegg er det polare oksygenatomet mer eksponert i en syklisk struktur. Dette fremgår av vannløseligheten til noen sykliske etere.
| Utvalgte data fra noen sykliske etere | |||||
|---|---|---|---|---|---|
| Ether | struktur | Smeltepunkt ° C | Bp ° C | Løselighet (i en liter H 2 O) | Dipole øyeblikk |
| Tetrahydrofuran |  |
−108.4 | 66,0 | hvilken som helst mengde | 1,74 D. |
| 1,4-dioksan |  |
11.8 | 101.3 | hvilken som helst mengde | 0,45 D |
Det lave dipolmomentet til 1,4-dioksan er forårsaket av dets symmetriske struktur: de to motsatte oksygenatomer i ringen reduserer molekylets samlede polaritet.
Ether syntese
Williamson etersyntese
Ulike syntetiske ruter er mulige for etere . Sannsynligvis er den mest kjente mekanismen Williamson etersyntese . Her er en alkali - alkoholat med et halogenalkan implementert, karakterisert ved at i tillegg til det tilsvarende alkalimetall- halogen - salt (ikke vist), eter dannet.
Reaksjonen skjer i henhold til en S- N- 2- mekanisme og brukes for å fremstille enkle og blandede etere. Eliminering kan forekomme som en side- reaksjon , og det er derfor anvendelsen av Williamson-etersyntese med tertiære haloalkaner ikke gir mening.
Williamson ettersyntese fører til sykliske etere i en intramolekylær reaksjon. Den enkleste representanten for denne klassen er oksacyklopropan ( etylenoksid , oksiran); den mest kjente representanten er tetrahydrofuran (THF), et populært løsningsmiddel innen organisk kjemi.
Syrekatalysert kondens av alkoholer
Ved syrekatalyse (her svovelsyre ) kan to alkoholmolekyler (vist ved bruk av etanol ) kondenseres til en eter (her dietyleter ) med eliminering av vann :
Hvis bare en type alkohol brukes (her etanol), kan symmetriske etere (R - O - R) representeres på denne måten. Hvis blandinger av z. For eksempel kan to alkoholer (f.eks R 1 -OH og R 2 -OH) kan resultere i tre forskjellige etere under virkningen av svovelsyre eller fosforsyre :
- R 1 –O - R 1 (symmetrisk eter)
- R 2 –O - R 2 (symmetrisk eter)
- R 1 -O - R 2 (asymmetrisk eter)
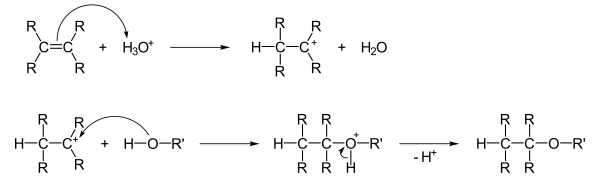
Tilsetning av alkoholer til dobbeltbindinger
Alkoholer kan tilsette dobbeltbindinger , og protonet til en tilsatt syre blir først lagt elektrofilt til dobbeltbindingen. Alkoholen akkumuleres deretter på en nukleofil måte , og etter påfølgende deprotonering dannes eteren:
Spesielle etere
Heteroether
I tillegg til de "normale" etrene, dvs. alkylradikaler med en oksygenbro, er det også analoger med pårørende til oksygen. I den sjette hovedgruppen følges oksygen av svovel . Dette danner såkalte tioetere i samsvar med reglene beskrevet ovenfor. I disse erstattes oksygenbroen med en svovelbro. Blant de mest kjente tioetere inkluderer "sennepsgass" eller svovelsennep og aminosyren metionin .
Kroneter
Kronethere er en spesiell gruppe av sykliske etere, som fortjener omtale på grunn av deres betydning i kjemien til levende ting så vel som i teknisk kjemi. Generelt er de sykliske etere, som består av 1,2-dieters bundet til hverandre. Den vanlige nomenklaturen for kronetere er uvanlig. En av de enkleste kronetherne er [12] krone-4 . Her [12] gir det totale antallet atomer (uten hydrogenatomer) i den sykliske eterunderstrukturen og -4 antall oksygenatomer i denne delen av molekylet. Kronethere har den unike evnen til å binde metallatomer (eller metallioner) i en slags burstruktur og dermed tjene som byggesteiner for transportsystemer for disse metallene.
Polyeter
Langkjedede ledd av arten
kalles polyetere (også polyalkylenglykoler , polyeterpolyoler , polyalkylenoksider ). Eksempler på denne gruppen av polymere etere er polyetylenglykol og polypropylenglykol , som begge produseres ved katalytisk polymerisering av henholdsvis de tilsvarende epoksider ( oksiraner ), etylenoksid og propylenoksyd . I tilfelle av polyetylenglykol og polypropylenglykol, alle rester (R 1 , R 2 , R 3 ...) er identiske med unntak av ende koblinger av kjedene. Et bredt utvalg av polymerer kan produseres når epoksider reageres med dioler . Tilsetningen av en enkel alkanol stopper polymeriseringen.

I tillegg til dioler, er polyvalente alkoholer, som f.eks. B. glyserol , 1,1,1-trimetylolpropan (TMP), pentaerytritol eller sorbitol kan reageres med epoksider i nærvær av sterke baser (f.eks. KOH) for å danne polyeterpolyoler. De monomere polyolene fungerer som en slags startpakke for den basekatalyserte ringåpningspolymerisasjonen av oksiraner. Den syrekatalyserte ringåpningspolymerisasjonen av tetrahydrofuran til polyetherdiol polytetrametylenglykol (PTMEG), også kalt polytetrahydrofuran (PolyTHF), er analog med dette . Polyetertrioler erholdes fra monomere trioler (glyserin, TMP) med epoksider. Polymerisasjonen resulterer i blandinger som avviker i molær massefordeling av de individuelle polyeter-triolmolekylene og i kjedelengdene til etersekvensene. Blokk- kopolymerer kan produseres på en målrettet måte ved sekvensiell polymerisering med forskjellige epoksider, kopolymerer med eksterne etylenoksydenheter som har primære hydroksylgrupper og de med eksterne propylenoksidenheter som har sekundære hydroksylgrupper (med redusert reaktivitet ). For å karakterisere polyeterpolyoler gis hydroksyltallet (OH-nummer) ofte , hvis tallverdi øker med funksjonaliteten til den monomere polyolen og avtar med molmassen til polyeterpolyolen. Vanlige polyeterpolyoler er Lupranol (BASF) og Desmophen (Covestro). Selv epoksyharpikser er polyeter med terminale epoksydgrupper. Polyetherdioler, som f.eks. B. polyetylenglykol, er viktige forløpere i reaksjonen med isocyanater for å danne polyuretaner .
Fareadvarsler og lagring
Auto-oksidasjon
Når etere lagres i lys, danner de peroksider med atmosfærisk oksygen . Disse kan akkumuleres i resten under (vakuum) destillasjon av en eter og føre til eksplosjoner.

I α-posisjonen til oksygenatomet blir et hydrogenatom abstrahert for å danne en radikal, og et peroksyd dannes med oksygen . Metyl- tert-butyl -eter (MTBE) er et unntak , ettersom den ikke har en α hydrogenatom på den tert- butyl-side og dannelsen av et radikal på den side metyl er også ugunstig. Peroksydene kan vanligvis påvises ved brun misfarging av eddiksyre jodid løsninger. Jod er oksidert til jod, som reagerer med jod til I 3 - og er ansvarlig for den brune fargen. Spesielle testpinner er også tilgjengelig i butikkene. Peroksider kan ødelegges, for eksempel med jern (II) salter. Oppbevaring av etere til laboratoriebruk bør derfor bare foregå i små beholdere med unntak av lette metallkanner som er ideelle på grunn av opasiteten. Eter som har vært lagret i lang tid, og spesielt når beholderen bare er delvis fylt, bør det kontrolleres for peroksider før bruk. Sykliske etere som tetrahydrofuran og dioksan er mer utsatt for peroksiddannelse enn acykliske etere.
Diverse
Når du arbeider med lavere etere, bør deres lave kokepunkt og lette antennelighet aldri undervurderes. (Dietyl) eter-luft-blandinger mellom 2 og 36 volum% eter er eksplosive . Det er viktig at eterdampene ikke bare er fargeløse, men også tyngre enn luft. Så de samler seg på dype steder. På grunn av dette og den narkotiske effekten av etere, skal de bare brukes i velfungerende avtrekksskap .
bruk
På grunn av deres ambivalente karakter er de fleste etere utmerkede løsningsmidler og oppløser mange vannuoppløselige forbindelser. Det meste av den produserte dietyleteren brukes som løsemiddel i kjemisk og medisinsk industri og i laboratoriebruk.
Diverse
- Ordet eter er, som engelsk eter, avledet av det greske ordet αἰθἠρ aithḗr , "den øvre luften" (basert på den indo-europeiske aiten , "burn"). ordet via latinsk aether ble adoptert på moderne språk . På Paracelsus betyr dette “det øverste laget av luft” eller “stjernehimmelen”. Adjektivet for dette er eterisk (også eterisk allerede i 1520 ).
- I 1730 overførte Frobenius ordet eter til det bedøvelsesmiddel og løsemiddel han representerte: Dietyleter var et av de første stoffene som ble brukt i moderne bedøvelse som bedøvelsesmiddel . På grunn av de sterke bivirkningene (uttalt spenningsfase, kvalme) og dens brennbarhet, er det imidlertid bare av historisk interesse for anestesi . På tidspunktet for forbudet ble dietyleter noen ganger brukt som etanolerstatning (oralt inntak), og det er fortsatt isolerte tilfeller av eterforbruk kjent i dag. Den fysiologiske effekten ligner på alkoholen. Når dietyleter brytes ned i kroppen, produseres det blant annet etanol.
- I den vitenskapelige terminologien på 1800-tallet ble eter brukt til å betegne den "fine massen utenfor jordens atmosfære".
Individuelle bevis
- ↑ Duden (24. utgave 2006) gir: Äther, spesialist. også eter.
- ↑ Axel Zeeck: Chemie für Mediziner , 6. utgave, Elsevier Urban & FischerVerlag, 2006, ISBN 978-3-437-44435-7 , s. 215.
- ↑ Oppføring på acetaler . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.A00062 .
- ↑ Oppføring for CAS-nr. 115-10-6 i GESTIS stoffdatabase til IFA , tilgjengelig 26. desember 2019. (JavaScript kreves)
- ↑ Oppføring for CAS-nr. 60-29-7 i GESTIS stoffdatabase til IFA , åpnet 26. desember 2019. (JavaScript kreves)
- ↑ Oppføring for CAS-nr. 111-43-3 i GESTIS stoffdatabase til IFA , tilgjengelig 26. desember 2019. (JavaScript kreves)
- El Axel Zeeck: Chemie für Mediziner, 6. utgave, Elsevier Urban & FischerVerlag, 2006, ISBN 978-3-437-44435-7 , s. 219.
- ↑ R. Brückner: Reaction Mechanisms , 3. utgave, Spectrum, Heidelberg / Berlin 2004, ISBN 3-8274-1579-9 , s. 41–43.
- ^ Friedrich Kluge : Etymologisk ordbok for det tyske språket. De Gruyter, Berlin / New York 1975, ISBN 3-11-005709-3 , s. 34 f. ( Ether ).
- ^ Friedrich Kluge: Etymologisk ordbok for det tyske språket. 1975, s. 34.
- ^ Friedrich Kluge: Etymologisk ordbok for det tyske språket. 1975, s. 35.
litteratur
- H. Beyer, W. Walter: Textbook of Organic Chemistry , 21. utgave, S. Hirzel-Verlag, Stuttgart 1988, s. 144-147.
- A. Streitwieser, CH Heathcock, EM Kosower: Organic Chemistry , VCH, Weinheim 1994, s. 232-243.
- Peter GM Wuts, Theodora W. Greene: Greene's Protective Groups in Organic Synthesis , 4. utgave, Wiley & Sons, 2007, s. 24-42.