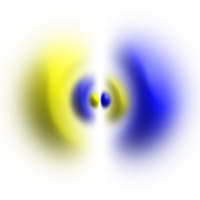
Atomic orbital

Øverste rad: Representasjon av sannsynlighetstettheten til orbitalene som punktskyer. Nederste rad: Representasjon av isosurfaces of . Isosurface er valgt på en slik måte at elektronet er innenfor volumet som er innesluttet av isosurface med en 90% sannsynlighet.
I de kvantemekaniske modellene av atomer er en atombane den romlige bølgefunksjonen til et enkelt elektron i kvantemekanisk tilstand , vanligvis i stasjonær tilstand. Dens symbol er vanligvis (liten phi ) eller (liten psi ). Den mengde firkantet beskriver som tetthetsfunksjonen , den romlige fordeling av sannsynligheten med hvilken elektron ved kan bli funnet ( Born regel av kvantemekanikken). Sammen med angivelse av hvorvidt den spinn er parallelt eller anti-parallelt til en fast akse eller til den orbital vinkelmomentet for elektronet, beskriver en orbital tilstanden av elektron fullstendig.
I de eldre atommodellene i følge Niels Bohr ( Bohrs atommodell , 1913) og Arnold Sommerfeld ( Bohr-Sommerfelds atommodell , 1916), beskriver en bane en eksakt elektronbane valgt av kvantiseringsreglene . Denne ideen ble forlatt i kvantemekanikken til fordel for en diffus fordeling av sannsynligheten for at elektronet blir lokalisert. Kvantemekanisk atombane strekker seg for bundne elektroner fra atomkjernen i sentrum utover til uendelig, der sannsynligheten for å være asymptotisk har en tendens til null. Den mest sannsynlige avstanden fra atomkjernen for den innerste banen er lik radien til Bohrs første sirkulære bane.
En bane representeres vanligvis tydelig av overflaten av minst mulig volum, inne i hvilken elektronen er lokalisert med stor sannsynlighet (f.eks. 90%) (se illustrasjon). Dette resulterer i legemer som omtrent tilsvarer atomenes størrelse og form, ettersom de er merkbare i kjemiske molekyler , kondensert materiale og den kinetiske teorien om gasser.
De mest vanlige atomorbitalene er de som resultat for den ene elektron av hydrogenatomet som løsninger til Schrödingerligningen av den hydrogen problemet og ble første gang publisert i 1926. De har forskjellige former med er referert til, den nedre indeksen fra hovedkvantetallet til det orbitale vinkelmomentkvantumet og det magnetiske kvantetallet er.
I banemodellen for atomer med flere elektroner antar man at elektronene fordeles over orbitalene under hensyntagen til Pauli-prinsippet . En slik tilstand kalles elektronkonfigurasjon og er ofte en nyttig tilnærming for atomskallets struktur , selv om dette blir enda mer komplisert av ytterligere elektronkorrelasjoner.
For å beskrive elektroner i molekyler dannes molekylære orbitaler som en lineær kombinasjon av atomorbitaler. Elektroner i faste stoffer er beskrevet av orbitaler, som har form av Bloch-bølgefunksjoner .
Denne artikkelen ser bare på bundne elektroner i atomer. En forenkling av banemodellen er skallmodellen .
presentasjon
Siden den komplette grafiske representasjonen av en bølgefunksjon krever fire dimensjoner (eller i så fall fem dimensjoner ), er en fullstendig representasjon i tre dimensjoner ikke direkte mulig (men for eksempel ved hjelp av fargekoding som vist i tabellen nedenfor). Som kjent fra hydrogenatomet har egenfunksjonene til den stasjonære Schrödinger-ligningen en radiell del og en vinkeldel :
Disse aksjene kan tegnes separat. Ofte viser imidlertid bilder av orbitaler en representasjon av sannsynlighetstettheten (og dermed indirekte av orbitalene ). Sannsynlighetstettheten kan visualiseres spesielt tydelig som en punktsky : Hvis sannsynlighetstettheten er høy, tegnes mange punkter; hvis sannsynlighetstettheten er liten, trekkes få punkter. Siden sannsynlighetstettheten er ulik null på nesten alle punkter (med unntak av nodepunktene til bølgefunksjonen) i rommet, kan en bane imidlertid ikke være fullstendig representert på denne måten - siden man må fortsette å tegne evighet. I stedet går man over til å tegne isosoverflater med samme sannsynlighetstetthet som implisitt blir utført av
er definert. Ved å skanne forskjellige vinkler lærer man noe om formen på isosurface og dermed noe om "formen til orbitalen". Formen på banen er gitt av en sfærisk overflatefunksjon . Konstanten blir ofte valgt slik at sannsynligheten for å finne elektronet i rommet som er isosurface er 90%.
Det er ikke uvanlig at en isooverflate blir farget i henhold til argumentet fra (som på bildet av p-banen).
En enkel måte å skjematisk representere okkupasjonen av atomorbitaler er Pauling-notasjonen .
klassifisering
Atomiske orbitaler kan settes inn med tre kvantetall og kan deretter ta imot to elektroner med motsatt rotasjon . Alternativt kan atomorbitaler defineres av fire kvantetall og deretter gi plass til bare ett elektron om gangen.
Hovedkvantetall n: skall
Hovedkvantetallet betegner skallet (også kalt K-skall, L-skall, M-skall, ...) som orbitalen tilhører. I Bohr atom modell, den energinivået indikerer, ved å starte med det laveste, i grunntilstanden
Jo større , jo lavere er bindingsenergien til elektronet og dermed større sannsynlighet for å finne elektronet lenger borte fra atomkjernen. Dette gjelder også atomer med flere elektroner. I tilfelle interaksjoner mellom atomer som kommer nær hverandre (som kollisjoner av gassmolekyler, romfylling i kondensert materie, kjemiske bindinger ), spiller elektronene med det største hovedkvantetallet derfor den viktigste rollen (elektronene til valensskall ).
Antallet orbitaler i et skall skyldes. Når man tar hensyn til Pauli-prinsippet , kan skallet fylles med maksimalt elektroner, så lukkes det. De tilsvarende atomer tilhører edelgassene .
Mindre eller orbital vinkelmomentkvantetall l
form
Den mindre eller banevinkelmoment quantum tall innenfor et skall beskriver mengden av den orbital vinkelmomentet for elektronet. Sammen med kvantetallet bestemmes den vinkelavhengige "formen" til bane. Det er det samme for alle viktigste kvantetall (merknad ).
I stedet for sifrene 0, 1, 2 etc. , blir sekundærkvantumet vanligvis betegnet i litteraturen med bokstavene s, p, d, f, g etc., avledet fra de opprinnelige betegnelsene for de tilsvarende spektrallinjene ; denne konkrete betydningen har for lengst blitt ubetydelig:
| -Orbital | -Orbitaler | -Orbital |
|---|---|---|
| Forenklet form av en p-bane . Fargen står for tegnet på bølgefunksjonen. En isosurface av |
Forenklede former for de forskjellige d-orbitalene (hver ). En isosurface av sannsynlighetstettheten er vist for de respektive orbitalene . | Form av en 4p orbital . Fargen står for tegnet på bølgefunksjonen.
|
| Etternavn | tidligere betydning | Mindre kvantetall | form | Nummer |
|---|---|---|---|---|
| s bane | s harpe | sfærisk symmetrisk | 1 | |
| p orbital | p rincipal | dumbbell formet | 3 A2 | |
| d orbital | d iffuse | krysset doble manualer | 5 | |
| f orbital | f undamental | rosetter formet | 7. | |
| g orbital A1 | (alfabetisk fortsettelse) | rosettformet | 9 | |
| h orbital A1 | (alfabetisk fortsettelse) | rosettformet | 11 |
Merknader:
Strengt tatt karakteriserer orbitalene bare de stasjonære elektronbølgene i systemer med bare ett elektron (f.eks. Hydrogenatom H, heliumion He + , litiumion Li 2+ , etc.). Siden formen på orbitalene omtrent beholdes selv i flerelektronsystemer, er kunnskap om dem tilstrekkelig til å svare på mange kvalitative spørsmål om kjemiske bindinger og strukturen til stoffer.
Det skal bemerkes at orbitalene vist i litteraturen noen ganger ikke er egenstatene til det magnetiske kvantetallet til z-komponenten til vinkelmomentoperatøren . For eksempel, av p-orbitalene, er bare en egenstat representert for egenverdien og betegnet som p z . Orbitalene merket p x og p y er ikke de tilsvarende egenstatene for, men er deres superposisjoner . De er egentilstandene av operatørene eller til , som imidlertid ikke pendle. Dette er ikke et problem for konklusjonene så lenge de tilsvarende bølgefunksjonene er ortogonale .
Nedre skall
Jo større , jo større er middelavstanden til elektronet fra atomkjernen til en fast verdi:
- Med bane er sfærisk og har en ikke-ubetydelig sannsynlighet for å være i kjernen.
- Maksimumsverdien tilsvarer Bohrs sirkulære bane, her er sannsynligheten for opphold konsentrert i radien beregnet i Bohrs modell.
Siden de indre elektronene beskytter den attraktive kjerneladningen i atomer med flere elektroner , reduseres bindingsenergien til de ytre elektronene. Siden de gjennomsnittlige kjerneavstandene avhenger av det sekundære kvantetallet, resulterer forskjellige energinivåer i samme skall avhengig av det sekundære kvantetallet. Disse er også referert til som de nedre skall av de viktigste skallet (også faststoff ).
Antall subshells per skall er lik hovedkvantetallet :
- For det er bare 1s skallet.
- For tre underskaller er mulig, som er merket 3s, 3p, 3d.
Det er orbitaler per subshell (hver med et annet magnetisk kvantetall , se neste avsnitt), noe som fører til totalt orbitaler per skall.
Magnetisk kvantetall m l : helning av vinkelmomentvektoren
Det magnetiske kvantetallet
spesifiserer z-komponenten til den orbitale vinkelmomentvektoren i forhold til en (fritt valgt) z-akse. Dette tilsvarer en helningsvinkel
- Hvis banevinkelmomentet er (omtrent) parallelt med aksen,
- ved (omtrent) antiparallell .
Det faktum at nøyaktig forskjellige verdier er mulige for en gitt kalles retningsbestemt kvantisering.
Hvis det ikke er noe eksternt felt, har de individuelle orbitalene i en subshell den samme energien. I motsetning til det, i magnetfeltet, deler energien i det nedre skallet seg i likeverdige verdier ( Zeeman-effekt ), dvs. det vil si at hver enkelt bane tilsvarer et eget energinivå.
Magnetisk spinnkvantantall m s
Når det gjelder lettere atomer, trenger man bare å ta hensyn til elektronspinnet på en slik måte at hver bane kan okkuperes av nøyaktig ett elektronpar , hvorav de to elektronene har motsatte magnetiske spinnkvantantall i henhold til Pauli-prinsippet ( ).
Totalt vinkelmoment j og magnetisk kvantetall m j
Spin-bane-interaksjonen blir sterkere mot de tunge atomer . Det fører til at energien til en subshell blir delt i to subshell, avhengig av verdien av det totale vinkelmomentet. Det magnetiske kvantetallet passerer gjennom verdier. Hver av disse orbitalene kan okkuperes av et elektron, så det totale antallet steder forblir det samme. I betegnelsen legges verdien til til symbolet for som en lavere indeks , f.eks. B.
Kvanteteori
Orbitalene er resultatet av den ikke-relativistiske kvanteteorien som følger: Samspillet mellom elektron og atomkjerne er beskrevet av Coulomb-potensialet , atomkjernen antas å være fikset. Den Hamilton operatør for ett-elektron system er
med potensialet
- .
Siden Hamilton-operatøren pendler med vinkelmomentoperatøren, og danner et komplett system for pendling av observerbare . For disse tre operatørene er det vanlige egentilstander som bestemmes av de tre tilknyttede kvantetallene .
Schrödinger-ligningen
kan deles inn i en radius- og en vinkelavhengig del. Egenfunksjonene er produktet av en sfærisk overflatefunksjon (egenfunksjon av vinkelmomentoperatøren) og en radial funksjon
Disse vises standardisert frem til i følgende tabell. Den radius Bohr og atomtall betegne .
Orbitalene vist i følgende tabell er alle justert rundt z-aksen fordi de er egenfunksjoner til operatøren. For å justere en bane med et gitt banevinkelmoment i en hvilken som helst annen retning, må man danne lineære kombinasjoner av bølgefunksjonene for de forskjellige . Den grafiske representasjonen viser et volum på overflaten som sannsynligheten for oppholdstetthet er konstant. Fargene koder for den komplekse fasen av bølgefunksjonen.
| Orbital | Orbitalens bølgefunksjon | Form av bane (ikke i målestokk) | |||
|---|---|---|---|---|---|
| 1s | 1 | 0 | 0 |
|
|
| 2s | 2 | 0 | 0 |

|
|
| 2p 0 | 2 | 1 | 0 |

|
|
| 2p -1 / + 1 | 2 | 1 | ± 1 |
 
|
|
| 3s | 3 | 0 | 0 |

|
|
| 3p 0 | 3 | 1 | 0 |

|
|
| 3p -1 / + 1 | 3 | 1 | ± 1 |
 
|
|
| 3d 0 | 3 | 2 | 0 |

|
|
| 3d -1 / + 1 | 3 | 2 | ± 1 |
 
|
|
| 3d -2 / + 2 | 3 | 2 | ± 2 |
 
|
|
Naturlig bane
En naturlig bane er en bane som ikke resulterer som en egenfunksjon av en Hamilton- operatør , men snarere som en egenfunksjon av en en-elektron-tetthetsoperator . Dette oppnås fra en forhåndsbestemt tilstand med mange partikler, som for eksempel også kan inneholde elektronkorrelasjoner og dermed går utenfor omfanget av en enkeltpartikkelmodell. Elektronkonfigurasjonen dannet med de naturlige orbitalene gir den beste tilnærmingen til den opprinnelig gitt mange-partikkel tilstanden som er mulig med en enkelt-partikkel modell.
Tidsavhengighet
Hvis orbitaler er definert som egenfunksjoner til en operatør som tilsvarer en energi, så er disse orbitalene stasjonære innenfor rammen av den valgte modellen. Eksempler på dette er Hartree-Fock- orbitalene som egenfunksjoner til Fock- operatøren og Kohn-Sham- orbitalene, som er egenfunksjoner til Kohn-Sham-Hamilton-operatøren. I motsetning til dette er de såkalte naturlige orbitalene, som egenfunksjoner til den reduserte en-elektron-tetthetsoperatøren , ikke stasjonære.
Hybridisering
Noen symmetrier av kjemiske bindinger ser ut til å være i strid med de karakteristiske formene til orbitalene. Disse bindingene kan forstås gjennom dannelsen av hybridorbitaler , som kan dannes i nærvær av elektroner med forskjellig orbital vinkelmoment, hvis de er energisk nesten likeverdige (se ovenfor).
Multi-elektronbølgefunksjoner
Tolkningen av orbitaler som bølgefunksjoner til et elektron er bare mulig med enkeltelektronsystemer. En bølgefunksjon for N- elektroner kan deretter konstrueres ved å sette N- orbitaler i en Slater-determinant . Dette garanterer antisymmetri for hele bølgefunksjonen, som er nødvendig for fermioner , men kan ikke representere ytterligere elektronkorrelasjoner . For å også tilnærmet ta hensyn til elektron-elektroninteraksjonen, kan orbitalene bestemmes av Hartree-Fock , Kohn-Sham-beregninger (se: Tetthetsfunksjonell teori i kvantefysikk ) eller MCSCF-beregninger (MCSCF: Multiconfiguration Self Consistent Field). Imidlertid forblir det alltid gyldig at forskjellige valgte orbitaler, hvis de er lineært uavhengige lineære kombinasjoner av de opprinnelige, matematisk resulterer i den samme Slater-determinanten, slik at man ikke entydig kan utlede fra en gitt flerpartikkelbølgefunksjon hva individet okkuperte orbitaler er.
litteratur
- Wolfgang Demtröder : Atomer, molekyler og faste stoffer . 3. Utgave. Springer, 2002, ISBN 3-540-21473-9 .
weblenker
- Hydrogenorbitaler på mikomma.de
- 3D-representasjoner av orbitaler fra University of Sheffield
- 3D-fremstilling av forskjellige orbitaler og et program for å beregne bildene