Elektronkonfigurasjon
Den elektron konfigurasjon angir fordelingen av elektroner til forskjellige energitilstander og således salonger ( atomorbitalene ) innenfor rammen av skallet modell av den atom skallet .
Kvantetall og skjell
Den tilstand av hver elektron i skallet er bestemt ved fire kvantetall ifølge Bohr-Sommerfeld-atom modell og den orbitale modell :

| Kvantumnummer | karakter | Verdiområde | beskrivelse | Eksempler |
|---|---|---|---|---|
| Hovedkvantetall | 1, 2, 3, ... | K, L, M, ... | 3 | |
| Mindre kvantetall | 0,…, n - 1 | s, p, d, f, ... | 0, 1, 2 | |
|
magnetisk vinkelmomentkvantum |
, ..., | s, p x, y, z , d yz, xz, xy, z², x²-y² , ... |
−2, −1, ± 0, +1, +2 | |
|
magnetisk spinnkvantum |
−½, + ½ | ↓, ↑ | −½, + ½ |
I følge Pauli-prinsippet må ikke to elektroner av et atom ha samme tilstand i alle fire kvantetall. Med dette prinsippet kan det vises at elektronene distribueres til de forskjellige tillatte tilstandene og dermed til skallene og underskallene.
De viktigste kvantetallene bestemmer skallene, de sekundære kvantetallene underskjellene. Hvert skall, i henhold til begrensningene for , og fylles med maksimalt 2n² elektroner. Skjellene er betegnet i stigende rekkefølge, begynnende med kjerneskallet, med store bokstaver: K, L, M, N, O, P, Q ... Orbitalene er navngitt i henhold til rekken av spektrallinjer som et eksitert elektron avgir når den er i original orbital faller tilbake; Av historiske årsaker kalles de fire første seriene s (“skarp”), p (“hoved”), d (“diffus”) og f (“grunnleggende”).
Det ytterste okkuperte skallet ( valensskall ) bestemmer den kjemiske atferden og er derfor avgjørende for klassifiseringen i det periodiske systemet .
Fylle bollene i henhold til oppbyggingsprinsippet

Med et økende antall elektroner i elementene er de mulige tilstandene - som begynner med de lavere energiene - okkupert. I følge Hunds regel tildeles orbitalene med samme energi først en gang, deretter to ganger.
Underskjellene fylles i følgende rekkefølge (i rader, dvs. i perioder):
- 1. periode : 1s
- 2. periode : 2s 2p
- 3. periode : 3s 3p
- 4. periode : 4s 3d 4p
- 5. periode : 5s 4d 5p
- 6. periode : 6s 4f 5d 6p
- 7. periode : 7s 5f 6d ...
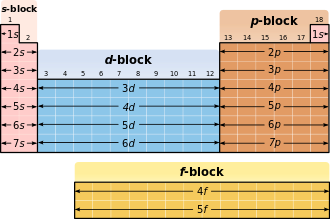
Forhold til periodisk tabell
I det periodiske systemet tilsvarer okkupasjonen av bane til et nytt skall hoppet inn i en ny periode .
| Orbital / blokk |
Antall elektroner |
inneholder elementer av ... |
|---|---|---|
| s | 2 | Element av 1. og 2. hovedgruppe samt helium |
| s | Sjette | gjenværende hovedelementelementer |
| d | 10 | alle undergruppeelementene |
| f | 14. | alle lantanider og aktinider |
notasjon
| 2p |
|
||||
|---|---|---|---|---|---|
| L. | 2s |
|
|||
| K | 1s |
|
|||
| 1s 2 2s 2 2p 4 [He] 2s 2 2p 4 | |||||
Elektronkonfigurasjonen til et atom er beskrevet av de okkuperte subshellene:
- Det antall av skallet er etterfulgt av bokstaven for den nedre skall og hevet antallet elektroner i det nedre skall. Så z. B. for det andre nedre skallet (l = 1 eller p) av det tredje skallet (n = 3 eller M) okkupert av 5 elektroner, betegnelsen 3p 5 .
- Hvis det er flere subshells, er det vanlige skallet utelatt: 2s 2 2p 3 blir 2s 2 p 3 .
- I tilfelle en ytterligere forkortet notasjon, er forkortelsen av edelgassen med neste lavere ordinale nummer plassert i hakeparenteser, som indikerer de manglende underskjellene til elementet som skal vises.
Eksempel på klor : 1s 2 2s 2 2p 6 3s 2 3p 5 → [Ne] 3s 2 3p 5 .
Underskjellene skal ikke spesifiseres i henhold til konstruksjonsprinsippet, men i rekkefølgen av hovedkvantetallet; så z. B. for europium : [Xe] 4f 7 6s 2 .
I tillegg er cellen eller Pauling-notasjonen vanlig som en tydelig grafisk fremstilling.