katalyse
Katalyse (fra gammelgresk κατάλυσις katálysis , tysk 'oppløsning' ) beskriver endringen i kinetikken til en kjemisk reaksjon ved hjelp av en katalysator med sikte på å få den til å begynne med, akselerere den eller lede selektiviteten i en favorisert retning. I den levende cellen spiller enzymer som katalyserer biokjemiske prosesser en grunnleggende rolle i metabolismen fra fordøyelse til reproduksjon og transkripsjon av genetisk informasjon . I miljøsektoren er naturlig forekommende katalytiske prosesser som dannelse av smog av stor betydning, det samme er den katalytiske reduksjonen av forurensende stoffer i bil- og kraftverk. Nye systemer for energiomdannelse og lagring som brenselcellen er basert på katalytiske prosesser.
Den merverdi gjennom katalyse i kjemisk industri er av stor økonomisk betydning, ettersom over 80% av alle kjemiske produkter er produsert ved hjelp av katalytiske prosesser. Ved å optimalisere dem kan energi- og ressursutgiftene reduseres betydelig. Det globale salget for katalysatorer i 2007 var rundt 16 milliarder amerikanske dollar, hvorav over 90% ble generert med katalysatorer for heterogent katalyserte prosesser.
historie
Første funn
De første katalytiske tekniske prosessene som brukes av mennesker er alkoholgjæring fra sukker, brukt av sumererne i Mesopotamia så tidlig som 6000 f.Kr., samt produksjon av eddiksyre fra alkohol ved hjelp av katalytisk aktive enzymer. Etter denne tidlige begynnelsen var det først på 1700- og begynnelsen av 1800-tallet at en hel serie nye katalytiske reaksjoner ble oppdaget. I 1781 oppdaget Antoine-Augustin Parmentier splittelsen av stivelse i sukker under syrekatalyse. Bare ett år senere oppdaget Carl Wilhelm Scheele syrekatalysert forestring av alkoholer og syrer til estere i 1782, og like etterpå oppdaget Joseph Priestley i 1783 nedbrytningen av etanol til etylen og vann på aluminiumoksyd .
Som den første fremgangsmåten for den tekniske fremstilling av en grunnleggende kjemiske, Desormes og Clement utviklet av bly kammeret fremgangsmåte for fremstilling av svovelsyre i 1806 , hvor nitrogenoksider katalyserer oksydasjon av svoveldioksyd. Berthollet oppdaget nedbrytningen av ammoniakk til nitrogen og hydrogen på jernkatalysatorer, og i 1818 oppdaget Thénard nedbrytningen av hydrogenperoksid i sølv , sølvoksid og mangandioksid . Tenningen av hydrogen på platina oppdaget av Döbereiner i 1823 førte til utviklingen av Döbereiner-tenneren , som ble produsert i relativt store mengder og ble brukt til midten av 1800-tallet. I et brev til Johann Wolfgang von Goethe , hans overordnede, skrev Döbereiner om sin oppdagelse: Nådig statsråd! Jeg tar meg frihet, Ew. Et fremragende funn for å gi nyheter ... at det rent metalliske pulverformige platina har den mest bemerkelsesverdige egenskapen til å bestemme hydrogengassen ved berøring og uten noen involvering av eksterne styrker som den kombinerer med oksygengass for å danne vann, hvorav den ene er til platina brenner ut økes summen av varme.
Verk av Berzelius og Ostwald

I 1835 anerkjente Berzelius det felles i de ovennevnte reaksjonene at, i tillegg til utgangsmaterialene og produktene, var det alltid nødvendig med et annet stoff i reaksjonen som tilsynelatende ikke ble konsumert. Han laget begrepet katalyse analogt med analyse : ... Jeg vil kalle det kroppens katalytiske kraft og nedbrytning ved samme katalyse. Den katalytiske kraften ser faktisk ut til å bestå i det faktum at legemer er i stand til å vekke deres blotte tilstedeværelse, og ikke gjennom deres slektskap, slumrer slektskapene ved denne temperaturen, slik at elementene i henhold til dem i en sammensatt kropp endres til slike andre proporsjoner som gir større elektrisk-kjemisk nøytralisering.

Wilhelm Ostwald fant en moderne definisjon av katalyse i 1894. Dette lyder: Katalyse er akselerasjonen av en langsom kjemisk prosess gjennom tilstedeværelsen av et fremmed stoff . Spesifisert senere: En katalysator er et stoff som øker hastigheten på en kjemisk reaksjon uten å bli fortært i seg selv og uten å endre endeposisjonen til den termodynamiske likevekten i denne reaksjonen. Som anerkjennelse for sitt arbeid med katalyse samt for sine grunnleggende studier av kjemiske likevektsforhold og reaksjonshastigheter, ble Ostwald tildelt Nobelprisen i kjemi i 1909 .
Katalyse i matproduksjon
I tillegg til den videre utviklingen av svovelsyreproduksjon i kontaktprosessen som en storskala katalyseprosess, ble heterogen katalyse også brukt i næringsmiddelproduksjonssektoren. Allerede i 1901 oppdaget Wilhelm Normann fettherding gjennom katalytisk hydrogenering av oljesyre til stearinsyre med hydrogen på finfordelt nikkel og dermed grunnlaget for storskala industriell margarinproduksjon. I 1909 ble prosessen brukt i stor skala, og i et anlegg i Warrington , England ble 100 tonn hvalolje bearbeidet til spiselig fett per uke i henhold til Normanns prosess .
Den franske kjemikeren Victor Henri jobbet innen enzymkatalyse allerede i 1903. Han undersøkte nedbrytningen av sukrose til glukose og fruktose ved hjelp av enzymet sukrose . Fortsettelsen av sitt arbeid av den tyske biokjemikeren Leonor Michaelis og den kanadiske legen Maud Menten lyktes i å formulere Michaelis-Menten-teorien i 1913 , hjørnesteinen i enzymkinetikken som fremdeles er gyldig i dag . Potensialet med enzymkatalyse for ressursbesparende produksjon av fine kjemikalier, legemidler, vitaminer eller vaskemidler er langt fra oppbrukt til i dag, mer enn 100 år etter at grunnleggende forhold ble oppdaget.
Storskala industrielle prosesser
Tidlig på 1900-tallet begynte det å bli utviklet en rekke prosesser som fremdeles er blant de viktigste i den kjemiske industrien i dag. Haber , Bosch og Mittasch utviklet syntesen av ammoniakk fra elementene nitrogen og hydrogen på jernkontakter i 1910, Haber-Bosch-prosessen . Wilhelm Ostwald utviklet Ostwald-prosessen med ammoniakkoksidasjon på platinanettverk til salpetersyre , som gjorde den tidligere knappe nitratgjødsel tilgjengelig i stor skala.
I 1913 ble den første Wacker-prosessen for produksjon av acetaldehyd fra acetylen og vann på kvikksølvkatalysatorer oppdaget. Ved væskekatalytisk krakking av silisiumdioksyd / aluminiumoksydkatalysatorer var bensin høyere fra petroleumsfraksjoner som man senere fikk tilgang til ved hydrokraking av nikkelkatalysatorer .
I 1923 utviklet Matthias Pier en katalytisk høytrykksprosess ved BASF for syntese av metanol fra syntesegass på sinkoksid-kromoksydkatalysatorer. Dette gjorde et viktig grunnleggende kjemikalie innen industriell organisk kjemi tilgjengelig, som ble brukt i mange andre prosesser. Fischer og Tropsch oppfant Fischer-Tropsch-prosessen , som fra og med 1925 ble karbonmonoksid og hydrogen oppnådd fra kull omdannet til parafiner og olefiner over jern-koboltkatalysatorer . Prosessen blir stadig viktigere i dag for å skaffe ikke bare drivstoff, men også kjemiske råvarer, som olefiner, fra andre ressurser enn råolje. Omtrent samtidig oppdaget Walter Reppe den homogene katalytiske reaksjonen av acetylener med forskjellige reaktanter under nikkelkomplekskatalyse for å danne et bredt spekter av produkter, den såkalte Reppe-kjemi .
Otto Roelen oppdaget hydroformylering i 1938, produksjonen av aldehyder fra olefiner, karbonmonoksid og hydrogen over koboltkatalysatorer , som han utviklet videre til en industriell prosess. Hydroformylering anses å være den første store anvendelsen av homogene overgangsmetallkatalysatorer. Den opprinnelige Roelens-prosessen har blitt videreutviklet mange ganger. I dag er Ruhrchemie-Rhône-Poulenc-prosessen, som fungerer med vannløselige homogene rodiumkatalysatorer for enklere separasjon av katalysatoren, teknikken innen hydroformyleringsteknologi.
Andre katalytiske prosesser er også utviklet innen raffinaderiteknologi. Ved katalytisk reformering av niedrigoktanigen-alkaner over platina- tinn- eller platina- rhenium / aluminiumoksydkontakter utviklet høyoktan, aromater og isoalkanrike bensiner. Prosessen gir fremdeles flere millioner liter bensin med høyt oktan per dag.
Med lavtrykksprosessen utviklet av Karl Ziegler ved Max Planck Institute for Coal Research , hvor etylen og propylen omdannes til polyolefiner på titan / aluminiumkatalysatorer, ble grunnlaget for den petrokjemiske industrielle masseproduksjonen av polymerer lagt, som varslet alder av plast . Sammen med Giulio Natta ble Ziegler tildelt Nobelprisen i kjemi for dette arbeidet . Ved MPI i Mülheim an der Ruhr var det grunnleggende arbeidet til Günther Wilke , som oppdaget produksjonen av 1,5-cyklooktadien fra 1,3-butadien på nikkelkatalysatorer , samt arbeidet til Wilhelm Keim på SHOP-prosessen. også utført .
Flere Nobelpriser
Forståelsen av enzymkatalyse og dens stereokjemi ble utvidet gjennom arbeidet til Cornforth , som ble tildelt Nobelprisen i kjemi for dette. I tillegg til utviklingen av katalytiske prosesser for basiske og mellomprodukter, har det også blitt utviklet mange prosesser for produksjon av fine kjemikalier gjennom årene.
Arbeidet til William S. Knowles og Ryoji Noyori "for deres arbeid med chiralt katalyserende hydrogeneringsreaksjoner" og epoksydasjonen oppkalt etter Barry Sharpless ble tildelt Nobelprisen.
Også på 1970-tallet oppdaget Richard F. Heck tverrkoblingen katalysert med homogene palladiumkomplekser, som muliggjør direkte olefinering av arylhalogenider. En annen Nobelprisen innen katalyse ble tildelt til Chauvin , Schrock, og Grubbs i 2005 for oppdagelsen av alken metatese av olefiner enn ruthenium katalysatorer . I 2007 ble Gerhard Ertl hedret for sine studier av kjemiske prosesser på faste overflater, som gir omfattende innsikt i de elementære trinnene i heterogent katalyserte reaksjoner.
Økonomisk betydning
Den økonomiske betydningen av katalyse er enorm. Dietten til en stor del av verdens befolkning er basert på mat produsert med mineralgjødsel. Verdensmarkedet for nitrogengjødsel i 2002 tilsvarte rundt 144 millioner tonn ammoniakk ved bruk av Haber-Bosch-prosessen. Cirka 1% av det globale energiforbruket er nødvendig for dette. Potensialet for besparelser ved å øke effektiviteten til de katalytiske prosessene er derfor stort.
Katalyse spiller en nøkkelrolle i området mer effektivt materiale og termisk utnyttelse av fossile og fornybare råvarer så vel som i miljøområdet. Katalytiske prosesser brukes i raffinerier for å produsere drivstoff med lite svovel og høyt oktan. UOP, en av de ledende produsentene av katalytiske reformeringssystemer, oppgir kapasiteten til CCR-systemene som er installert over hele verden i henhold til UOP-patentet med over 600 millioner liter bensin per dag.
Innen miljøteknologi, bilavgasskatalyse, katalytisk reduksjon av nitrogenoksider ved bruk av Denox-prosessen og dieselkatalysatorer gir et avgjørende bidrag til å holde luften ren. Bruken av katalytiske brennere i bygningstjenester er ment å redusere dannelsen av nitrogenoksider på grunn av den lavere forbrenningstemperaturen som dette muliggjør.
Akrolein, hydrocyansyre og ammoniakk
I næringsmiddelproduksjonen brukes tradisjonelt enzymkatalytiske og syre / basekatalyserte prosesser. Aminosyrer som D, L-metionin produseres i økende grad fra råmaterialer oppnådd ved heterogen katalyse slik som akrolein , hydrocyansyre og ammoniakk . Innen produksjon av aktive ingredienser er prosesser for fremstilling av enantiomeriske rene produkter spesielt ettertraktede. I tillegg til de homogene katalytiske prosessene, er biokatalytiske prosesser spesielt fordelaktige her.
Innen fornybare råvarer er bruken av katalytiske prosesser for tiden begrenset hovedsakelig til den basekatalyserte transesterifiseringen av triglyserider med metanol til biodiesel . Den installerte produksjonskapasiteten til biodieselanlegg i Tyskland i 2008 var 4,85 millioner tonn per år, hvorav 2,8 millioner tonn eller rundt 8% av det totale dieselbehovet ble solgt.
Stivelse, cellulose og sukker
De fornybare råstoffene stivelse, cellulose og sukker ble hovedsakelig brukt i enzymkatalytiske gjæringsprosesser. I 2007 ble det brukt rundt 2,1 millioner tonn fornybare råvarer i kjemisk industri.
Fossile råvarer
Det utføres intensiv forskning i nye katalytiske prosesser innen fossile råvarer. Den delvise oksidasjonen av metan, ifølge nåværende estimater, den klart største økonomisk brukbare hydrokarbonkilden, til syntesegass eller direkte heterogen katalytisk eller enzymkatalytisk oksidasjon med metanmonooxygenase til metanol er fokus for nåværende forskning.
Energiske grunnleggende

En enkel kjemisk reaksjon A + B → AB kan for eksempel påvirkes av en katalysatorkatt . Som følger , der A-KAT tilsvarer overgangstilstanden:
Katalysatorer øker reaksjonshastigheten for kjemiske reaksjoner med flere størrelsesordener. Det er imidlertid ikke mulig å bruke katalysatorer for å utføre reaksjoner der den totale energien til sluttproduktene er høyere enn utgangsstoffene. Slike reaksjoner er termodynamisk forbudt selv med katalysatorer : katalyse er derfor et kinetisk og ikke et termodynamisk fenomen. Som med enhver spontan reaksjon, må reaksjonens frie entalpi ( ) være negativ. En katalysator endrer ikke den kjemiske likevekten i en reaksjon, bare hastigheten den skjer med. Den katalytiske effektiviteten er utelukkende basert på evnen til å senke aktiveringsenergien til en kjemisk reaksjon. Det er mengden energi som først må overvinnes for å sette reaksjonen i bevegelse. Under reaksjonen endres reaktanten i økende grad, den vedtar en energisk ugunstig overgangstilstand . Aktiveringsenergien er mengden energi som kreves for å tvinge reaktanten til overgangstilstanden. Det er her effekten av katalysatoren kommer inn, noe som øker sannsynligheten for at reaktanten adopterer overgangstilstanden på grunn av dens romlige struktur og dens ladningsforhold. Dermed kreves mindre energi for å bringe reaktanten i denne tilstanden. De Arrhenius ligning viser effekten av en lav aktiveringsenergi under ellers like reaksjonsbetingelser i reaksjonshastighetskonstanten:
Med
- pre-eksponensiell faktor eller frekvensfaktor , ifølge slagteorien tilsvarer produktet av slagnummeret og orienteringsfaktoren ,
- Aktiveringsenergi (enhet: J / mol)
- = 8,314 J / (K mol) generell gasskonstant
- absolutt (termodynamisk) temperatur (enhet: K)
- Reaksjonshastighet konstant
Katalysen er derfor å anse som en ren kinetisk effekt.
Klassifisering
Katalysen er klassifisert i henhold til forskjellige kriterier, så som de involverte fasene eller typen katalysatorer som brukes. Avhengig av fasen der katalysatoren og substratet er tilstede, skilles det mellom homogen (katalysator og substrat er i samme fase) og heterogen katalyse (katalysator og substrat er i forskjellige faser). Hvis en katalysator eller et substrat endrer fase under reaksjonen, kalles prosessen faseoverføringskatalyse .
Avhengig av typen katalysator som er brukt, er det ytterligere klassifiseringskriterier som overgangsmetallkatalyse, syrebasekatalyse eller biokatalyse. Hvis produktene fra en katalytisk reaksjon har spesielle stereokjemiske egenskaper, kalles dette enantioselektiv katalyse . Hvis et stoff produsert under en reaksjon har en katalytisk effekt på generasjonsreaksjonen, kalles denne prosessen autokatalyse . Avhengig av typen katalysert reaksjon, snakker man for eksempel om oksidasjons- eller hydrogeneringskatalysatorer .
Hvis reaksjoner katalyseres ved hjelp av organiske molekyler som ikke inneholder metaller, men bare består av lette hovedgruppeelementer, kalles dette organokatalyse . Ved organokatalyse reagerer katalysatoren opprinnelig med substratet for å danne en kovalent binding. Et velkjent eksempel er enantioselektiv prolin katalyse. Som et sekundært amin danner prolin en enamin med en karbonylforbindelse , som er i tautomer likevekt med dets iminiumion. I begge former kan det resulterende komplekset gjennomgå et antall reaksjoner, slik som nukleofile aldoltilsetninger eller Knoevenagel-reaksjoner .
I det siste trinnet frigjøres produktet gjennom hydrolyse, og prolinet gjenvinnes som en katalysator.
Heterogen katalyse
I heterogen katalyse er katalysatoren ofte i fast form (såkalt kontakt) og substratet reagerer fra gass- eller væskefasen. Heterogen katalyse er grunnlaget for mange kjemiske og petrokjemiske prosesser. Katalysatorer er ofte faste baser og syrer slik som zeolitter, metalloksider eller heterogene homogene katalysatorer slik som understøttede enzymer. I tillegg til kjemien til den katalytiske reaksjonen, er transportprosesser ofte hastighetsbestemmende trinn i heterogent katalyserte reaksjoner. En stor fordel med heterogene katalysatorer er deres enkle separasjon fra reaksjonsproduktene.
Optimaliseringen av katalytiske prosesser krever en tverrfaglig tilnærming der, i tillegg til kjemisk kjemi og prosess, må aspekter av væskedynamikk , reaktordesign og nye funn innen faststoff- og overflatekjemi og analyse tas i betraktning.
Homogen katalyse
I homogen katalyse, kan katalysatoren og substratet enten være i gassfasen, slik som NO 2 og SO 2 i spissen kammeret prosess, eller i den flytende fase. Selektiviteten er ofte høyere enn i tilfelle av heterogent katalyserte reaksjoner, men det er ofte vanskelig å skille dem fra den resulterende produktblandingen.
Hvis aktiviteten til den anvendte homogene katalysatoren er veldig høy, og hvis den går gjennom tilstrekkelige katalytiske sykluser, er det ikke nødvendig å separere katalysatoren. I slike tilfeller, for eksempel i Ziegler-Natta-prosessen, forblir katalysatoren i produktet i en veldig liten mengde.
Avhengig av hvilken type katalysator som brukes, skilles det mellom følgende typer homogen katalyse:
- Brönsted syre / basekatalyse,
- Lewis-syre / basekatalyse, eller elektrofil / nukleofil katalyse,
- Redoks katalyse,
- Kompleks katalyse,
- organometallisk kompleks katalyse.
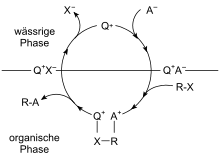
Faseoverføringskatalyse
Hvis en katalysator gjør det mulig for to reaktanter som er i forskjellige faser (vanligvis vandige og organiske faser) å komme i kontakt, kalles dette faseoverføringskatalyse. Katalysatoren for en slik reaksjon gjør det mulig for reaktantene å passere gjennom fasegrensen.
For å muliggjøre kroneter , løsningen av alkalimetallioner i organiske løsningsmidler; anioner, for eksempel MnO 4 - blir dratt inn i den organiske fase som en kroneeter / alkali anion par. Kronetere med 15 og 18 karbonatomer i ringen har vist seg å være spesielt nyttige. Gode enantiomeriske overskudd kan oppnås ved å bruke chirale kronetere.
Kvaternære ammoniumforbindelser , fosfonium- eller arsoniumioner med lipofile alkylrester forbedrer ekstraksjonen. De lipofile øker med økende karboninnhold i alkylresten. Reaksjonshastigheten for faseoverføringskatalyse øker ofte lineært med katalysatorens konsentrasjon.
Biokatalyse
Metabolske prosesser i levende ting katalyseres av enzymer . Disse reaksjonene er generelt karakterisert ved ekstremt høy effektivitet og selektivitet og finner sted ved milde temperaturer og i et vandig medium. Reaktive arter som vil reagere med vann er skjermet av hydrofobe "lommer". Mange biokatalysatorer er proteiner eller inneholder proteinkomponenter. I henhold til deres funksjon er enzymene delt inn i seks klasser som oksidasoreduktaser, transferaser, hydrolaser, lyaser, isomeraser og ligaser.
Noen biokatalytiske prosesser er blant de eldste kjente kjemiske prosessene kjent for mennesker, for eksempel ølbrygging . Biokatalytiske prosesser ved bruk av bakterier, gjær eller sopp, spesielt i produksjonen av vin, øl, ost og andre matvarer, har vært kjent i lang tid. Biokatalytiske prosesser brukes også i økende grad i legemiddelindustrien . Økonomisk viktige biokatalytiske prosesser er fremstilling av vitamin C , produksjon av aspartam , forsukring av stivelse til glukose sirup og de antibiotika -produksjonen ved enzymatisk spaltning av penicillin G .
katalysator
En katalysator er stoffet som forårsaker katalysen beskrevet ovenfor. Katalysatorer brukes til stasjonær og mobil miljøbeskyttelse, i kjemisk industri og i raffineriteknologi. Salget av bilkatalysatorer utgjorde omtrent 5,2 milliarder amerikanske dollar i 2008. Bilkatalysatoren hadde dermed den største andelen av markedet for heterogene katalysatorer. Katalysatorer for stasjonære miljøbeskyttelsesapplikasjoner, som DENOX-katalysatorer, genererte et salg på rundt 1 milliard dollar over hele verden. Cirka 30% av markedet er for katalysatorer for raffinaderiprosesser som plattforming og catracking , ytterligere 30% brukes i en rekke prosesser i kjemisk industri.
Effektiviteten eller aktiviteten til en katalysator uttrykkes av antall omdreininger , også kalt omdreiningstall , eller av antall omdreininger per tidsenhet, omgangsfrekvensen . En annen viktig egenskap ved en katalysator er dens selektivitet, det vil si dens evne til å akselerere bare de ønskede reaksjonene, men unngå generering av uønskede biprodukter.
I tillegg til den faktiske katalysatoren krever en katalytisk syklus ofte en kokatalysator som har en positiv effekt på aktiviteten eller selektiviteten til en katalysator. Et velkjent eksempel er funksjonen av metylaluminoxan som en co-katalysator i olefinpolymerisasjon og hydriodic syre i Monsanto prosessen .
Produksjon av heterogene katalysatorer
Effektiviteten til heterogene katalysatorer avhenger hovedsakelig av antall mulige samtidige kontakter mellom katalysatoren og substratene, for hvilken den største mulige katalysatoroverflaten ofte er viktig. Heterogene katalysatorer kan være i form av ikke-porøse fullkontakter eller metallmasker, som i Ostwald-prosessen, med lave spesifikke overflatearealer eller som porøse faste stoffer med høyt spesifikke overflatearealer. Fulle kontakter kan f.eks. Opprettes ved utfelling eller samutfelling av metallsalter med alkalikarbonater eller hydroksider. Etter utfelling vaskes disse, tørkes, kalsineres og aktiveres om nødvendig ved å redusere dem til metall. Katalyse av oksidasjonsreaksjoner krever ofte fulle kontakter, som bare har den aktive komponenten i det ytre området av katalysatorlegemet og tillater rask diffusjon av reaktantene fra og inn i hovedgassstrømmen, det hastighetsbestemmende trinnet i disse reaksjonene.
Heterogene katalysatorer er laget på mange forskjellige måter. En velkjent prosess er ekstrudering for produksjon av katalysatorer for katalysatoren til bilens eksos, som deretter blir belagt med en vaskelakk. En porøs kontakt består enten av fast materiale slik som aluminiumoksyd eller av et bærermateriale som er impregnert eller belagt med en katalytisk aktiv komponent og eventuelt aktivatorer.
Et viktig aspekt ved de porøse kontaktene er fordelingen av porestørrelsene. De porer i katalysator korn øke det spesifikke overflateareal betraktelig. Dette kan være flere hundre kvadratmeter per gram. I henhold til IUPAC- definisjonen er det tre porestørrelsesområder: mikroporer med en diameter på mindre enn 2 nm, mesoporer i området fra 2 til 50 nm og makroporer som er større enn 50 nm. For utformingen av katalysatoren er det viktig at porestørrelsesfordelingen blir tilpasset diffusjonen og reaksjonshastigheten til reaksjonen.
Etter at en bærer er impregnert med en metallsaltoppløsning , blir metallet tørket , kalsinert og aktivert , for eksempel . På grunn av de spesifikke forholdene i disse trinnene, kan spesielle metallprofiler valgfritt settes på en bærerpellets , som må skreddersys til reaksjonskinetikken og diffusjonskarakteristikkene til reaktantene i den katalyserte reaksjonen.
I heterogen katalyse bærer bærermaterialer de findelte, katalytisk aktive metallklyngene og kan på grunn av deres egenskaper tjene som samkatalysatorer, eller som ligander har de en innflytelse på den katalytiske aktiviteten til det dispergerte metallet. Når det gjelder mikroporøse stoffer som zeolitter, har ionebytte bevist sin verdi.
På grunn av spesielle strukturer, for eksempel i tilfelle zeolitter, kan bærermaterialer påvirke selektiviteten til en reaksjon. Eksempler på bærematerialer er kordieritt , kullsvart , kiselgel , zeolitter eller metalloksider slik som titandioksid og aluminiumoksid .
Produksjon av homogene overgangsmetallkatalysatorer
Produksjonen av homogene overgangsmetallkatalysatorer utføres ofte ved hjelp av metodene for organometallisk kjemi. Mange overgangsmetallkatalysatorer er følsomme for luft og fuktighet. Liganddesignen er av spesiell betydning for utbyttet og selektiviteten til den homogent katalyserte reaksjonen. De elektroniske og steriske egenskapene til liganden kan kontrollere reaksjonen og for eksempel overføre sterisk informasjon til reaktantsystemet.
Katalysator deaktivering og regenerering
Mekanismene for katalysator deaktivering er forskjellige. I overgangsmetallkatalyse observeres for eksempel reduksjonen av metall-ligandkatalysatorene som brukes til metallet.
Deaktiveringstypen kan grovt deles inn i mekanisk, for eksempel gjennom slitasje eller desintegrasjon, termisk som for eksempel sintring, fysisk som koksing eller fysisk blokkering av aktive sentre, og kjemisk deaktivering ved dannelse av inaktive metallkomponenter som sulfider .
I heterogen katalyse er koksing, sintring av den aktive overflaten eller oppløsningen av katalysatoren på grunn av mekanisk slitasje, for eksempel i prosesser med fluidisert seng, kjent i raffineriprosesser . Aldringsprosesser kan redusere størrelsen på den katalytisk aktive overflaten eller tette porene, for eksempel i zeolitter.
Regenereringsprosessene inkluderer for eksempel avbrenning av koks fra kontakter som brukes i sprekkprosesser eller katalytisk reformering, eller oksyklorering for å gjenopprette sure sentre. Hvis katalysatoren er deaktivert i en slik grad at regenerering ikke lenger gir mening, blir katalysatoren fjernet fra prosessen. I tilfelle edelmetallkatalysatorer smeltes bærerne om nødvendig, og edelmetallet utvinnes ved smelting og elektrokjemiske prosesser.
Deaktivering gjennom faseendringer er ofte irreversibel. Dette observeres for eksempel i sink / aluminiumoksydkatalysatorer for syntesen av metanol som har blitt utsatt for for høye temperaturer. Katalysatoren deaktiveres ved dannelse av en spinelfase og kan ikke regenereres.
Katalytiske mekanismer
Mekanismer i heterogen katalyse
I tillegg til den kjemiske reaksjonen, kan transportprosessene være hastighetsbestemmende trinn i heterogen katalyse. Totalt syv trinn kan skilles ut. Den første er diffusjonen av reaktantene fra gassstrømmen inn i katalysatoren. Det andre trinnet er porediffusjon, etterfulgt av adsorpsjonen av reaktantene på det aktive stedet. Etter den kjemiske reaksjonen forlater produktene kontakten gjennom desorpsjon, porediffusjon igjen og diffusjon i hovedgassstrømmen.
Den kjemiske prosessen etter adsorpsjon kan finne sted på forskjellige måter. I monomolekylære reaksjoner brytes for eksempel edukten på overflaten av katalysatoren. Når det gjelder bimolekylære reaksjoner, kan det tenkes tre mekanismer, som avhenger av om og hvordan reaktantene adsorberes.
Langmuir-Hinshelwood mekanisme
Den Langmuir - Hinshelwood mekanisme består av trinnene med adsorpsjon, overflatediffusjon, overflatereaksjon og desorpsjon. Først og fremst må begge utgangsmaterialene A og B adsorberes fra gassfasen på katalysatoroverflaten :
De adsorberte artene diffunderer på overflaten av katalysatoren og reagerer for å danne produkt C:
I det siste trinnet desorberer produkt C:
Langmuir-Hinshelwood-mekanismen har blitt demonstrert blant annet for oksidasjon av CO på platinakatalysatorer, metanolsyntese på sinkoksydkatalysatorer og oksidasjon av etylen til acetaldehyd på palladiumkatalysatorer.
Eley-Rideal mekanisme
I Eley-Rideal-mekanismen , som ble foreslått av DD Eley og Eric Rideal i 1938 , adsorberer reaktant A opprinnelig på katalysatoroverflaten:
Den adsorberte edukten reagerer deretter med en annen edukt B fra gassfasen for å danne produkt C:
I det siste trinnet desorberer produkt C:
Eley-Rideal-mekanismen har blitt demonstrert blant annet for oksidasjon av ammoniakk på platinakatalysatorer og selektiv hydrogenering av acetylen på jernkatalysatorer.
Mars van Krevelen mekanisme
Educt A adsorberes først fra gassfasen på katalysatoroverflaten:
Dette etterfølges av oksidasjon av edukt A med gitteroksygen til stede:
Produkt AO desorberer og en oksygen ledighet opprettes i krystallgitteret:
Etter desorpsjon fylles stillingene opp igjen ved oksidering med oksygen:
Den oksidative dehydrogeneringen av propan til propen fortsetter i henhold til en Mars-van-Krevelen-mekanisme på vanadiumholdige metalloksydkatalysatorer.
Mekanismer i homogen katalyse
Velkjente former for homogen katalyse er syrebasekatalyse, overgangsmetallkatalyse og organokatalyse. Mekanismene for organokatalyse er forskjellige. Mer nylig har bruken av chirale aminosyrer som prolin i enantioselektive synteser blitt undersøkt. Sammenlignet med overgangsmetallkatalyse trenger organokatalyse neppe å utføres med utelukkelse av luft eller vann; katalysatorene er lett å få fra naturlige stoffer og kan brukes i forskjellige løsningsmidler.
Syre-base katalyse
Et velkjent eksempel på en syrekatalysert reaksjon er den ovennevnte forestring av karboksylsyrer med alkoholer eller reversering av denne reaksjonen med forsæbning . Det skilles mellom to typer, spesifikk og generell syre- eller basekatalyse.
I tilfelle spesifikk syrekatalyse i et løsningsmiddel S, er reaksjonshastigheten proporsjonal med konsentrasjonen av det protonerte løsemiddelmolekylet HS + .
Syren selv, AH, tar bare del i reaksjonen i den form at den forskyver likevekten mellom løsningsmidlet og syren til den protonerte formen av løsningsmidlet SH + :
I en bufret vandig løsning avhenger reaksjonshastigheten til reaktanten R bare av pH i systemet, men ikke av konsentrasjonen av den involverte syren.
Denne type av kjemisk kinetikk observeres når reaktanten R 1 er i hurtig likevekt med sin tilsvarende syre R 1 H + , som deretter langsomt ytterligere reagerer med R 2 under dannelse av reaksjonsprodukter, for eksempel i tilfelle av aldolkondensasjon .
Generelt syrekatalyse bidrar alle arter som kan gi en proton til å øke reaksjonshastigheten, med sterke syrer som er mer effektive.
Protonoverføring er det hastighetsbegrensende trinnet i generell syrekatalyse, for eksempel i azokobling .
Overgangsmetallkatalyse
Det første trinnet i homogen overgangsmetallkatalyse er dannelsen av den aktive arten fra pre-katalysatoren. På den faktiske katalysatoren finner den oksidative tilsetningen av et substrat sted i det andre trinnet, og endrer oksidasjonstilstanden til katalysatormetallet. I et ytterligere trinn kompleksiserer et annet substrat den katalytisk aktive arten. En typisk reaksjon i det følgende trinn er innføring av dette substratet i det tidligere dannede substrat-katalysatorbinding av det oksidativt tilførte substratet. Den katalytiske syklusen lukkes ved omlegging og påfølgende reduktiv eliminering av det dannede produkt, og frigjør den opprinnelige katalysatoren.
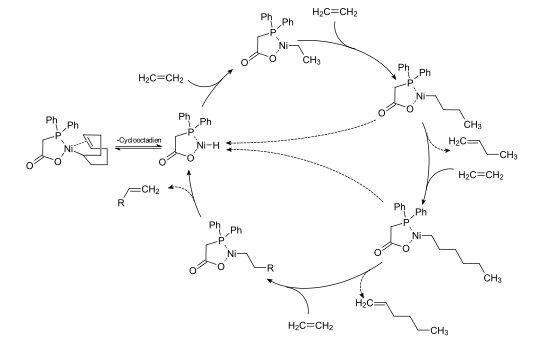
I SHOP-prosessen dannes den katalytisk aktive arten ved å splitte cyklooktadienliganden fra nikkel-difenylfosfinoeddiksyre-COD-komplekset. Ved å sette eten inn i nikkel-hydrogenbindingen dannes et nikkel-alkylkompleks, i hvilket nikkel-karbonbinding ytterligere etenenheter kan settes inn. Ved reduktiv eliminering av a-olefinen frigjøres nikkel-hydrogen-difenylfosfinoeddiksyrekomplekset igjen, som igjen representerer utgangspunktet for ytterligere katalytiske sykluser.
Andre eksempler på homogent katalyserte prosesser er hydrocyanering , hydroformylering eller olefinmetese .
Nobelpriser i katalyse
| år | person | Årsak til å tildele prisen |
|---|---|---|
| 1909 | Wilhelm Ostwald | "Som anerkjennelse for sitt arbeid med katalyse og for hans grunnleggende studier av kjemiske likevektsforhold og reaksjonshastigheter" |
| 1912 | Paul Sabatier | "For hans metode for å hydrogenere organiske forbindelser i nærvær av finfordelte metaller, der fremdriften i organisk kjemi har blitt sterkt fremmet de siste årene." |
| 1918 | Fritz Haber | "For syntese av ammoniakk fra dets grunnstoffer" (Haber-Bosch-prosessen) |
| 1932 | Irving Langmuir | "For hans oppdagelser og forskning innen overflatekjemi" |
| 1946 | James Batcheller Sumner | "For hans oppdagelse av krystalliserbarheten av enzymer" |
| 1963 |
Karl Ziegler , Giulio Natta |
"For deres oppdagelser innen kjemi og teknologien til høypolymerer" ( Ziegler-Natta-prosessen ) |
| 1975 | John W. Cornforth | "For sitt arbeid med stereokjemi av enzymkatalysereaksjoner" |
| 2001 |
William S. Knowles , Ryoji Noyori |
"For deres arbeid med chiralt katalyserende hydrogeneringsreaksjoner" |
| Barry Sharpless | "For sitt arbeid med kiralt katalyserende oksidasjonsreaksjoner" ( Sharpless epoxidation ) | |
| 2005 |
Yves Chauvin , Robert Grubbs , Richard R. Schrock |
"For utvikling av metatesesmetoden i organisk syntese" |
| 2007 | Gerhard Ertl | "For sine studier av kjemiske prosesser på faste overflater" |
| 2010 |
Richard F. Heck , Ei-ichi Negishi , Akira Suzuki |
"For palladium -katalysert krysskoplinger i organisk syntese " |
Organisasjoner
Ulike foreninger i Europa er aktive på nasjonalt og internasjonalt nivå som et grensesnitt for utveksling mellom industri og universiteter. Organisasjonene støtter markedsføring av forskning og undervisning og fungerer som interessegrupper innen katalyse.
I Tyskland er German Catalysis Society (GECATS) aktivt på europeisk nivå, og European Federation of Catalysis Societies (EFCATS) representerer vitenskapelige organisasjoner innen katalyse i 25 land. International Association of Catalysis Societies (IACS) har organisert den internasjonale kongressen om katalyse (ICC) siden 1956. Etter den siste ISS-kongressen i München i 2012, vil den neste finne sted i Beijing i juli 2016. I Nord-Amerika representerer det nordamerikanske Catalysis Society (NACS) interessene til katalyse.
Fagbøker (utvalg)
Den nåværende tilstanden for forskning innen katalyse publiseres i et stort antall tidsskrifter og spesialtidskrifter. Blant dem er Catalysis Letters , som er redigert av Norbert Kruse og Gábor A. Somorjai og publiserer artikler innen homogen, heterogen og enzymatisk katalyse.
De Kata Anmeldelser understreker tverrfaglig aspekt av katalyse og publisere artikler i ulike områder som reaktor design, datasimulering og fremskritt i analytiske prosesser.
Applied Catalysis magazine vil bli utgitt i et A- og B-nummer. Mens A-utgaven konsentrerer seg om området for tradisjonell katalyseforskning med fokus på katalytiske sykluser innen homogen, heterogen og enzymatisk katalyse, samt aspekter av katalysatorproduksjon, aktivering og deaktivering, aldring og regenerering, B-utgaven tar for seg katalytiske prosesser i miljøsektoren.
Catalysis Today publiserer hovedsakelig originale artikler og anmeldelser om individuelle emner.
Den Journal of Catalysis publiserer, for eksempel studier av katalytiske elementære prosesser på overflater eller metallkomplekser, fra analytiske metoder til teoretiske aspekter ved katalyse i alle områder av katalyse.
I Kinetics and Catalysis , en russisk tidsskrift, er publikasjonen i fokus innen kinetiske studier og kvantemekaniske beregninger.
litteratur
Katalyse generelt
- B. Cornils, WA Herrmann , M. Muhler, C. Wong: Catalysis from A to Z: A Concise Encyclopedia. Verlag Wiley-VCH, 2007, ISBN 978-3-527-31438-6 .
- J. Hagen: Teknisk katalyse. En introduksjon. Wiley-VCH, 1996, ISBN 3-527-28723-X , ISBN 978-3-527-28723-9 .
- M. Baerns : Grunnleggende prinsipper i anvendt katalyse. Springer, Berlin 2004, ISBN 3-540-40261-6 .
Homogen katalyse
- Arno Behr : Anvendt homogen katalyse. Wiley-VCH Verlag, 2008, ISBN 978-3-527-31666-3 .
- Dirk Steinborn : Grunnleggende om organometallisk kompleks katalyse. Vieweg + Teubner, 2007, ISBN 978-3-8351-0088-6 .
Heterogen katalyse
- P. Kripylo, K.-P. Wendlandt, F. Vogt: Heterogen katalyse i kjemisk teknologi. Tysk forlag for grunnleggende industri, Leipzig 1993, ISBN 3-342-00666-8 .
- Gábor A. Somorjai : Introduksjon til overflatekjemi og katalyse . Wiley, New York 1994, ISBN 0-471-03192-5 (engelsk).
- Gerhard Ertl , Helmut Knözinger , Ferdi Schüth , Jens Weitkamp : Handbook of Heterogeneous Catalysis. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31241-2 .
- Gerhard Ertl: Reaksjoner på overflater: fra atom til kompleks (Nobel Lecture). (Engelsk) (PDF-fil; 666 kB)
Biokatalyse
- GE Jeromin, M. Bertau: Bioorganikum: Praktisk kurs i biokatalyse. Wiley-VCH, 2005, ISBN 3-527-31245-5 .
weblenker
Individuelle bevis
- ^ Wilhelm Gemoll : Gresk-tysk skole- og håndbok . München / Wien 1965.
- ↑ Dirk Steinborn: Grunnleggende om organometallisk kompleks katalyse. Springer-Verlag, 2007, ISBN 978-3-8351-0088-6 ( begrenset forhåndsvisning i Google-boksøk).
- ↑ Döbereinersche lightere. (Ikke lenger tilgjengelig online.) Www.gnegel.de, arkivert fra originalen 4. august 2008 ; Hentet 5. januar 2010 .
- ^ Brev mellom Goethe og Johann Wolfgang Döbereiner, 1810–1830, utgitt av Julius Schiff, Verlag Böhlau, 1914.
- ^ Rutger A. Santen, P. Van Leuwen, J. Moulijn: Catalysis. Elsevier, 2000, ISBN 978-0-444-50593-4 ( begrenset forhåndsvisning i Google-boksøk).
- Ost W. Ostwald: Rapport om arbeidet til F. Strohmann: Om varmeinnholdet i bestanddelene i maten. I: Z. phys. Chem. 15 (1894), s. 705 f.
- ^ Historie og utvikling av fettherding. (Ikke lenger tilgjengelig online.) Www.dgfett.de, arkivert fra originalen 28. august 2007 ; Hentet 5. januar 2010 .
- ↑ Hubert Rehm: Biochemistry light. Tysk, 2008, ISBN 978-3-8171-1819-9 , s. 23 ( begrenset forhåndsvisning i Google-boksøk).
- ↑ Jan Koolman: Pocket Atlas of Biochemistry. Georg Thieme Verlag, 2003, ISBN 978-3-13-759403-1 , s. 90 ( begrenset forhåndsvisning i Google- boksøk ).
- ↑ James E. Huheey: Uorganisk kjemi. Walter de Gruyter, 2003, ISBN 978-3-11-017903-3 , s. 837 ( begrenset forhåndsvisning i Google-boksøk).
- ↑ Werner Abelshauser: BASF. CHBeck, 2002, ISBN 978-3-406-49526-7 , s. 672 ( begrenset forhåndsvisning i Google- boksøk ).
- ↑ Reppe-Chemie hos BASF ( siden er ikke lenger tilgjengelig , søk i nettarkiver ) Info: Linken ble automatisk merket som defekt. Sjekk lenken i henhold til instruksjonene, og fjern deretter denne meldingen.
- ↑ Boy Cornils, Wolfgang Herrmann A., Manfred Rasch : Otto Roelen som en pioner av industriell homogen katalyse . I: Angewandte Chemie. 106, 1994, s. 2219-2238.
- ↑ Guttekorniler: Vannfase organometallisk katalyse. John Wiley & Sons, 2004, ISBN 978-3-527-30712-8 , s. 639 ( begrenset forhåndsvisning i Google-boksøk).
- ↑ Thomas James Lindberg: Strategier og taktikk i organisk syntese. Academic Press, 2004, ISBN 978-0-12-450283-3 , s. 316 ( begrenset forhåndsvisning i Google Book Search).
- ↑ Informasjon fra den Nobelstiftelsen på 2007 prisutdelingen til Gerhard Ertl (engelsk)
- ^ CCR-plattformer. (PDF) (Ikke lenger tilgjengelig online.) Www.uop.com, arkivert fra originalen 9. november 2006 ; åpnet 31. desember 2009 .
- ↑ fornybare produkter Produsert i Tyskland: Biodrivstoff generelt. (Ikke lenger tilgjengelig online.) Www.renewables-made-in-germany.com, arkivert fra originalen 24. februar 2015 ; Hentet 5. januar 2010 .
- ↑ Fornybare råvarer i industrien. (PDF; 4,1 MB) www.fnr-server.de, åpnet 5. januar 2010 .
- Pl Max Planck Society - Et pulver mot sløsing med energi. www.mpg.de, åpnet 5. januar 2010 .
- ^ CM Starks: faseoverføringskatalyse. Springer Science & Business Media, 1994, ISBN 978-0-412-04071-9 ( begrenset forhåndsvisning i Google-boksøk).
- ↑ Ryoji Noyori: Asymmetrisk katalyse: vitenskap og muligheter, nobel forelesning, 8. desember 2001. (PDF; 879 kB) nobelprize.org, åpnet 21. november 2009 .
- ^ Skrift fra University of Hannover om organokatalyse ( Memento fra 11. juni 2007 i Internet Archive )
- ↑ U. Eder, G. Sauer, R. Wiechert: Ny type asymmetrisk syklisering til optisk aktive steroide CD-partielle strukturer. I: Angew. Chem., Int. Ed. 1971, 10, s. 496
- ↑ Dirk Steinborn : Grunnleggende om organometallisk kompleks katalyse. Verlag BG Teubner, 2007, ISBN 978-3-8351-0088-6 , s. 8.
- ↑ PTCIssue17.pdf (applikasjon / pdf-objekt). (PDF; 351 kB) www.phasetransfer.com, åpnet 4. januar 2010 .
- ↑ Manfred T. Reetz : biocatalysis i organisk kjemi og bioteknologi: Fortid, nåtid og fremtid. I: J. Am. Chem. Soc. 135 (2013) s. 12480-12496.
- ^ Oppføring på Langmuir - Hinshelwood-mekanismen . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.L03451 .
- ↑ Kurt W. Kolasinski: Surface Science. John Wiley & Sons, 2008, ISBN 978-0-470-99781-9 , s. 183 ( begrenset forhåndsvisning i Google Book Search).
- ↑ Oppføring ved spesifikk katalyse . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.S05796 Versjon: 2.3.1.
- Innføring i generell syrekatalyse . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.G02609 Versjon: 2.3.1.
- ↑ W. Keim, FH Kowaldt, R. Goddard, C. Krüger: Novel koordinering fremgangsmåten i (benzoylmethylene) trifenylfosforan i et nikkel-oligomeriseringskatalysator. I: Anvendt kjemi. 1978, 90, s. 493.
- ↑ , GECATS - German Catalysis Society - German Catalysis Society. www.gecats.de, åpnet 26. desember 2009 .
- ↑ EFCATS - European Federation of Catalysis Societies. www.efcats.org, åpnet 26. desember 2009 .
- ^ IACS - International Association of the Catalysis Societies. (Ikke lenger tilgjengelig online.) Www.iacs-icc.org, arkivert fra originalen 21. januar 2009 ; Hentet 5. januar 2010 .
- ^ The North American Catalysis Society. www.nacatsoc.org, åpnet 5. januar 2010 .


























![{\ mathrm {- {\ frac {d [R1]} {dt}} = k [SH ^ {+}] [R1] [R2]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9996175982cf896daa1b65e6634d4f550c3d000)
![{\ mathrm {- {\ frac {d [R1]} {dt}} = k_ {1} [SH ^ {+}] [R1] [R2] + k_ {2} [AH ^ {1}] [R1 ] [R2] + k_ {3} [AH ^ {2}] [R1] [R2] + \ dots}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/341fec73fb75a3804330d3792306c75dc430c664)