fenol
| Strukturell formel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Generell | ||||||||||||||||||||||
| Etternavn | fenol | |||||||||||||||||||||
| andre navn |
|
|||||||||||||||||||||
| Molekylær formel | C 6 H 6 O | |||||||||||||||||||||
| Kort beskrivelse |
fargeløse nålformede krystaller med en gjennomtrengende lukt |
|||||||||||||||||||||
| Eksterne identifikatorer / databaser | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Legemiddelinformasjon | ||||||||||||||||||||||
| ATC-kode | ||||||||||||||||||||||
| eiendommer | ||||||||||||||||||||||
| Molarmasse | 94,11 g mol −1 | |||||||||||||||||||||
| Fysisk tilstand |
fast |
|||||||||||||||||||||
| tetthet |
1,07 g cm −3 |
|||||||||||||||||||||
| Smeltepunkt |
41 ° C |
|||||||||||||||||||||
| kokepunkt |
182 ° C |
|||||||||||||||||||||
| Damptrykk |
0,2 hPa (20 ° C) |
|||||||||||||||||||||
| pK s verdi |
9.99 |
|||||||||||||||||||||
| løselighet |
moderat i vann (84 g l -1 ved 20 ° C) |
|||||||||||||||||||||
| Brytningsindeks |
1,5408 (41 ° C) |
|||||||||||||||||||||
| sikkerhetsinstruksjoner | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
|
|||||||||||||||||||||
| Toksikologiske data | ||||||||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er oppgitt, gjelder opplysningene standardbetingelser . Brytningsindeks: Na-D-linje , 20 ° C | ||||||||||||||||||||||
Fenol eller hydroksybenzen (utdaterte også karbolsyre eller karbol for kort ) er et aromatisk , organisk forbindelse og består av en fenylgruppe (-C 6 H 5 ) til hvilken en hydroksylgruppe (-OH) er festet. Det fargeløse, krystallinske faste stoffet er et viktig industrielt kjemikalie og brukes som et mellomprodukt, spesielt ved fremstilling av forskjellige plastmaterialer . Fenol er den enkleste representanten for fenolene . Med baser danner fenol salter , fenolatene .
nomenklatur
Det systematiske navnet IUPAC er Benzenol . Men IUPAC navn foretrukket i dag er fenol .
historie
Fenol ble oppdaget i 1834 av kjemikeren Friedlieb Ferdinand Runge under destillasjonen av kulltjære ; han kalte stoffet "karbolsyre". Auguste Laurent gjenoppdaget den i 1841 og bestemte molekylformelen som C 6 H 6 O. Charles Gerhardt kalte den fenol . Navnet refererer til kullgassen, som ble produsert i tillegg til kulltjære under produksjonen av koks. På den tiden ble belysningsgass ( bygass ) brukt til å belyse byer (gresk phainomai : å skinne).
Joseph Lister brukte den i 1865 - i en fem prosent løsning - som et antiseptisk middel for desinfisering av sår; På den tiden var karbolsyre nesten det eneste tilgjengelige middel mot sårinfeksjoner. På grunn av hudirriterende bivirkninger ble det imidlertid snart erstattet av andre antiseptiske midler. På grunn av sin bakteriedrepende effekt ble den brukt som desinfeksjonsmiddel og erstattes nå av derivater av fenol.
Fenol kombineres med formaldehyd for å fremstille fenolharpiksen - Harpiks brukt: under varemerket var Bakelite fenolharpiks på begynnelsen av 1900-tallet som den første helsyntetiske, industrielt produserte plasten .
Under Holocaust , SS-leger myrdet konsentrasjonsleirfanger og andre. ved intrakardiale fenolinjeksjoner .
Den vannløselige bedøvelsesmiddel propofol, utviklet i 1977, er et av de nyere kjente fenolderivatene .
Utvinning og presentasjon
Fenoler kan ikke representeres av elektrofil aromatisk substitusjon , siden en tilsvarende oksygenelektrofil ikke er tilgjengelig.
Industriell produksjon
I industriell skala produseres den basiske kjemiske fenolen ved kumenhydroperoksydprosessen , også kjent som Hock- fenolsyntese ( Hock-prosess ):
Benzen og propen blir først omdannet til isopropylbenzen ( kumen ) ved en Friedel-Crafts-alkylering i syre . Kumen oksyderes av oksygen i luften for å danne hydroperoksid , som spaltes gjennom sur opparbeidelse med omlegging til fenol og aceton . Samtidig opprettelse av to verdifulle produkter som er lett å skille, gjør denne prosessen spesielt økonomisk.
Produksjon fra fornybare råvarer
Det forskes for tiden på måter å produsere fenol fra fornybare råvarer og spesielt fra lignin . Ulike pyrolyse-varianter med påfølgende produktpreparat er egnet for dette . Det anslås imidlertid at det vil ta ytterligere 10 til 20 år før slik fenolproduksjon blir kommersialisert.
Produksjon i laboratoriet
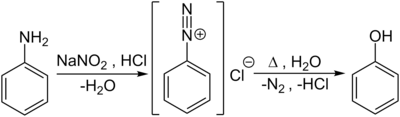
På laboratorieskala er fenoler også ved koking av diazoniumsalter representert ved diazotisering av aromatiske aminoforbindelser - her av anilin med - salpetersyre produsert oppstår i kulde:
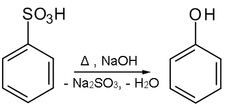
En annen mulighet for representasjon består i å smelte natriumsaltet av benzensulfonsyre med alkalihydroksid i en nukleofil aromatisk substitusjon i henhold til tilsetnings-eliminasjonsmekanismen ( ipso-substitusjon ):
I betydningen radikal substitusjon kan benzen omdannes til fenol i Fenton-reaksjonen . Den Baeyer-Villiger-oksidering av acetofenon gir fenylacetat , som frigir fenol etter forsåpningen.
eiendommer
Fysiske egenskaper
Ren fenol danner fargeløse krystallnåler ved romtemperatur, men det kommersielt tilgjengelige produktet er vanligvis rosa til rødbrunt på grunn av mindre, men intenst fargede urenheter. Smeltepunktet er 41 ° C og kokepunktet er 182 ° C. Den har en karakteristisk, aromatisk lukt. På grunn av den hydrofile OH-gruppen er fenol hygroskopisk . En begrenset mengde vann oppløses i fenol. Med rundt 6% vann er blandingen flytende ved 20 ° C. Fenol er bare moderat oppløselig i vann. Mellom løsningene med høyt og lavt fenolinnhold er det et blandbarhetsgap . Fenol flytende med vann ble kalt Phenolum liquefactum i det medisinske feltet .
Kjemiske egenskaper
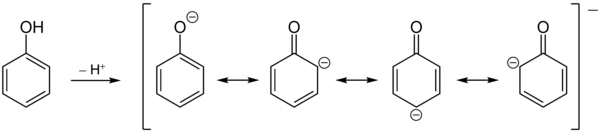
Hydroksylgruppen av fenol er surere enn alkohol ; derfor er fenol en svak organisk syre . Årsaken er mesomerismestabiliseringen av den tilsvarende basen av fenolationen. Den negative ladningen kan delokaliseres i ringen.
I motsetning til alkoholer inngår fenoler bare nukleofile substitusjonsreaksjoner ved høye temperaturer og i nærvær av spesielle katalysatorer, hvor hydroksylgruppen erstattes av andre nukleofiler . Hydroksyfunksjonen viser, spesielt i deprotonert tilstand, en uttalt + M-effekt . I tillegg viser det en −I effekt . Men siden dette er betydelig mindre enn + M-effekten, blir fenol veldig lett angrepet av elektrofiler. Angrepet finner sted fortrinnsvis i orto- og para- stilling til hydroksylgruppen. På grunn av hydroksongruppens elektrondonende natur er fenol omtrent tusen ganger mer reaktiv enn benzen. Foretaket for orto- eller para- angrep av elektrofiler kan forstås på den ene siden ved å vurdere grensestrukturene til fenolatanionet. Den negative ladningen blir avlokalisert i den aromatiske ringen til orto- og paraposisjonene . Siden elektrofiler foretrekker å angripe elektronrike posisjoner, oppstår den observerte regioselektiviteten . På den annen side, den σ-kompleks (karbenium-ion) dannes som et mellomtrinn i den substitusjon er mer mesomeric stabiliseres i orto og para- stillinger enn i den meta- stilling, ettersom mer lavenergi grensestrukturer er mulige, og de delokalisering av elektronene er derfor mer uttalt. Substitusjon i paraposisjonen er også foretrukket, siden det ikke er noen sterisk interaksjon mellom den angripende elektrofilen og de ensomme elektronparene av oksygenet.
Den keto-enol-tautomeri er helt på enol side på grunn av dannelsen av de termodynamisk gunstige aromatiske system.
En teknisk viktig nukleofil substitusjonsreaksjon er fremstilling av anilin fra fenol ved 250 ° C i nærvær av en oksydkatalysator ( aluminium , silisium eller magnesiumoksid , også borsyre ) som en " Halcon-prosess ".
Fenol omdannes til cykloheksanol ved katalytisk hydrogenering .
bruk

Fenol brukes hovedsakelig som råvare for produksjon av plast . Produksjonen av fenoplaster spiller den viktigste rollen her. Fenol blir også omdannet til kaprolaktam , et stoff som brukes til fremstilling av polyamider . Omdannelsen til bisfenol A gir et viktig utgangsmateriale for produksjon av epoksyharpikser .
Legemidlet acetylsalisylsyre er laget av fenol . I mikroskopi brukes fenol til konservering og til gramfarging .
Tidligere ble en løsning av 22 promille fenol per liter vann brukt som et desinfeksjonsmiddel, såkalt karbolisk vann eller karbolisk løsning. På grunn av toksisitet og hudirritasjon ble ikke karbolvann lenger brukt snart etter oppdagelsen av andre desinfeksjonsmidler. Betegnelsen på (unge) sykepleiere som karbolmus er hentet fra denne bruken.
sikkerhetsinstruksjoner
Fenol er svært giftig både lokalt og systemisk; Når den utsettes for huden, har den irriterende for etsende effekter på slimhinner, hud og øyne. Øynene kan lide skade i form av uklarhet i hornhinnen , hevelse og sammenheng i øyelokkene opp til blindhet. Hudkontakt fører først til rødhet i huden, senere til hvit misfarging; lengre eksponeringstid fører til en mørkere opp til dannelsen av nekrose .
Fenol absorberes hovedsakelig gjennom huden, men innånding eller oral absorpsjon er også mulig. I den menneskelige organismen skader stoffet akutt nyrene, blodet, sentralnervesystemet og det kardiovaskulære systemet. Ved kronisk eksponering, gastrointestinale og nervesykdommer er ytterligere skade på lever, nyrer og hudforandringer kjent. Symptomer på rus etter innånding var svimmelhet, hodepine og øresykdommer, oppkast, søvnløshet og irritasjon av nyrene. Inntak av store mengder førte til massiv nyresvikt opp til akutt nyresvikt i løpet av få timer. Svelging forårsaker forbrenning i munnen, halsen, spiserøret og magen; svelgeforstyrrelser og forstyrrelser i mage-tarmkanalen er også kjent.
Toksisiteten tilskrives reaktive metabolitter av fenol, som binder seg til DNA og andre makromolekyler og kan forårsake brudd i kromosomene og mutagene effekter. En oral dose på 1 g eller mer kan av og til være dødelig for en person; individuelt overlevde imidlertid mye høyere doser. Den orale LD Lo- verdien for mennesker er mellom 140 og 1400 mg / kg kroppsvekt; Hos barn er den minste dødelige orale dosen 10 mg / kg kroppsvekt.
I 2015, ble fenol omfattet av EU i fellesskap pågående virkning plan ( CoRAP ) i henhold til forordning (EF) 1907/2006 (REACH) som en del av substans evaluering . Effektene av stoffet på menneskers helse og miljøet vurderes på nytt, og om nødvendig iverksettes oppfølgingstiltak. Fenolinntak ble forårsaket av bekymringer om forbrukerbruk , arbeidstakereksponering , høy (samlet) tonnasje, høy risiko karakteriseringsgrad (RCR) og andre farerelaterte bekymringer, samt potensiell risiko for mutagene egenskaper. Evalueringen har pågått siden 2015 og er utført av Danmark .
Historisk beskrivelse
"Karbolsyre (kulltjære kreosot, acidum fenylicum, acidum carbolicum). Et stoff som har blitt ekstremt viktig for malingindustrien og medisinen (som desinfeksjonsmiddel ). Handelsnavnet er fortsatt karbolsyre mens det vitenskapelige navnet nå er fenol; Selv om dette stoffet har egenskapene til en svak syre og er i stand til å kombinere med baser, kalles det derfor også fenylsyre eller feninsyre, men på samme tid og i enda større grad spiller det rollen som en alkohol, derav navnet fenylalkohol, som brukes i forkortet fenol. Karbolsyre er hovedsakelig oppnådd fra kulltjære og brunkull, tjære , tretjære bare inneholder meget små mengder av det, fordi kreosot av tretjære ikke består av fenol, som ble antatt for en stund, men av den strukturelt lignende kresol , så vel som noen andre stoffer. For å oppnå karbolsyre behandles den delen av tjære som går over mellom 150 og 200 ° C med kaustisk soda , som kombineres med karbolsyre og kresol, som også er inneholdt i kulltjære, skiller denne løsningen fra andre tjærkomponenter og nedbryter dem med en syre. Det oljeaktige produktet som har skilt seg ut destilleres deretter og det som passerer over 190 ° C samles spesielt opp. sistnevnte selges som rå kresol, det som går under 190 ° C som rå karbolsyre. Begge stoffene i denne tilstanden er fortsatt brune, veldig illeluktende, oljete væsker. Denne rå karbolsyren (acidum carbolicum crudum) er delvis renset, delvis den brukes til å bevare trevirke og desinfisere brønner . "
weblenker
Individuelle bevis
- ^ August Laurent: Om fenol (fenyloksydhydrat, fenylsyre). I: Tidsskrift for praktisk kjemi. 52, 1851, s. 279-282. doi: 10.1002 / prac.18510520125 .
- ↑ a b c d e f g h i j k l m Oppføring av fenol i GESTIS stoffdatabase til IFA , åpnet 8. januar 2018. (JavaScript kreves)
- ↑ a b c d Oppføring av fenol. I: Römpp Online . Georg Thieme Verlag, åpnet 9. juni 2013.
- ↑ CRC Handbook of Tables for Organic Compound Identification , Third Edition, 1984, ISBN 0-8493-0303-6 .
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-422.
- ↑ Entry på fenol i klassifisering og merking Opptelling av den europeiske kjemikaliebyrået (ECHA), åpnes den 1. februar, 2016. produsenter eller distributører kan utvide den harmoniserte klassifisering og merking .
- ↑ Swiss Accident Insurance Fund (Suva): Grenseverdier - nåværende MAK- og BAT-verdier (søk etter 108-95-2 eller fenol ), åpnet 2. november 2015.
- ↑ Grenseverdier for arbeidsmateriell ( Minne til originalen fra 23. september 2015 i Internettarkivet ) Info: Arkivkoblingen ble automatisk satt inn og ennå ikke sjekket. Kontroller originalen og arkivlenken i henhold til instruksjonene, og fjern deretter denne meldingen. , Forordning av forbundsministeren for arbeid, sosiale saker og forbrukerbeskyttelse (Grenseverdiforordningen GKV 2011), Østerrike.
- ↑ a b c W. B. Deichmann: Toxicology of Drugs and Chemicals. New York 1969, Academic Press, s. 463.
- ↑ a b R. Lefaux, OH Cleveland: Praktisk toksikologi av plast. Chemical Rubber Co., 1968, s. 329.
- ^ Henri A Favre, Warren H Powell: Nomenklatur for organisk kjemi: IUPAC-anbefalinger og foretrukne navn 2013 . Red.: The Royal Society of Chemistry. Cambridge 2014, ISBN 978-0-85404-182-4 , pp. 416, 668 .
- ^ Max Bloch, i Günther Bugge, The Book of Great Chemists , bind 2, Verlag Chemie, Berlin 1930, s. 92-114.
- ↑ Heinz Lüllmann, Klaus Mohr, Lutz Hein, Pharmakologie und Toxikologie , Georg Thieme, Stuttgart, 2010, s. 541 ( begrenset forhåndsvisning i Googles boksøk ).
- ^ SS-legene. ( Memento fra 4. mars 2016 i Internet Archive ) Nettsted for Mauthausen Memorial. Hentet 9. juli 2019.
- Hal Hans Halter: Morderne er fortsatt med oss. Nazi-leger - Fra dødshjelp. Rapport im Spiegel 25/1988, 20. juni 1988, s. 112-122.
- ↑ Karin Orth: Systemet til de nasjonalsosialistiske konsentrasjonsleirene. En politisk organisasjonshistorie. Hamburg 1999.
- ↑ Otto Mayrhofer : Tanker om anestesiens 150-årsdag. I: Anestesilegen. Volum 45, 1996, s. 881-883, her: s. 883.
- ↑ Joseph Zakzeski, Pieter CA Bruijnincx, Anna L. Jongerius & Bert M. Weckhuysen: The Catalytic valorization of lignin for the Production of Renewable Chemicals . I: Chemical Reviews . teip 110 , nr. 6 , 2010, s. 3565-3567 , doi : 10.1021 / cr900354u .
- ↑ Joy Esohe Omoriyekomwan, Arash Tahmasebi & Jianglong Yu: Produksjon av fenolrik bioolje under katalytisk fast seng og mikrobølgeovnpyrolyse av palmekjerneskall . I: Bioresource Technology . teip 207 , 2016, s. 188–196 , doi : 10.1016 / j.biortech.2016.02.002 .
- ↑ Dengle Duan, Hanwu Lei, Yunpu Wang, Roger Ruan, Yuhuan Liu, Lijun Ding, Yayun Zhang & Lang Liu: Fornybar fenolproduksjon fra lignin med syreforbehandling og ex-situ katalytisk pyrolyse . I: Journal of Cleaner Production . teip 231 , 2019, s. 331–340 , doi : 10.1016 / j.jclepro.2019.05.206 .
- ↑ Vinoth Kumar Ponnusamy, Dinh Duc Nguyen, Jeyaprakash Dharmaraja, Sutha Shobana, Rajesh Banu, Rijuta Ganesh Saratale, Soon Woong Chang og Gopalakrishnan Kumar: En gjennomgang av ligninstruktur, forbehandling, gjæringsreaksjoner og bioraffineringspotensial . I: Bioresource Technology . teip 271 , 2019, s. 462–472 , doi : 10.1016 / j.biortech.2018.09.070 .
- ^ Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie , 18. utgave, Harri Deutsch, Frankfurt (Main), 2001.
- ↑ Hans-Dieter Jakubke, Ruth Karcher (red.): Lexicon of Chemistry , Spectrum Academic Publishing House, Heidelberg, 2001.
- ^ Arnold Willmes, Taschenbuch Chemical Substances , Harri Deutsch, Frankfurt (M.), 2007, s.583.
- ↑ SA Lawrence: Aminer: syntese, egenskaper og bruksområder , Cambridge University Press, 2004, ISBN 978-0-521-78284-5 , s 80..
- ↑ Hans-Jürgen Arpe , Klaus Weissermel : Industriell organisk kjemi: viktige for- og mellomprodukter. 6. utgave, Wiley-VCH, 2007, ISBN 978-3-527-31540-6 , s. 418.
- ↑ Rullende fellesskapshandlingsplan ( CoRAP ) fra European Chemicals Agency (ECHA): Fenol , tilgjengelig 26. mars 2019.
- ↑ Cresol er metylfenol.
- ↑ karbolsyre . I: Mercks Warenlexikon . 3. utg. 1884 ff., S. 250 f.







![{\ mathrm {C_ {6} H_ {5} OH \ + \ NH_ {3} \ {\ xrightarrow [{Cat.}] {250 ^ {{\ circ}} C}} \ C_ {6} H_ {5 } NH_ {2} \ + \ H_ {2} O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee2fee96963f62879e3117c093e3eb5dca2a51fe)