aceton
| Strukturell formel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Generell | |||||||||||||||||||
| Etternavn | aceton | ||||||||||||||||||
| andre navn | |||||||||||||||||||
| Molekylær formel | C 3 H 6 O | ||||||||||||||||||
| Kort beskrivelse |
fargeløs væske med en søt lukt |
||||||||||||||||||
| Eksterne identifikatorer / databaser | |||||||||||||||||||
| |||||||||||||||||||
| eiendommer | |||||||||||||||||||
| Molarmasse | 58,08 g mol −1 | ||||||||||||||||||
| Fysisk tilstand |
væske |
||||||||||||||||||
| tetthet |
0,79 g cm −3 (20 ° C) |
||||||||||||||||||
| Smeltepunkt |
−95 ° C |
||||||||||||||||||
| kokepunkt |
56 ° C |
||||||||||||||||||
| Damptrykk |
|
||||||||||||||||||
| løselighet |
blandbar med vann og mange organiske løsningsmidler |
||||||||||||||||||
| Dipole øyeblikk | |||||||||||||||||||
| Brytningsindeks |
1,3588 (20 ° C) |
||||||||||||||||||
| sikkerhetsinstruksjoner | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG / Sveits: 500 ml m −3 eller 1200 mg m −3 |
||||||||||||||||||
| Toksikologiske data | |||||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . Brytningsindeks: Na-D-linje , 20 ° C | |||||||||||||||||||
Aceton eller aceton [ at͡səˈtoːn ] er det vanlige navnet på den organisk-kjemiske forbindelsen propanon eller dimetylketon . Aceton er en fargeløs væske og brukes som et polært aprotisk løsningsmiddel og som utgangsmateriale for mange synteser innen organisk kjemi. Med sitt strukturelle trekk ved karbonylgruppen (> C = O), som bærer to metylgrupper , er det den enkleste ketonen .
Utvinning og presentasjon
Aceton ble først produsert i 1606 av Andreas Libavius ved oppvarming av bly (II) acetat . I 1661 var Robert Boyle i stand til å vinne den gjennom tørr destillasjon av tre. Det ble først beskrevet i 1610 i Tyrocinium Chymicum av Jean Beguin . Fram til midten av 1900-tallet var fermentering av aceton-butanol-etanol, oppdaget og patentert av Chaim Weizmann , også en viktig prosess for produksjon av aceton. Den anaerobe bakterien Clostridium acetobutylicum ble brukt til industriell produksjon .
Den viktigste produksjonsprosessen av aceton i dag er kumenhydroperoksydprosessen , som også er kjent som Hock- fenolsyntese :
Her blir benzen og propen først omdannet til isopropylbenzen ( kumen ) ved en Friedel-Crafts-alkylering i syre . Dette reagerer deretter med oksygen i en radikal reaksjon for å danne hydroperoksydet , som spaltes til fenol og aceton under sur prosessering .
En annen produksjonsprosess er dehydrogenering eller oxydehydrogenering av isopropanol .
En annen måte å produsere aceton på er å varme opp kalsiumacetat ( 1 ), der det brytes ned til aceton ( 2 ) og kalsiumoksid ("kalk salt destillasjon").
Denne prosessen går tilbake til den ovennevnte historiske syntesen av Libavius i 1606.
eiendommer
Aceton er en fargeløs væske med lav viskositet med en karakteristisk, lett søt lukt, svært brannfarlig og danner en eksplosiv blanding med luft. Kokepunktet ved normalt trykk er 56 ° C. Det er blandbart i alle proporsjoner med vann og de fleste organiske løsningsmidler. Acetonmolekylet viser keto-enol tautomerisme ; dens pK s- verdi er 20. aceton kan være på grunn av dens polære karbonylgruppe, hvor kationer også danner komplekse forbindelser.
Forbindelsen danner azeotrope blandinger med et antall andre løsningsmidler . De azeotropiske sammensetningene og kokepunktene finner du i følgende tabell. Ingen azeotroper dannes med vann , etanol , 1-propanol , 2-propanol , n-butanol , benzen , toluen , etylbenzen , dietyleter , etylacetat og acetonitril .
| Azeotrope med forskjellige løsningsmidler | ||||||||||||
| løsemiddel | n- pentan | n- heksan | n- heptan | Sykloheksan | Metanol | kloroform | Karbontetraklorid | Diisopropyleter | Metylacetat | |||
| Innhold av aceton | i% | 21 | 59 | 90 | 67 | 88 | 22 | 89 | 61 | 50 | ||
| kokepunkt | i ° C | 32 | 50 | 56 | 53 | 55 | 64 | 56 | 54 | 55 | ||
Termodynamiske egenskaper
I følge Antoine er damptrykksfunksjonen resultatet av log 10 (P) = A− (B / (T + C)) (P i bar, T i K) med A = 4.42448, B = 1312.253 og C = −32.445 in temperaturområdet fra 259,2 til 507,6 K.
| eiendom | Type | Verdi [enhet] | Merknader |
|---|---|---|---|
| Standard formasjonens entalpi | Δ f H 0 væske Δ f H 0 gass |
−249,4 kJ mol −1 −218,5 kJ mol −1 |
som en væske som en gass |
| Forbrenningens entalpi | Δ c H 0 gass | −1821,4 kJ mol −1 | |
| Varmekapasitet | c s | 125,45 J mol −1 K −1 (25 ° C) 2,16 J g −1 K −1 (25 ° C) 75,02 J mol −1 K −1 (25 ° C) 1,29 J g −1 K −1 (25 ° C) |
som en væske som en gass |
| Kritisk temperatur | T c | 508.15K | |
| Kritisk press | p c | 47,582 bar | |
| Kritisk tetthet | ρ c | 4,63 mol·l −1 | |
| Sentrisk faktor | ω c | 0,30653 | |
| Enthalpy of fusion | Δ f H | 5,72 kJ mol −1 | ved smeltepunktet |
| Enthalpi av fordampning | Δ V H | 29,1 kJ mol −1 | ved normalt trykkkokepunkt |
Temperaturavhengigheten til entalpi av fordampning kan beregnes i henhold til ligningen Δ V H 0 = A e (−βT r ) (1 - T r ) β (Δ V H 0 i kJ / mol, T r = (T / T c ) redusert temperatur) med A = 46,95 kJ / mol, β = 0,2826 og T c = 508,2 K i temperaturområdet mellom 298 K og 363 K. Den spesifikke varmekapasiteten kan beregnes i temperaturområdet mellom 5 ° C og 50 ° C via en lineær funksjon med c p = 1.337 + 2.7752 · 10 −3 · T (med c p i kJ · kg −1 · K −1 og T i K) kan estimeres.
Damptrykk -Funksjon av aceton
Temperaturavhengighet av fordampningsvarmen til aceton
Spesifikk varmekapasitet for aceton
Sikkerhetsrelaterte parametere
Aceton danner svært brannfarlige damp-luft-blandinger. Forbindelsen har et flammepunkt under -20 ° C. Den eksplosjonsområdet er mellom 2,5 volum% (60 g / m³) som den nedre eksplosjonsgrense (LEL) og 14,3 volum% (345 g / m³) som den øvre eksplosjonsgrense (UEL). En korrelasjon av eksplosjonsgrensene med damptrykkfunksjonen resulterer i et nedre eksplosjonspunkt på -23 ° C og et øvre eksplosjonspunkt på 8 ° C. Eksplosjonsgrensene er trykkavhengige. En reduksjon i trykk fører til en reduksjon i eksplosjonsområdet. Den nedre eksplosjonsgrensen endres bare litt opp til et trykk på 100 mbar og øker bare ved trykk under 100 mbar. Den øvre eksplosjonsgrensen synker analogt med synkende trykk.
| Eksplosjonsgrenser under redusert trykk (målt ved 100 ° C) | ||||||||||||
| skrive ut | i mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 |
| Nedre eksplosjonsgrense (LEL) | i volum% | 2.2 | 2.2 | 2.3 | 2.3 | 2.4 | 2.4 | 2.5 | 2.6 | 2.7 | 3.6 | 5.0 |
| i g m −3 | 53 | 53 | 53 | 55 | 57 | 58 | 59 | 61 | 63 | 86 | 119 | |
| Øvre eksplosjonsgrense (UEL) | i volum% | 14.3 | 14.0 | 13.7 | 13.4 | 13.2 | 13.1 | 13.1 | 13.1 | 12.5 | 10.3 | 9.0 |
| i g m −3 | 345 | 338 | 331 | 324 | 319 | 316 | 316 | 316 | 302 | 249 | 217 | |
| Maksimalt eksplosjonstrykk under redusert trykk | ||||||||||||
| skrive ut | i mbar | 1013 | 800 | 600 | 400 | 300 | 200 | 100 | ||||
| Maksimalt eksplosjonstrykk (i bar) | ved 20 ° C | 9.3 | 7.5 | 5.5 | 3.6 | 2.7 | 1.8 | 0,8 | ||||
| ved 100 ° C | 7.4 | 4.5 | ||||||||||
Maksimalt eksplosjonstrykk er 9,7 bar. Når temperaturen stiger og utløpetrykket faller, faller det maksimale eksplosjonstrykket. Den grense spaltebredde ble bestemt til å være 1,04 mm (50 ° C). Dette resulterer i en oppgave til eksplosjonsgruppe IIA. Damp-luft-blandinger er ekstremt antennelige med en minimum tenningsenergi på 1,15 mJ. Den antennelsestemperaturen er 535 ° C. Stoffet faller derfor i temperaturklasse T1. Et kraftig fall i antennelsestemperaturen observeres under økt trykk. Den elektriske ledningsevnen er ganske lav ved 4,9 · 10 −7 S · m −1 .
| Antennelsestemperaturer under økt trykk | ||||||||||||
| skrive ut | kontant | 1 | 2 | 4. plass | 6.8 | 16.5 | ||||||
| Antennelsestemperatur | i ° C | 535 | 345 | 290 | 265 | 250 | ||||||
Reaksjoner (valg)
Jodering av aceton
Som en spesiell reaksjon er her jodering av aceton som et klassisk eksempel på en reaksjonskinetikk kalt pseudo-null rekkefølge. Siden bare enolformen kan jodiseres, men aceton er nesten 100% keton, kan 2-propenolkonsentrasjonen under reaksjonen betraktes som konstant. Dens C = C dobbeltbinding reagerer med jod ved å dele av et jodidion for å danne en mesomerisk kation, som deretter overfører en proton til et jodidion.
Etableringen av keto-enol-likevekten er syre (og også base) katalysert. Jodineringen akselereres derfor sterkt av det resulterende hydrogenjodidet ( autokatalyse ).
Jodform reaksjon
Når du legger til base, finner imidlertid jodformreaksjonen sted:
Dannelse av dibenzalaceton
Aceton reagerer i nærvær av benzaldehyd i en alkalisk løsning for å danne dibenzalaceton . Reaksjonen skjer i henhold til den generelle mekanismen for aldolkondensasjon .
Også benzalanilin syntetiseres - det reagerer anilin med at-in alkalisk løsning aceton eliminering av vann til Schiff base ( azometin ). Både dibenzalaceton og benzalanilin er verdifulle stoffer fordi de har veldig reaktive dobbeltbindinger som kan angripes av nukleofiler .
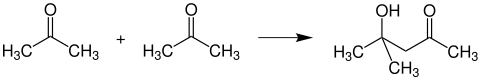
Dannelse av diacetonalkohol
Hvis to acetonemolekyler får dimere seg på en aldollignende måte under påvirkning av basiske reagenser, dannes diacetonalkohol :
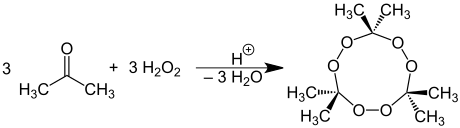
Dannelse av acetonperoksid
Aceton reagerer med hydrogenperoksid for å danne detonasjonsutsatt acetonperoksid :
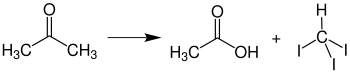
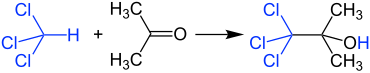
Reaksjon med kloroform
Aceton og kloroform må ikke blandes i høyere konsentrasjoner fordi en veldig voldsom reaksjon oppstår i nærvær av spor av alkaliske stoffer, og produserer 1,1,1-triklor-2-metyl-2-propanol . Av denne grunn bør også klorert og ikke-klorert løsningsmiddelavfall samles separat i laboratoriet.
bruk
Aceton er utgangsmaterialet for mange synteser i kjemisk industri. Det brukes hovedsakelig til produksjon av polymetylmetakrylat (PMMA), kjent som akrylglass eller plexiglass. For dette formål blir aceton først omdannet til acetoncyanohydrin ved å tilsette hydrocyansyre , som lett splitter av vann i et surt medium ( mesomer stabilisering av dobbeltbindingen på grunn av konjugasjon til trippelbindingen til nitrilgruppen). Det resulterende 2-metylpropenenitril omdannes til metylmetakrylat ved tilsetning av en blanding av konsentrert svovelsyre og metanol , som blir polymerisert til akrylglass i et ytterligere trinn.
Aceton brukes industrielt som en forløper for produksjon av diacetonalkohol ved aldoltilsetning og dermed indirekte som en forløper for mesityloksid og metylisobutylketon .

Aceton brukes også i små mengder som et nyttig løsemiddel for harpiks , fett og oljer, kolofonium , celluloseacetat, samt neglelakkfjerner og plastlim. Det brukes også til å fjerne forurensning forårsaket av konstruksjonsskum , for eksempel når du rengjør PU-skumkanoner. Den oppløses mange ganger volumet i etyn (acetylen).
I noen land tilsettes aceton i små proporsjoner (1: 2000 - 1: 5000) til bensin eller diesel for å oppnå en mer fullstendig forbrenning av drivstoffet.
Ved fotokjemisk produksjon av kretskort brukes aceton til den endelige avfettingen av kretskortet før lodding.
Acetonholdige løsninger brukes i tannbehandling for å rengjøre forberedte tannflater og rotkanaler .
biokjemi
Aceton er et ketonlegeme dannet i leveren som ikke kan metaboliseres i nevneverdig grad. Det frigjøres derfor gjennom lungene eller i unntakstilfeller gjennom urinen ( acetonuri , et symptom på diabetes mellitus ). Andre ketonlegemer er aceteddiksyre og 3-hydroksybutansyre . Disse kan behandles i stoffskiftet og er involvert i tilførsel av energi til musklene.
toksikologi
Aceton forårsaker tørrhet på huden ettersom den avfetter huden. Derfor bør du smøre de berørte områdene etter kontakt. Innånding av større doser forårsaker bronkial irritasjon, tretthet og hodepine. Svært høye doser har en narkotisk effekt .
Hexadeuteroacetone
Deuterert aceton (empirisk formel: C 3 D 6 O), også kalt aceton-d 6 , blir brukt som et oppløsningsmiddel i kjernemagnetisk resonansspektroskopi (NMR).
De fysiske egenskapene er litt forskjellige fra den ikke-deutererte forbindelsen:
- Smeltepunkt: -93,8 ° C
- Kokepunkt: 55,5 ° C
- Tetthet: 0,872 g / ml (25 ° C)
- Brytningsindeks: 1,355 (20 ° C)
weblenker
- Oppføring for aceton i databasen for forbrukerproduktinformasjon
Individuelle bevis
- ↑ Oppføring av ACETONE i CosIng-databasen til EU-kommisjonen, åpnet 16. februar 2020.
- ↑ a b c d e f g h i j k l m n o Oppføring av aceton i GESTIS stoffdatabase til IFA , åpnet 1. februar 2016. (JavaScript kreves)
- ↑ Peter B. Fleming, Robert E. McCarley: Kjemi til Polynuclear metallhalogenider. IV. Elektronisk spektra av noe niob og tantal M 6 X 12 n + klyngederivater . I: Uorganisk kjemi . teip 9 , nr. 6. juni 1970, s. 1347-1354 , doi : 10.1021 / ic50088a011 .
- Try Oppføring av aceton. I: Römpp Online . Georg Thieme Verlag, åpnet 10. november 2014.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Dipole Moments, s. 9-52.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-4.
- ↑ Oppføring av aceton i klassifiserings- og merkelisten til European Chemicals Agency (ECHA), tilgjengelig 1. februar 2016. Produsenter eller distributører kan utvide den harmoniserte klassifiseringen og merkingen .
- ↑ Swiss Accident Insurance Fund (Suva): Grenseverdier - nåværende MAK- og BAT-verdier (søk etter 67-64-1 eller aceton ), åpnet 2. november 2015.
- ↑ chemgapedia.de , læringsenhet acetonsyntese .
- ↑ a b I. M. Smallwood: Håndbok om organiske løsemiddelegenskaper. Arnold, London 1996, ISBN 0-340-64578-4 , s. 27-29.
- ↑ D. Ambrose, CHS Sprake, R. Townsend: termodynamiske egenskaper Organic oksygenforbindelser. XXXIII. Damptrykket av aceton. I: J. Chem. Thermodyn. 6, 1974, s. 693-700, doi: 10.1016 / 0021-9614 (74) 90119-0 .
- ↑ a b K. B. Wiberg, LS Crocker, KM Morgan: Thermochemical Studies of Carbonyl Compounds. 5. Entalpier for reduksjon av karbonylgrupper. I: J. Am. Chem. Soc. 113, 1991, s. 3447-3450, doi: 10.1021 / ja00009a033 .
- ^ CB Miles, H. Hunt: Heats of forbrenning. I. Varmen til forbrenning av aceton. I: J. Phys. Chem. 45, 1941, s. 1346-1359; doi: 10.1021 / j150414a002 .
- ↑ a b c R. Malhotra, LA Woolf: Termodynamiske egenskaper til propanon (aceton) ved temperaturer fra 278 K til 323 K og trykk opp til 400 MPa. I: J. Chem. Thermodyn. 23, 1991, s. 867-876, doi: 10.1016 / S0021-9614 (05) 80282-4 .
- ↑ a b J. Chao: Termodynamiske egenskaper til viktige organiske oksygenforbindelser i karbonområdet C 1 til C 4 . Del 2. Ideelle gassegenskaper. I: J. Phys. Kjem.Ref.data . 15, 1986, s. 1369-1436, doi: 10.1063 / 1.555769 .
- ↑ a b c A. N. Campbell, RM Chatterjee: De kritiske konstanter og ortobare tettheter av aceton, kloroformbenzen og karbontetraklorid . I: Canadian Journal of Chemistry . 47, 1969, s. 3893-3898, doi : 10.1139 / v69-646 .
- ↑ J. Schmidt: Design av sikkerhetsventiler for flerbrukssystemer i henhold til ISO 4126-10. I: Chem. Ing. Techn. 83, 2011, s. 796-812, doi: 10.1002 / cite.201000202 .
- ↑ KK Kelley: Varmekapasiteten til isopropylalkohol og aceton fra 16 til 298 ° K og de tilsvarende entropiene og frie energiene. I: J. Am. Chem. Soc. 51, 1929, s. 1145-1150, doi: 10.1021 / ja01379a022 .
- ^ A b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, s. 300.
- ↑ a b c d e E. Brandes, W. Möller: Sikkerhetsrelaterte parametere. Volum 1: Brennbare væsker og gasser. Wirtschaftsverlag NW - Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ a b c d D. Pawel, E. Brandes: Sluttrapport om forskningsprosjektet, avhengigheten av sikkerhetsrelaterte parametere til trykket under atmosfæretrykket. ( Memento fra 2. desember 2013 i Internet Archive ), Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 1998.
- ↑ JB Fenn: Lean Antennbarhetsgrense og Minimum gnisttennende energi. Kommersielle væsker og rene hydrokarboner. I: Ind. Eng. Chem. 43, 1951, s. 2865-2869; doi: 10.1021 / ie50504a057 .
- ↑ HF Calcote, CA Gregory, CM Barnett, RB Gilmer: Spark Ignition - Effect of Molecular Structure. I: Ind. Eng. Chem. 44, 1952, s. 2656-2662; doi: 10.1021 / ie50515a048 .
- ↑ Teknisk regel for farlige stoffer TRGS 727, BG RCI brosjyre T033 Unngåelse av antennelsesfare på grunn av elektrostatiske ladninger , status august 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6 .
- ^ FA Carey, RJ Sundberg: Organisk kjemi. Wiley-VCH Verlag, 2004, ISBN 3-527-29217-9 .
- ↑ Lutz Roth, Ursula Weller: Farlige kjemiske reaksjoner , ISBN 3-609-73090-0 , ecomed security; 2005.
- ↑ Eksterne identifikatorer eller databasekoblinger for Deuterated Acetone : CAS-nummer:666-52-4 , EC-nummer: 211-563-9, ECHA- infokort: 100.010.514 , PubChem : 522220 , ChemSpider : 455535 , Wikidata : Q1032873 .
- ↑ Acetone-d6 datablad fra Sigma-Aldrich , åpnet 31. august 2019 ( PDF ).
- ↑ Sammenlignet med 0,791 g / ml (25 ° C) for den ikke-deutererte forbindelsen. Aceton -datablad fra Sigma-Aldrich , åpnet 31. august 2019 ( PDF ).