Karboksylsyrer
| Karboksylsyrer |
|---|
|
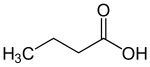
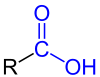
| Generell struktur for monokarboksylsyrene med karboksyfunksjonen merket med blått . Radikalet R representerer enten et hydrogenatom eller en organylgruppe . |
Karboksylsyrer , også kalt karboksyl -syrer , er organiske forbindelser som bærer en eller flere karboksygrupper (-COOH) og således har en mer eller mindre utpreget sur karakter. De salter av karboksylsyrer er kalt karboksylater . Forbindelser hvor OH-gruppen i karboksygruppen er erstattet av en annen gruppe, f.eks. B. -OR, -NH 2 eller -Cl erstattes, karboksylsyrederivater blir kalt. De tre nevnte eksemplene tilhører også karboksylsyrederivatene : karboksylsyreestere , karboksylsyreamider og karboksylsyrehalogenider .
nomenklatur
For den systematiske navngivningen av karboksylsyrene på tysk, legges ordet komponent "syre" til navnet på den grunnleggende strukturen. Mange karboksylsyrer har også usystematiske navn (vanlige navn ), som også ender med "syre". Eksempler på navn på karboksylsyrer med den basiske strukturen til et alkan er metansyre (maursyre), etansyre (eddiksyre) og butansyre (smørsyre). Det vanlige navnet identifiserer den respektive karboksylsyren hovedsakelig i henhold til en typisk forekomst.
Klassifisering
Det skilles mellom alifatiske , aromatiske og heterosykliske karboksylsyrer basert på den kjemiske strukturen til R- gruppen som –COOH-gruppen er knyttet til . De alifatiske karboksylsyrene kan videre deles inn i alkansyrer , alkensyrer og alkynoinsyrene syrer. Alkansyrer kalles også mettede karboksylsyrer . Alkenonsyrer, det vil si karboksylsyrer med minst en dobbeltbinding i resten (f.eks. Akrylsyre ) og alkynosyrer med minst en trippelbinding i resten, blir derimot referert til som umettede karboksylsyrer .
Videre kan karboksylsyrer differensieres i henhold til antall karboksygrupper de inneholder. Monokarboksylsyrer har en karboksygruppe, mens dikarboksylsyrer (f.eks. Oksalsyre ) inneholder to og trikarboksylsyrer (f.eks. Sitronsyre ) inneholder tre karboksygrupper.
Det er også grupper av karboksylsyrer som bærer andre funksjonelle grupper i tillegg til karboksygruppen, slik som ketokarboksylsyrene , hydroksykarboksylsyrene (f.eks. Melkesyre ) og aminosyrene (faktisk: aminokarboksylsyrer ).
Fra synspunktet til den kjemiske strukturen er de såkalte fettsyrene ikke en spesiell gruppe karboksylsyrer, fordi de for det meste er uforgrenede, alifatiske, mettede eller umettede monokarbonsyrer, ofte med 12 til 22, noen ganger, som i smør , selv med bare 4 karbonatomer. Der blir de forestret med glyserin som såkalte triglyserider i animalsk og vegetabilsk fett (se f.eks. Melkefett ). Nyere funn har vist at kortkjedede og forgrenede karboksylsyrer også forekommer i fettlipidene i cellemembraner, slik at i dag kan alle karboksylsyrer med (kjedelignende) organylgrupper oppsummeres under betegnelsen fettsyre .
En annen gruppe karboksylsyrer identifisert i henhold til deres forekomst er harpikssyrene , som forekommer i naturlige harpikser .
Fra et kjemisk struktursynspunkt hører ikke de såkalte metallkarboksylsyrene til gruppen karboksylsyrer. Dette er navnet gitt til metallkomplekser med karboksygrupper ligander som oppstår som mellomprodukter ved ( katalyserte ) reaksjoner med karbonmonoksyd (CO), og karbondioksyd (CO 2 ), for eksempel i vann-gass-skiftreaksjonen .
Eksempler
| alifatiske, mettede monokarboksylsyrer |
eddiksyre |
Smørsyre (en fettsyre ) |
||
| alifatiske, umettede monokarboksylsyrer |
Akrylsyre |
Oljesyre (en fettsyre ) |
||
| alifatiske, mettede dikarboksylsyrer |
Oksalsyre | Ravsyre | ||
| alifatiske, mettede trikarboksylsyrer |
Sitronsyre | Agarinsyre | ||
| alifatiske, umettede dikarboksylsyrer |
Fumarsyre | Maleinsyre | ||
| aromatiske karboksylsyrer |
Bensoesyre | Salisylsyre | ||
| heterosykliske karboksylsyrer |
Nikotinsyre |
Pyrrolidin-2-karboksylsyre (en aminosyre ) |
||
| alifatiske, umettede, sykliske monokarboksylsyrer |
Abietinsyre (en harpiks syre ) |
Gibberellinsyre |
eiendommer
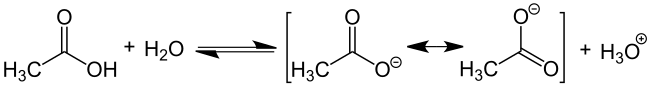
De kjemiske egenskapene til karboksylsyrer uten ytterligere funksjonelle grupper i alkylkjeden bestemmes utelukkende av karboksylgruppen. Oksygenatomet i karbonylgruppen (C = O) har en relativt sterk elektronuttrekkende effekt, slik at bindingen mellom hydrogen og oksygenatomet i hydroksylgruppen er sterkt polarisert. Dette fremmer frigjøring av H + -ioner fra karboksygruppen, vist her ved bruk av eddiksyre:
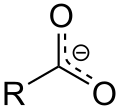
I tillegg er den sure karakteren av karboksylsyrene en konsekvens av den mesomere stabiliseringen av karboksylatanionet. Det favoriserer den deprotonerte formen av karboksylsyren og dermed stabiliteten til anionet. I likhet med mesomeric stabilisering av benzen , er den delokaliserte elektron ofte angis med følgende notasjon (i eksempelet, R står for metylgruppen CH 3 ).
De fysiske egenskapene til karboksylsyrer (syrefasthet, kokepunkt eller smeltepunkt, løselighet i vann) bestemmes i det vesentlige av typen alkylkjede og eventuelle substituenter som er tilstede i alkylgruppen.
Den surhet av en karboksylsyre, er mer uttalt jo kortere alkylkjeden. En ekstra substituent på alfa-karbonatomet med en elektronuttrekkende induktiv effekt (-I-effekt) øker syrestyrken betraktelig. En mer positiv partiell ladning tilsettes karboksygruppen , noe som bedre kan balansere anionens negative ladning og dermed stabilisere anionet. Et eksempel på dette er det mer stabile trikloracetatet sammenlignet med acetat . Et mål på syrestyrken til en karboksylsyre er syredissosiasjonskonstanten eller pK s- verdien
Kortkjedede karboksylsyrer med opptil seks karbonatomer er fargeløse, skarpe ( maursyre ) eller ubehagelige ( smørsyre ) luktende væsker med relativt høye kokepunkter. På grunn av karboksygruppen har karboksylsyrer en polær karakter, noe som resulterer i god løselighet i vann, som avtar med økende lengde på alkylkjeden. Brønnen mulige romlige anordning av to karboksygrupper favoriserer dannelsen av intermolekylære hydrogenbindinger og således fører til karboksylsyren dimer . Den doble massen av partiklene i damprommet over væsken kan forklare de relativt høye kokepunktene til karboksylsyrer.
Med økende kjedelengde øker den lipofile karakteren til karboksylsyrer og den hydrofile karakteren avtar. Dette gjelder også saltene av karboksylsyrene. I tillegg til den lipofile alkylkjeden, med muligens mer enn seks karbonatomer, har saltene også en hydrofil gruppe i det samme molekylet med karboksylatgruppen. De natrium- og kaliumsalter av de langkjedede karboksylsyrer er således amfifile stoffer. De har egenskapene til overflateaktive stoffer og brukes som ostemasse såper og myke såper .
Produksjon
Oksidasjoner
Karboksylsyrer kan bare produseres fra alkaner eller fra aromatiske hydrokarboner substituert med alkylgrupper ved oksidasjonsreaksjoner med sterke oksidasjonsmidler hvis det ikke er andre oksiderbare funksjonelle grupper i molekylet som også kan oksideres, slik som f.eks. B. hydroksyl- eller aminogrupper eller CC-dobbeltbindinger, mellomtrinn av fullstendig oksydasjon av alkylgrupper er alkoholer og aldehyder , som derfor også kan brukes som utgangsstoffer for oksidasjonsreaksjoner. Kjente egnede oksidasjonsmidler er oksygen , eller til og med ozon , kaliumpermanganat , kromtrioksyd , salpetersyre eller kaliumdikromat .
- Oksidasjon av alkaner: En prosess som ble brukt industrielt i Tyskland fra 1930 og utover var den såkalte parafinoksidasjonen . Blandinger av lengrekjedede alkaner med atmosfærisk oksygen og permanganater ved 120 ° C ble brukt. behandlet. Oksidativ spaltning av alkankjedene resulterte i blandinger av forskjellige karboksylsyrer som måtte skilles fra hverandre. Alkoholer og aldehyder ble produsert som biprodukter. Følgende tilknyttede reaksjonsligning og alle følgende reaksjonsligninger for oksidasjonsreaksjoner er forenklet skjematisk.
- Oksidasjon av alkylerte aromater :
- Oksidasjon av olefiner med basisk kaliumpermanganat. Under nøytrale betingelser er reaksjonen fører til vicinale dioler bare .
Reaksjoner med forlengelse av alkylkjeden
- Reaksjon av Grignard-forbindelser , tidligere dannet av haloalkaner , med karbondioksid . Den påfølgende tilsetning av vann fører til fri karboksylsyre. (Reaksjonsligning oppsummerer begge trinn skjematisk).
- Hvis det er funksjonelle grupper i alkylkjeden som forhindrer produksjonen av en Grignard-forbindelse, kreves en omkjøring
- kan velges via Kolbe-nitrilsyntesen og påfølgende hydrolyse av nitrilen. (Reaksjonsligning viser begge trinn oppsummert bare skjematisk)
Hydrolyse av karboksylsyrederivater
- Hydrolysen av såkalte reaktive karboksylsyrederivater, f.eks. B. karboksylsyreklorider eller karboksylsyreanhydrider gir ingen mening, siden de reaktive karboksylsyrederivatene alltid må være laget av karboksylsyrer for å kunne produsere andre karboksylsyrederivater av dem . Denne hydrolysereaksjonen er derfor en stort sett uønsket sidereaksjon som må unngås når man bruker reaktive karboksylsyrederivater.
- ,
- Alkalisk hydrolyse (" forsæbning ") eller syrekatalysert hydrolyse av karboksylsyreestere :
- Den sure eller basiske hydrolysen av karboksamider må finne sted under sterke forhold på grunn av stabiliteten til karboksamidene.
- Den sure eller basiske hydrolysen av nitriler må også finne sted under energiske forhold på grunn av nitrilenes stabilitet.
Andre spesielle reaksjoner
- Kolbe-Schmitt-reaksjon : for syntese av hydroksybenzosyrer (f.eks. Salisylsyre ) fra fenater og karbondioksid
- Koch-reaksjon ( hydroformylering ): forgrenede alkener blir høyt forgrenede karboksylsyrer gjennom tilsetning av karbonmonoksid til α-karbonatomet
Spektroskopi av karboksylsyrer
De viktigste analysemetodene for å bestemme strukturen til karboksylsyrer er IR- og NMR-spektroskopi .
I IR-spekteret er C = O strekkingsvibrasjon på rundt 1710–1760 cm −1 og den brede OH- strekkvibrasjon rundt 3000 cm −1 karakteristiske.
I den 1 H-NMR-spektrum , blir de sure hydroksylgrupper protoner forskjøvet til en usedvanlig lav felt, 10-13 ppm. Protonene til alkylgruppene på karbonyl-C har en kjemisk forskyvning i området ca. 2,0-2,5 ppm; myresyrehydrogenatomet bundet direkte til karbonylgruppen vises ved 8,08 ppm. I en karbonkjede av en ikke-konjugert karboksylsyre forskyves toppene som er lenger borte fra karbonylfunksjonen i mindre grad til det dype feltet fordi påvirkningen av karbonylgruppens induktive effekt avtar.
I den 13 C-NMR-spekteret , blir karboksygruppen karbonatomet som finnes i området fra ca. 170 til 180 ppm.
Viktige reaksjoner
På grunn av de to oksygenatomene ved siden av karbonatomet i karboksygruppen, som har en elektronuttrekkende effekt, kan nukleofile angrep på karbonatomet i karboksygruppen finne sted. Det nukleofile angrepet kan fremmes ved syrekatalyse (protonering av karbonylgruppen) hvis de angripende nukleofilene ikke er sterke Brønsted-baser , f.eks. B. Alkoholer. Når nukleofilene er baser, f.eks. B. ammoniakk eller aminer de protoneres og svekkes av syrekatalysen. Selv uten syrekatalyse protoneres slike nukleofiler av selve karboksylsyren og blir ineffektive. Samtidig dannes også de tilsvarende saltene av karboksylsyren, som ikke lenger kan angripes av nukleofiler.
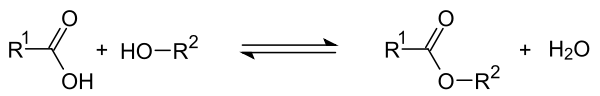
Forestring
Ved syrekatalysert forestring reagerer karboksylgruppen i en organisk syre med hydroksylgruppen i en alkohol. En ester dannes når vannet deles av . I løpet av reaksjonen setter en omvendt reaksjon inn, fordi karboksygruppen i den resulterende esteren også kan bli nukleofilt angrepet av det resulterende vannet. Etter at alkoholen er delt av, dannes den opprinnelige syren tilbake. Hvis R1 er resten av syren og R2 er resten av alkoholen, oppstår følgende likevektsreaksjon i løpet av reaksjonen :
Stillingen av likevekt kan påvirkes. Hvis den dannede esteren har et lavere kokepunkt enn syren, kan det oppnås ved kontinuerlig destillasjon. Tilsetningen av faste tørkemidler , som kan binde vann, gjør at esterformasjonen fortsetter mer fullstendig.
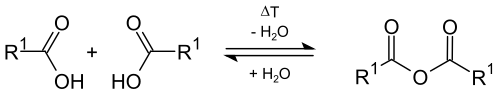
Dehydrering
I teorien kan karboksylsyrer lett omdannes til organiske karboksylsyreanhydrider med intermolekylær eliminering av vann ( dehydrering ) ved høyere temperaturer . I laboratoriepraksisen er denne reaksjonen sjelden vellykket, fordi intramolekylær dehydrering også kan forekomme ved høye temperaturer, med ketener som dannes.
Et alternativ til dannelsen av karboksylsyreanhydrider fra karboksylsyrer er tilsetning av sterkt dehydratiserende stoffer ( fosforpentoksid ) eller andre reaksjoner, slik som reaksjonen av karboksylsyrehalogenider med saltene av karboksylsyrer, eller reaksjonen av ketener med karboksylsyrer .
Karboksylsyreanhydrider kan reagere tilbake på de tilsvarende karboksylsyrene med vann.
weblenker
Individuelle bevis
- ↑ karboksylsyre på Duden.de, tilgjengelig 15. januar 2016
- ↑ karboksylsyre på Duden.de, tilgjengelig 15. januar 2016
- ↑ a b Brockhaus ABC kjemi. VEB F. A. Brockhaus Verlag, Leipzig 1965, s. 645-646.
- ↑ G. Wietzel: Produksjon av syntetiske fettsyrer ved oksidasjon av parafiniske hydrokarboner med molekylært oksygen. I: Kjemisk ingeniørvitenskap. 3, 1954, s. 17-IN4, doi : 10.1016 / S0009-2509 (54) 80003-0 .