enzym

Et enzym , tidligere kjent som gjæring , er et stoff som består av gigantiske biologiske molekyler og som fungerer som en katalysator for å akselerere en kjemisk reaksjon. De fleste enzymer er proteiner , med unntak av katalytisk aktivt RNA ( ribozym ), som f.eks. B. snRNA eller (naturlig ikke forekommende, kunstig produsert) katalytisk aktivt DNA (deoksyribozym). Som med andre proteiner, dannes de i cellen via proteinbiosyntese på ribosomene . Enzymer har viktige funksjoner i metabolismen av organismer : De kontrollerer de fleste biokjemiske reaksjoner - fra fordøyelse til transkripsjon ( RNA-polymerase ) og replikasjon ( DNA-polymerase ) av genetisk informasjon .
Opprinnelsen til ordet og historien til enzymforskning
Mennesker har brukt enzymer som gjær og bakterier i flere tusen år ; så det er kjent at sumererne så tidlig som 3000 f.Kr. Brygger øl , baker brød og lager ost . For bruk av øl eller bakegjær , som mos eller i gjærdeig , og prosessene for gjæring initiert med den , ble begrepet "gjæring" opprettet uten å vite eksistensen av bakterier (eller mikrobielle gjær) og deres effekt gjennom enzymer.
Ordene gjæring og gjæring fant veien inn i det tyske språket på 1400-tallet, de går tilbake til det latinske ordet fermentum . Columella brukte også dette uttrykket rundt 60 e.Kr. for å løsne og hovne opp i jorden, mens Seneca brukte det omtrent samtidig i Epistulae for å beskrive en gjæringsprosess som han anså som nødvendig for dannelsen av honning . Med denne betydningen som "gjæringsmiddel" eller " surdeig ", ble ordet gjæring lånt fra latin , og gjæring , gjæring og gjæring avledet fra det.
De første gjæringsprosessene ble beskrevet av Paracelsus og Andreas Libavius . De første forsøkene på å forklare dette kom fra Johann Baptist van Helmont og Georg Ernst Stahl . Etter at René Réaumur hadde undersøkt fordøyelsen av fugler i 1752 og funnet ut at rovfugler ikke har svimmel som hugger opp korn, men heller skiller ut væske i magen, var Lazzaro Spallanzani i stand til å bevise i 1783 at deres magesaft alene er tilstrekkelig til å flytende kjøtt . Dette tilbakeviste teorien om en rent mekanisk fordøyelsesprosess .
Den første direkte bruken av enzymer uten involvering av mikroorganismer ble gjort av den tyske farmasøyten Constantin Kirchhoff i 1811, da han oppdaget at større mengder sukker kan produseres ved oppvarming av stivelse med tilsetning av svovelsyre . Den franske kjemikeren Anselme Payen foredlet prosessen i 1833; siden det på den tiden ble antatt at sukkeret bare var skilt fra stivelsen, ble denne prosessen kalt "diastase" (gresk for separat); i dag brukes begrepet "diastase" synonymt med amylase . Dette ble etterfulgt av oppdagelsen av Erhard Friedrich Leuchs i 1831 om at menneskelig spytt tilsynelatende sukker stivelse. I 1833 brukte Eilhard Mitscherlich begrepet "gjæring" i forbindelse med et stoff som ikke transformeres under en reaksjon, men som er nødvendig for at en reaksjon skal komme i kontakt. I 1835 mistenkte den svenske kjemikeren Jöns Jakob Berzelius at diastase var en kjemisk prosess med virkningen av katalytiske krefter.
I 1837 oppdaget de tre forskerne Charles Cagniard de la Tour , Theodor Schwann og Friedrich Traugott Kützing uavhengig av hverandre at gjær består av mikroorganismer. Louis Pasteur demonstrerte i 1862 at mikroorganismer er ansvarlige for gjæring; Han konkluderte med at gjæringen foregår gjennom en vital kraft som er tilstede i formcellen, som han kalte "fermenter", som ikke mister sin effektivitet med formcellens død.
I 1878 Wilhelm Friedrich Kühne introduserte dagens neoklassisk oppdiktede ord enzym ( gamle greske ἔνζυμον énzymon ), avledet fra ἐν- en- , “i-”, og ζύμη Zyme , som også betyr “surdeig” eller “ gjær ”, så forstanden er der "Det som finnes i surdeig / gjær" (nemlig stoffet som utløser eller påvirker gjæring ). Dette begrepet fant deretter veien inn i internasjonal vitenskap og er nå også en del av det moderne greske språket .
Kühne differensierte begrepet enzymer , som brukes til å beskrive biokatalysatorer som er effektive utenfor levende celler, fra gjæringer som, etter Pasteurs mening, bare kunne utvikle effekten i levende celler.
En annen milepæl er studiene på enzymspesifisiteten til Emil Fischer, og han postulerte i 1890 at enzymer og substrat som en lås og nøkkel matchende oppførsel. I 1897 oppdaget Eduard Buchner på grunnlag av alkoholgjæring at enzymer også kan ha en katalytisk effekt uten den levende cellen; I 1907 mottok han Nobelprisen for å demonstrere cellefri gjæring. I 1903 klarte Eduard Buchner og Jakob Meisenheimer å drepe mikroorganismer som utløste gjæring av melkesyre og eddiksyre uten å påvirke deres enzymvirkning. Den tyske kjemikeren Otto Röhm isolerte enzymer for første gang i 1908 og utviklet prosesser for enzymatisk lærgarvning , fruktjuicerensing og en rekke diagnostiske bruksområder.
På begynnelsen av 1900-tallet var den kjemiske sammensetningen av enzymer fremdeles ukjent. Det ble antydet at enzymer består av protein og at deres enzymatiske aktivitet er assosiert med deres struktur. Imidlertid hevdet andre forskere som Richard Willstätter at proteiner bare er bærere av de "virkelige enzymene", og at de ikke er i stand til å sette i gang en katalytisk reaksjon alene. James B. Sumner viste i 1926 at enzymet urease er et rent protein og var i stand til å krystallisere det. Den siste tvilen om sammensetningen av enzymer ble fjernet av John H. Northop og Wendell M. Stanley da de i 1930 demonstrerte at pepsin , trypsin og chymotrypsin består av rent protein. Northrop og Stanley mottok Nobelprisen i kjemi for dette i 1946.
Kunnskapen om hvordan man krystalliserer enzymer har nå tillatt forskerne å bruke krystallstrukturanalyse for å avklare strukturen og funksjonen til enzymer på atomnivå. I årene 1930 til 1939 ble krystallstrukturene til elleve andre enzymer avslørt. Den første aminosyresekvensen som ble fullstendig dechiffrert av et enzym er ribonukleasen . Dette trinnet ble oppnådd av Stanford Moore og William Howard Stein . I 1969 syntetiserte Robert Bruce Merrifield deretter hele sekvensen av ribonukleasen ved hjelp av teknikken oppkalt etter ham ( Merrifield-syntese ). Samtidig klarte også RG Denkewalter og R. Hirschmann å gjøre dette .
På 1980-tallet ble katalytiske antistoffer av Richard Lerner oppdaget at en enzymaktivitet hadde en gang mot overgangstilstanden modellert på molekylær immunisert var. Linus Pauling hadde allerede mistenkt i 1948 at enzymer binder molekyler som ligner overgangstilstanden spesielt godt. På slutten av 1980-tallet ble det oppdaget at RNA også kan utvikle katalytisk (enzymatisk) aktivitet i organismen ( ribozym ). I 1994 ble det første deoksyribozymet, GR-5 , utviklet.
Forskere som Leonor Michaelis og Maud Menten var banebrytende for studiet av enzymkinetikk med formuleringen av Michaelis-Menten-teorien .
Nomenklatur og klassifisering i henhold til IUPAC og IUBMB
nomenklatur
Den IUPAC og IUBMB har sluttet en såkalt nomenklatur utviklet enzymer som disse homogene og tallrike inneholdende gruppe av representanter molekyler klassifisert . For dette formålet utviklet IUPAC prinsipper for nomenklatur:
- Enzymnavn har utvidelsen (eller suffikset ) "-ase" når det aktuelle enzymet kjemiske eller organiske forbindelser separerer eller deler seg (for eksempel " hydrol ase n " eller " Prote ase n ") eller neuverbindet (slik som " oxide ase n "eller" Telomer ase ").
- Enzymnavnet er ment å være forklarende, dvs. å beskrive reaksjonen som enzymet katalyserer. (Eksempel: kolinesterase : Et enzym som det estergruppen i kolin -molekylet hydrolyseres ).
- Enzymnavnet skal inneholde klassifiseringen (se nedenfor). (Eksempel: kolinesterase )
I tillegg ble det utviklet et kodesystem, EC- tallsystemet, der enzymene er klassifisert under en numerisk kode som består av fire tall. Det første tallet indikerer en av de syv enzymklassene. Lister over alle oppdagede enzymer sikrer at den angitte enzymkoden kan bli funnet raskere, f.eks. B. på BRENDA . Selv om kodene er basert på egenskapene til reaksjonen som enzymet katalyserer, viser det seg i praksis at tallkoder er uhåndterlige. Systematiske navn basert på reglene ovenfor brukes oftere. Problemer med nomenklaturen oppstår for eksempel med enzymer som katalyserer flere reaksjoner. Derfor er det noen ganger flere navn på dem. Noen enzymer har trivielle navn som ikke indikerer at stoffet som er nevnt er et enzym. Siden navnene tradisjonelt ble brukt mye, ble de delvis beholdt (eksempler: fordøyelsesenzymer trypsin og pepsin hos mennesker).
klassifisering
Enzymer er delt inn i syv enzymklasser i henhold til reaksjonen de katalyserer:
- EC 1: Oxidoreductases som katalyserer redoksreaksjoner .
- EC 2: Transferaser som overfører funksjonelle grupper fra ett substrat til et annet.
- EC 3: hydrolaser som spalter bindinger ved bruk av vann .
- EC 4: Lyaser som katalyserer spalting eller syntese av mer komplekse produkter fra enkle substrater, men uten forbruk av adenosintrifosfat (ATP) eller annet nukleosidtrifosfat (NTP).
- EC 5: isomeraser som akselererer omdannelsen av kjemiske isomerer .
- EC 6: Ligaser eller syntetaser som katalyserer addisjonsreaksjoner ved hjelp av ATP (eller annen NTP). En omvendt reaksjon (splitting) er vanligvis energisk ugunstig og finner ikke sted.
- EC 7: Translokaser , transport av stoffer til eller gjennom cellemembraner.
Noen enzymer er i stand til å katalysere flere, noen ganger veldig forskjellige, reaksjoner. Hvis dette er tilfelle, blir de tildelt flere enzymklasser.
konstruksjon
Enzymer kan differensieres ut fra deres struktur. Mens mange enzymer bare består av en polypeptidkjede , såkalte monomerer , består andre enzymer, oligomerene , av flere underenheter / proteinkjeder. Noen enzymer kombineres med andre enzymer for å danne såkalte multi- enzymkomplekser og samarbeide eller regulere hverandre. Motsatt er det også individuelle proteinkjeder som kan utøve flere forskjellige enzymaktiviteter ( multifunksjonelle enzymer ). En annen mulig klassifisering med hensyn til deres struktur tar hensyn til tilstedeværelsen av medfaktorer :
- Rene proteinenzymer består utelukkende av proteiner. Det aktive senteret dannes bare fra aminosyrerester og peptidrygraden. Denne gruppen inkluderer for eksempel fordøyelsesenzymet chymotrypsin og triose fosfatisomerase (TIM) av glykolyse .
- Holoenzymer ( gammel Gr . Ὅλος holos "hel", "komplett" og enzym) består av en proteinkomponent, apoenzymet , og en kofaktor, et molekyl med lav molekylvekt (uten protein). Begge deler er viktige for enzymets funksjon. Organiske molekyler som medfaktorer kalles koenzymer . Hvis de er kovalent bundet til apoenzymet, kalles de protetiske grupper , ellers kalles de også kosubstrat , siden de reageres med substratet i ekvivalente mengder under den enzymatiske reaksjonen. Eksempler på kosubstrater er adenosintrifosfat (ATP) og nikotinamidadenindinukleotid (NAD). ATP brukes ofte som en energikilde for proteinkinaser å reagere . NAD brukes som elektronakseptor av enzymer som alkoholdehydrogenase . Krever et enzym metallioner ( jern -, sink - eller kobber- ioner), snakker man om en metalloenzyme . Den lipoxygenase , for eksempel jern og carbonsyreanhydrase inneholder sink.
Protein-RNA-kompleksene eller protein-ribozym-kompleksene danner en spesiell gruppe, eksempler på hvilke er telomeraser . De ribosomer er også slike komplekser.
funksjon
Enzymer er biokatalysatorer . De akselererer biokjemiske reaksjoner ved å redusere aktiveringsenergien som må overvinnes for at et stoff skal konverteres. Dette øker reaksjonshastigheten (se overgangstilstandsteori ). Teoretisk er en enzymatisk omdannelse reversibel, dvs. Dette betyr at produktene kan konverteres tilbake til utgangsmaterialene. Utgangsmaterialene (utgangsmaterialene) til en enzymreaksjon, substratene , er bundet i det såkalte aktive sentrum av enzymet, det dannes et enzym-substratkompleks . Enzymet gjør det nå mulig å omdanne substratene til reaksjonsproduktene som deretter frigjøres fra komplekset. Som alle katalysatorer er enzymet tilbake i sin opprinnelige form etter reaksjonen. Enzymer er preget av høy substrat- og reaksjonspesifisitet ; fra mange stoffer velger de bare de aktuelle substratene og katalyserer nøyaktig en av mange tenkelige reaksjoner.
Energiske grunnlag for katalyse
De fleste biokjemiske reaksjoner ville bare finne sted i ubetydelig hastighet uten enzymer i levende ting. Som med enhver spontan reaksjon, må reaksjonens frie entalpi ( ) være negativ. Enzymet fremskynder etableringen av den kjemiske likevekten - uten å endre det. Et enzyms katalytiske effektivitet er utelukkende basert på dets evne til å senke aktiveringsenergien i en kjemisk reaksjon : dette er mengden energi som først må investeres for å sette reaksjonen i gang. Under dette blir underlaget stadig mer endret, det vedtar en energisk ugunstig overgangstilstand . Aktiveringsenergien er nå mengden energi som kreves for å tvinge substratet til overgangstilstanden. Det er her den katalytiske effekten av enzymet kommer inn: gjennom ikke-kovalente interaksjoner med overgangstilstanden stabiliserer den det slik at det kreves mindre energi for å bringe substratet til overgangstilstanden. Substratet kan konverteres til reaksjonsproduktet mye raskere, ettersom en måte er "banet" for det, for å si det sånn.
Det aktive senteret - strukturelt grunnlag for katalyse og spesifisitet
Det aktive senteret (katalytisk senter) er ansvarlig for et enzyms katalytiske effektivitet . På dette tidspunktet binder det substratet og blir deretter "aktivt" konvertert. Det aktive senteret består av brettede deler av polypeptidkjeden eller reaktive ikke-proteindeler (kofaktorer, protesegrupper) av enzymmolekylet og forårsaker en spesifisitet av den enzymatiske katalysen. Denne spesifisiteten er basert på komplementariteten til den romlige strukturen og de mulige overfladiske interaksjonene mellom enzym og substrat. Det dannes et enzym-substratkompleks .
Den romlige strukturen til det aktive senteret betyr at bare et strukturelt egnet substrat kan bindes. Illustrativt passer et bestemt substrat til det tilsvarende enzymet som en nøkkel i riktig lås ( nøkkelås-prinsipp ). Dette er årsaken til enzymers høye substratspesifisitet . I tillegg til lås- og nøkkel modell, er den ikke-stive induced fit modell : Siden enzymer er fleksible strukturer, kan det aktive senteret omformes gjennom interaksjon med substratet.
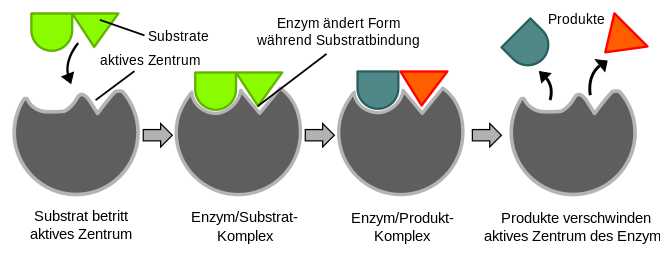
Selv små strukturelle forskjeller i den romlige strukturen eller ladningsfordelingen av enzymet kan bety at et stoff som ligner på substratet ikke lenger gjenkjennes som et substrat. Glukokinase, for eksempel, aksepterer glukose som et substrat, men dets stereoisomer, galaktose , gjør det ikke. Enzymer kan ha forskjellige substratspesifikasjoner, slik at alkoholdehydrogenaser bryter ned andre alkoholer i tillegg til etanol, og heksokinase IV aksepterer ikke bare glukose, men også andre heksoser som substrater.
Substratet er gjenkjent og bundet av ikke-kovalente interaksjoner ( hydrogenbindinger , elektrostatiske interaksjoner eller hydrofobe effekter ) mellom deler av enzymet og substratet. Bindingen av enzymet må være sterk nok til å binde det ofte dårlig konsentrerte substratet (mikro- til millimolære konsentrasjoner), men det må ikke være for sterkt, siden reaksjonen ikke ender med bindingen av substratet. Det som er viktig er et enda sterkere bånd mellom reaksjonens overgangstilstand og stabilisering. Det er ikke uvanlig at to substrater deltar i en reaksjon; enzymet må da garantere riktig orientering av reaksjonspartnerne til hverandre. Disse sistnevnte mekanistiske særegenheter ved en enzymatisk reaksjon er grunnlaget for spesifisiteten til et enzyms virkning . Det katalyserer alltid bare en av mange mulige reaksjoner av substratene. Aktiviteten til enzymer er delvis regulert av pseudoenzymer (varianter av enzymer uten enzymaktivitet).
Katalytiske mekanismer
Selv om de detaljerte mekanismene for enzymatiske reaksjoner er varierte, bruker enzymer vanligvis en eller flere av de følgende katalytiske mekanismene.
- Foretrukket binding av overgangstilstanden
- Bindingen av overgangstilstanden er sterkere enn bindingen av substratene og produktene, noe som resulterer i en stabilisering av overgangstilstanden.
- Orientering og tilnærming av underlag
- Bindingen av to substrater i riktig orientering og konformasjon kan øke reaksjonshastigheten betydelig, siden de reaktive gruppene i molekylene kommer i riktig posisjon til hverandre og konformasjonene av molekylene som er gunstige for reaksjonen er stabilisert.
- Generell syrebasekatalyse
- Aminosyrerester, for eksempel fra histidin, reagerer som syre eller base ved å ta opp eller frigjøre protoner ( H + -ioner ) under en reaksjon .
- Kovalent katalyse
- Aminosyrerester eller koenzymer danner kovalente bindinger med et substrat og danner et kortvarig mellomprodukt . Vanligvis er nukleofile aminosyresidekjeder (for eksempel lysinsidekjeder med aminogruppe ) eller koenzymer som pyridoksalfosfat involvert i slike reaksjoner .
- Metallionkatalyse
- Metallioner kan støtte katalyse som strukturstabiliserende sentraler , redoks partnere (ofte jern eller kobber -ioner) eller som Lewis-syrer (ofte sink- ioner). De kan stabilisere eller skjerme negative ladninger eller aktivere vannmolekyler.
Enzymkinetikk
Enzymkinetikk håndterer løpet av enzymatiske reaksjoner over tid. Reaksjonshastigheten er en nøkkelfaktor her . Det er et mål på endringen i substratkonsentrasjonen over tid, dvs. for mengden substrat som omdannes i et bestemt reaksjonsvolum per tidsenhet (enhet: mol / (l · s)). I tillegg til reaksjonsbetingelsene som temperatur , saltkonsentrasjon og pH-verdi av løsningen, avhenger det av konsentrasjonene av enzymet, substratene og produktene samt effektorer (aktivatorer eller inhibitorer).
Enzymaktiviteten er relatert til reaksjonshastigheten. Det indikerer hvor mye aktivt enzym det er i et enzympreparat. Enhetene med enzymaktivitet er enhet (U) og katal (kat), hvor 1 U er definert som mengden enzym som omdanner en mikromol substrat per minutt under de angitte forhold: 1 U = 1 μmol / min. Katal brukes sjelden, men er SI-enheten med enzymaktivitet: 1 kat = 1 mol / s. Et annet viktig mål for enzymer er den spesifikke aktiviteten (aktivitet per masseenhet, U / mg). Dette viser hvor mye av det totale proteinet i løsningen egentlig er enzymet du leter etter.
Den målte enzymaktiviteten er proporsjonal med reaksjonshastigheten og er derfor sterkt avhengig av reaksjonsbetingelsene. Den øker med temperaturen i samsvar med RGT-regelen : en økning i temperaturen med ca. 5–10 ° C fører til en dobling av reaksjonshastigheten og dermed også aktiviteten. Dette gjelder imidlertid bare et begrenset temperaturområde. Når en optimal temperatur overskrides, er det et bratt fall i aktivitet på grunn av denaturering av enzymet. Endringer i pH i løsningen har ofte dramatiske effekter på enzymaktiviteten, da dette kan påvirke ladningen av individuelle aminosyrer i enzymet som er viktige for katalyse. Utover den optimale pH-verdien, reduseres enzymaktiviteten og stopper på et eller annet tidspunkt. Det samme gjelder saltkonsentrasjonen eller ionestyrken i miljøet.
Michaelis-Menten teori
En modell for den kinetiske beskrivelsen av enkle enzymreaksjoner er Michaelis-Menten-teorien (MM-teorien). Det gir et forhold mellom reaksjonshastigheten v for en enzymreaksjon og enzym- og substratkonsentrasjonen [E 0 ] og [S] . Grunnlaget er antagelsen om at et enzym danner et enzym-substratkompleks med et substratmolekyl, og dette brytes enten ned til enzym og produkt eller til dets startkomponenter. Hva som skjer raskere, avhenger av den respektive hastighetskonstanten k .
Modellen sier at jo høyere substratkonsentrasjon, jo høyere er reaksjonshastigheten. Dette skjer lineært i begynnelsen og flater deretter ut til en ytterligere økning i substratkonsentrasjonen ikke lenger har noen innflytelse på enzymets hastighet, siden det allerede fungerer med maksimal hastighet V max . MM-ligningen er som følger:
Parametrene K m ( Michaelis konstant ) og k cat ( omsetningsnummer ) er egnet til å karakterisere enzymer kinetisk, dvs. Det vil si å komme med uttalelser om deres katalytiske effektivitet . Hvis K m er meget lavt, for eksempel, betyr dette at enzymet når sin maksimale hastighet, selv ved en lav substratkonsentrasjon og således virker meget effektivt. Ved lave substratkonsentrasjoner, spesifisiteten konstanten k cat / K er m et mer passende mål på den katalytiske effektivitet. Hvis den når verdier på mer enn 108 til 109 M −1 s −1 , er reaksjonshastigheten bare begrenset av diffusjonen av substratet og enzymmolekylene. Enhver tilfeldig kontakt mellom enzymet og substratet fører til en reaksjon. Enzymer som oppnår dette effektivitetsnivået kalles "katalytisk perfekt".
Kooperativitet og allostery
Noen enzymer viser ikke den hyperbolske metningskurven som forutsagt av Michaelis-Menten-teorien, men snarere en sigmoid metning. En slik ting var først med bindingsproteiner som hemoglobin beskrevet og som positiv samarbeid tolket flere bindingssteder : bindingen av en ligand (substratmolekyl) påvirket flere bindingssteder i det samme enzymet (ofte men i andre underenheter ) i deres affinitet . I tilfelle av positiv kooperativitet har et bindingsprotein med mange frie bindingssteder en svakere affinitet enn et stort sett okkupert protein. Hvis den samme liganden binder seg til alle bindingssentre, snakker man om en homotrop effekt . I enzymer er kooperativitet nært knyttet til allostery . Med allostery menes tilstedeværelsen av andre bindingssteder (allosteriske sentre) i et enzym, bortsett fra det aktive sentrum. Hvis effektorer (ikke substratmolekyler) binder seg til allosteriske sentre, er det en heterotrop effekt . Allostery kan konseptuelt skilles fra kooperativitet, men de forekommer ofte sammen.
Multisubstratreaksjoner
De tidligere betraktningene gjelder bare for reaksjoner der et substrat blir omdannet til et produkt. Imidlertid katalyserer mange enzymer reaksjonen av to eller flere substrater eller co-substrater. Flere produkter kan også opprettes. Når det gjelder reversible reaksjoner, er skillet mellom substrat og produkt relativt uansett. Michaelis-Menten-teorien gjelder bare et av flere substrater hvis enzymet er mettet med de andre substratene.
Følgende mekanismer kan tenkes for reaksjoner med flere substrater:
- Sekvensiell mekanisme
- Substratene binder seg sekvensielt til enzymet. Hvis alle underlag er bundet, er det et sentralt kompleks . Det er her substratene blir omdannet til produkter, som deretter frigjøres fra komplekset etter hverandre. Det skilles mellom:
- Tilfeldig mekanisme (Engl. Random ): Rekkefølgen for substratbinding er tilfeldig.
- Overordnet mekanisme (engl. Ordered ): Bindingsrekkefølgen er fast.
- Ping pong mekanisme
- Bindingen av substratet og frigjøringen av produktet skjer vekselvis. Første substrat A binder seg til enzymet, og det første produktet P skilles av. Enzymet modifiseres i prosessen. Det andre substratet B blir deretter tatt opp og reagerer for å danne et andre produkt Q. Enzymet har sin opprinnelige form igjen.
Enzymehemming


Da enzyminhibering (inhibering) er definert som reduksjon i et enzyms katalytiske aktivitet av en spesifikk hemmer ( hemmer ). Et grunnleggende skille skilles mellom irreversibel inhibering , der en hemmer inngår en binding med enzymet som er irreversibel under fysiologiske forhold (som penicillin med D-alanintranspeptidase ), og reversibel inhibering , der enzyminhibitor-komplekset som har dannet er restaurert kan bryte ned i dens bestanddeler. Ved reversibel inhibering skilles det mellom
- konkurransedyktig hemming - substratet konkurrerer med hemmeren om binding til enzymets aktive sted. Imidlertid kan inhibitoren ikke omdannes enzymatisk og stopper dermed enzymarbeidet ved å blokkere det aktive senteret;
- allosterisk hemming (også ikke-konkurransedyktig hemming ) - hemmeren binder seg til det allosteriske sentrum og endrer dermed konformasjonen til det aktive senteret slik at substratet ikke lenger kan binde der
- ikke-konkurransedyktig hemming - hemmeren binder seg til enzym-substratkomplekset og forhindrer således katalytisk omdannelse av substratet til produktet.
- Sluttproduktinhibering - sluttproduktet av en serie enzymatiske omdannelser blokkerer enzym 1 og avslutter således omdannelsen av utgangssubstratet til produktet. Denne negative tilbakemeldingen begrenser produksjonen i noen metabolske prosesser.
Regulering og kontroll av enzymaktivitet i organismen
I den levende organismen jobber enzymer sammen i et komplekst nettverk av metabolske veier. For å være i stand til å tilpasse seg optimalt til svingende interne og eksterne forhold, er det nødvendig med en fin regulering og kontroll av stoffskiftet og de underliggende enzymene. Under regulering refererer det til prosesser som begge opprettholder stabile interne forhold under skiftende miljøforhold ( homeostase tjener). Som en kontroll er det referert til endringer som skjer på grunnlag av eksterne signaler (f.eks. Av hormoner). Det er raske / kortsiktige, middels og langsomme / langsiktige regulerings- og kontrollprosesser i stoffskiftet:
Kortsiktig justering
Raske endringer i enzymaktivitet oppstår som en direkte respons av enzymene på endrede konsentrasjoner av metabolske produkter som substrater, produkter eller effektorer (aktivatorer og hemmere). Enzymreaksjoner som er nær likevekt er følsomme for endringer i substrat- og produktkonsentrasjoner. Akkumulering av substrat akselererer foroverreaksjonen , akkumulering av produkt hemmer foroverreaksjonen og fremmer den omvendte reaksjon (konkurrerende produkt hemming) . Generelt tildeles imidlertid de irreversible enzymreaksjonene en større rolle i metabolsk regulering og kontroll.
Allosterisk modulering er av stor betydning . Substrat- eller effektormolekyler som oppstår i metabolismen binder seg til enzymets allosteriske sentre og endrer dets katalytiske aktivitet. Allosteriske enzymer består av flere underenheter (enten fra de samme eller fra forskjellige proteinmolekyler). Bindingen av substrat- eller inhibitormolekyler til en underenhet fører til konformasjonsendringer i hele enzymet, som endrer affiniteten til de andre bindingsstedene for substratet. En sluttproduktinhibering ( tilbakemeldingsinhibering ) oppstår når produktet opererer en kjede av reaksjoner på enzymet ved begynnelsen av denne kjeden allosterisk retardant. Dette oppretter automatisk en kontrollsløyfe .
Midlertidig justering
En vanlig form for metabolsk kontroll er kovalent modifisering av enzymer, spesielt fosforylering . Som med en molekylær bryter, kan enzymet slås på eller av for eksempel etter et hormonsignal av fosfatoverførende enzymer ( kinaser ). Innføring av en negativt ladet fosfatgruppe fører til strukturelle endringer i enzymet og kan i prinsippet favorisere både aktive og inaktive konformasjoner. Spaltingen av fosfatgruppen med fosfataser reverserer denne prosessen, slik at en fleksibel tilpasning av stoffskiftet til endrede fysiologiske krav er mulig.
Langsiktig justering
Som en langsiktig reaksjon på endrede metabolske krav, er enzymer spesifikt nedbrutt eller nydannet. Den dannelsen av nye enzymer som er kontrollert av ekspresjonen av deres gener. En slik type genetisk regulering i bakterier beskriver operonmodellen av Jacob og Monod . Den kontrollerte nedbrytningen av enzymer i eukaryote celler kan realiseres ved ubiquitinering . Festingen av polyubikvitinkjeder til enzymer, katalysert av spesifikke ubikvitinligaser, markerer dem for nedbrytning i proteasomet , en "søppelrenn" av cellen.
Biologisk betydning
Enzymer har høy biologisk betydning, de spiller den sentrale rollen i metabolismen til alle levende organismer. Nesten hver biokjemiske reaksjon er forårsaket og kontrollert av enzymer. Velkjente eksempler er glykolyse og sitratsyklus , respirasjonskjede og fotosyntese , transkripsjon og translasjon og DNA-replikasjon . Enzymer fungerer ikke bare som katalysatorer, de er også viktige regulerings- og kontrollpunkter i den metabolske prosessen.
Betydningen av enzymene er ikke begrenset til metabolismen, de er også viktige for absorpsjon og overføring av stimuli. Ved signaltransduksjon , dvs. utveksling av informasjon i en celle reseptorer er ofte involvert i enzymatisk funksjon. Også kinaser som tyrosinkinaser og fosfataser spiller en avgjørende rolle i overføring av signaler. Aktivering og deaktivering av bærerne av informasjonen, dvs. hormonene , utføres av enzymer.
Videre er enzymer involvert i forsvaret av sin egen organisme, for eksempel er forskjellige enzymer som serinproteasene i komplementsystemet en del av menneskets uspesifikke immunsystem .
Defekter i enzymer kan få fatale konsekvenser. Som et resultat av slike enzymdefekter reduseres aktiviteten til et enzym eller er ikke lenger tilgjengelig. Noen enzymdefekter arves genetisk; Det vil si at genet som koder for aminosyresekvensen til det tilsvarende enzymet inneholder en eller flere mutasjoner eller er helt fraværende. Eksempler på arvelige enzymdefekter er fenylketonuri og galaktosemi .
Kunstige enzymer (for eksempel i brøddeig som ikke er denaturert under bakingen) bærer risikoen for allergi utløsende
Bruk og forekomst i hverdagen
Enzymer er verdifulle verktøy innen bioteknologi . Deres mulige bruksområder spenner fra osteproduksjon ( løpe ) til enzymatikk og genteknologi . For visse applikasjoner utvikler forskere i dag spesifikt kraftigere enzymer gjennom proteinteknikk . I tillegg ble det konstruert en ny form for katalytisk aktive proteiner, de katalytiske antistoffene , som ble kalt abzymer på grunn av deres likhet med enzymene . Også ribonukleinsyrer (RNA) kan være katalytisk aktive; disse kalles da ribozymer .
Enzymer trengs blant annet i industrien. Lipaser (enzymer som bryter ned fett), proteaser ( enzymer som bryter ned protein ) og amylaser ( enzymer som bryter ned stivelse ) tilsettes vaskemidler og oppvaskmidler for å øke rengjøringsytelsen, fordi disse enzymene bryter ned flekkene i klær eller rester på retter.
Enzymer brukes også til å lage noen medisiner og insektmiddel. I ysting opptrer løpe med, et enzym som stammer fra kalvemager.
Mange enzymer kan nå produseres ved hjelp av genetisk modifiserte mikroorganismer .
Enzymene i rå ananas , kiwifrukt og papaya hindrer kaker i å sette gelatin , en uønsket effekt når for eksempel en fruktkake som inneholder rå biter av disse fruktene skal dekkes med en fast kakegelatintopp. Fyllet forblir ikke mykt når du bruker hermetisert frukt ; disse pasteuriseres , hvorved de proteinnedbrytende enzymene deaktiveres.
Når du skaler frukt og grønnsaker, blir planteceller skadet og enzymer frigjøres som et resultat. Som et resultat kan det skrellede produktet ( godt synlig i epler og avokado ) bli brunt på grunn av den enzymatisk støttede reaksjonen av flavonoider eller andre følsomme ingredienser med atmosfærisk oksygen. Tilsetningen av sitronsaft fungerer som motgift. Askorbinsyren i sitronsaft forhindrer oksidasjon eller reduserer allerede oksyderte forbindelser (tilsetning av askorbinsyre som tilsetningsstoff ).
I de medisinske enzymene spiller en viktig rolle. Mange medikamenter blokkerer eller øker effekten av enzymer for å kurere en sykdom. Den mest fremtredende representanten for slike medikamenter er sannsynligvis acetylsalisylsyre , som hemmer enzymet cyklooksygenase og dermed blant annet har en smertelindrende effekt.
Enzymer i teknologi
Den følgende tabellen gir en oversikt over bruksområdene til enzymer. Se protein for hvordan du lager det .
| teknisk prosess | Enzymer | effekt |
|---|---|---|
| Stivelsesbehandling | α- amylase , glukoamylase | Stivelse hydrolyse |
| Vedtak | L- acylase | Produksjon av aminosyrer |
| vaskemiddel | Proteaser , lipaser | Hydrolyse av proteiner og fett |
| Osteproduksjon | Proteaser | Melking |
| Distillery produkter | α-amylase, glukoamylase | Forstivelse av stivelse |
| Bryggeriindustri | α-amylase, glukoamylase, proteaser | Moseprosess |
| Behandling av fruktjuice | Pektinaser , α-amylase | Hydrolyse av pektiner eller stivelse |
| Bakeriproduksjon | α-amylase, proteaser, pentosanase | delvis hydrolyse av mel og ingredienser fra deigen |
| Lærbehandling | Proteaser | Oppmykning, hårfjerning av skinn |
| Tekstilindustri | α-amylase | Stivelse hydrolyse, desizing |
Bruk av enzymer for resirkulering av plast
Enzymer brukes også til å resirkulere plast. Disse må være tilstrekkelig varmestabile, dvs. Det vil si at de må tåle temperaturer på rundt 70 grader. Det franske selskapet Carbios har funnet et enzym som bryter ned polyetylentereftalat (PET) til monomerene ( etylenglykol og tereftalsyre ). Flaskene må først reduseres i størrelse før oppvarming. På slutten av prosessen er det et plastgranulat som kan brukes til nye PET-produkter. Til tross for den relativt høye innsatsen, vurderes prosessen som verdt, ettersom kostnadene bare utgjør rundt 4% av kostnadene som er påløpt for produksjon av nye plastflasker fra råolje.
Betydningen av enzymer i medisinsk diagnostikk
De diagnostiske anvendelser enzymer for å oppdage sykdommer. I teststrimlene for diabetikere er det for eksempel et enzymsystem som, under påvirkning av blodsukker, produserer et stoff hvis innhold kan måles. Slik måles blodsukkernivået indirekte. Denne prosedyren kalles en "enzymatisk måling". Det brukes også i medisinske laboratorier for å bestemme glukose (blodsukker) eller alkohol. Enzymatiske målinger er relativt enkle og rimelige å bruke. Man gjør bruk av substratspesifisiteten til enzymer. Et enzym tilsettes kroppsvæsken som skal analyseres, som spesifikt kan konvertere substratet som skal måles. Fra mengden produserte reaksjonsprodukter er det mulig å lese av hvor mye av substratet som var tilstede i kroppsvæsken.
En rekke enzymer i humant blod kan også måles direkte basert på deres aktivitet. Noen av enzymene som sirkulerer i blodet kommer fra spesifikke organer. Det kan derfor trekkes konklusjoner om skade på visse organer basert på reduksjon eller økning i enzymaktiviteter i blodet. Betennelse i bukspyttkjertelen kan gjenkjennes av den sterkt økte aktiviteten av lipase og bukspyttkjertelamylase i blodet.
litteratur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 5. utgave. Spectrum Academic Publishing House, Heidelberg - Berlin 2003, ISBN 3-8274-1303-6 .
- David Fell: Forstå kontrollen over stoffskifte . Portland Press Ltd, London 1997, 2003, ISBN 1-85578-047-X .
- Alfred Schellenberger (red.): Enzymkatalyse. Introduksjon til kjemien, biokjemien og teknologien til enzymer . Gustav Fischer Verlag, Jena 1989, ISBN 3-540-18942-4 .
- Donald Voet, Judith G. Voet: Biokjemi. 3. Utgave. John Wiley & Sons Inc., London 2004, ISBN 0-471-39223-5 .
- Maria-Regina Kula: Enzymer i teknologi. Kjemi i vår tid , 14. år 1980, nr. 2, s. 61-70, doi: 10.1002 / ciuz.19800140205
- Brigitte Osterath, Nagaraj Rao, Stephan Lütz, Andreas Liese: Teknisk anvendelse av enzymer: hvitt tøy og grønn kjemi. Kjemi i vår tid 41 (4), s. 324-333 (2007), doi: 10.1002 / ciuz.200700412
- Otto Westphal , Theodor Wieland , Heinrich Huebschmann: livsregulator . Av hormoner, vitaminer, gjæringer og andre aktive ingredienser. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Research and Life. Volume 1), spesielt s. 57–64 ( History of Ferment Research ).
weblenker
- IUBMB - Liste og nomenklatur over enzymer
- BRENDA omfattende enzymdatabase
- ExploreEnz - Enzymdatabasen
- Enzymdatabase med søkemotor
- KEGG Metabolic Pathway Database (grafiske fremstillinger av de biokjemiske reaksjonene med tilhørende, systematisk identifiserte enzymer)
- Utvalg av enzymer tilsatt brøddeig
Individuelle bevis
- ↑ a b c d e f Wolf-Dieter Müller-Jahncke , Christoph Friedrich , Ulrich Meyer: Medisinsk historie . 2., revidert og utvidet utgave. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5 , s. 106 .
- ↑ a b Kluge Etymological Dictionary of the German Language, 24. utgave.
- ↑ Ordbok på in.gr, oppføring Enzym. Hentet 29. mai 2013.
- ↑ Wolf-Dieter Müller-Jahncke : Enzymer. I: Werner E. Gerabek , Bernhard D. Haage, Gundolf Keil , Wolfgang Wegner (red.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4 , s. 356 f., Her: s. 356.
- ^ Nobelprisen i kjemi 1946. I: nobelprize.org , åpnet 19. november 2016.
- ^ A. Tramontano, KD Janda, RA Lerner: Katalytiske antistoffer. I: Vitenskap. Volum 234, nummer 4783, desember 1986, s. 1566-1570. PMID 3787261 .
- ^ RA Lerner, SJ Benkovic, PG Schultz: I krysset mellom kjemi og immunologi: katalytiske antistoffer. I: Vitenskap. Volum 252, nummer 5006, mai 1991, s. 659-667. PMID 2024118 .
- ^ L. Pauling: Kjemisk prestasjon og håp for fremtiden. I: Amerikansk forsker. Volum 36, nummer 1, januar 1948, s. 51-58. PMID 18920436 .
- ↑ Ronald R. Breaker, Gerald F. Joyce: En DNA-enzym som spalter RNA . I: Chem Biol. Bind 1 , nei 4 , desember 1994, s. 223-229 , doi : 10.1016 / 1074-5521 (94) 90014-0 , PMID 9383394 .
- ↑ -ase - Duden , 2016
- ↑ JCBN / NC-IUB Newsletter 1984: Synthases and Ligases (engelsk).
- ^ Nomenklaturkomité for International Union of Biochemistry and Molecular Biology (NC-IUBMB) Enzymnomenklatur. Anbefalinger: EC 7. Translocases (engelsk)
- ↑ arkivert kopi ( minnesmerke av den opprinnelige datert 24 februar 2016 i Internet Archive ) Omtale: The arkivet koblingen ble automatisk satt inn og ennå ikke kontrollert. Vennligst sjekk originalen og arkivlenken i henhold til instruksjonene, og fjern deretter denne meldingen.
- ↑ Ulrich Weber (red.): Biologie Oberstufe Complete Volume , Cornelsen Verlag Berlin 2001, ISBN 3-464-04279-0 , s. 72.
- ↑ Funksjonelle enzymer (i brøddeig)
- ↑ Kunstige enzymer kan utløse allergier
- ↑ Robert Ebermann, Ibrahim Elmadfa: Lærebok om matkjemi og ernæring. 2. utgave. Springer-Verlag Wien New York, 2008 og 2011, ISBN 978-3-7091-0210-7 , s. 594, side online på Google Books .
- ↑ Kunstig enzym kan bryte ned plast. Deutschlandfunk Nova , åpnet 27. januar 2021 .
- ↑ Mutert enzym bryter ned plast på rekordtid. ingenieur.de, åpnet 27. januar 2021 .
- ↑ Mutert enzym bryter ned plast på få timer. t-online.de , åpnet 27. januar 2021 .
- ↑ Enzymet som spiser plast. Frankfurter Rundschau , åpnet 27. januar 2021 .






![v = {k_ {cat} [E_ {0}] [S_ {0}] \ over K_ {m} + [S_ {0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8440c752cf139697cc911054213ca1a2755207cb)
