Viruskonvolutt
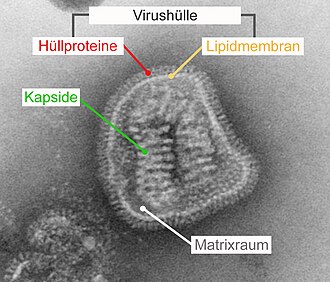
Den virale konvolutten ( engelsk viral envelope ) er i visse virus eksisterende ytre struktur av lipider av et fosfolipid dobbeltlag av den opprinnelige vertscellen og innlemmet i det eksisterer virale proteiner . Virushylsen lukker vanligvis et kapsid der den virale nukleinsyren er pakket. Avhengig av type virus, oppstår konvolutten fra cellemembranen på celleoverflaten eller fra membraner i det endoplasmatiske retikulum (ER) eller Golgi-apparatet inne i cellen.
Tilstedeværelsen av en viruskonvolutt er et viktig kriterium i klassifiseringen av virus, den såkalte virustaksonomien . De innhyllede virusene skiller seg fra de ikke-innhyllede eller "nakne" virusene. Mens ikke-innhyllede virus, må den infiserte cellen alltid forlate ved å ødelegge vertscelleinnhyllede virus uten slik lysis ved spirende ( engelsk spirende ) frigjøres. Virushylsteret er av stor betydning for opptak av virus i cellen, stabilitet mot miljøpåvirkninger og desinfeksjonsmidler, og den lette muligheten til å endre virusoverflaten. Denne variasjonen gjennom en viruskonvolutt er en evolusjonær fordel i forhold til ikke-innhyllede virus. Det gjør at innhyllede virus lettere kan undergrave verts immunforsvar eller tilpasse seg bedre til en ny vert. Disse egenskapene til viruskonvolutten blir tydelige, for eksempel fra det faktum at alle virus som dukker opp hos mennesker ( nye virus ) som representerer en reell eller potensiell trussel fra en pandemi, er innhyllede virus. B. HI-viruset , SARS coronavirus 1 og 2 , influensavirus , Ebola-virus og West Nile-virus .
oppdagelse
Begynnelsen av virologi og definisjonen av virus som en ny type smittsom patogen er knyttet til to ikke-innhyllede virus: tobakksmosaikkviruset ( Dmitri Iwanowski 1892 og Martinus Beijerinck 1898) og munn- og klovsykevirus ( Friedrich Loeffler og Paul Frosch 1897). Gulfeberviruset oppdaget av Walter Reed i 1901 var det første viruset som ble identifisert hos mennesker og samtidig det første omsluttede viruset som ble beskrevet. Imidlertid var disse undersøkelsene begrenset til overføringsveier, morfologien til virusene forble opprinnelig ukjent bortsett fra egenskapen til å være spesielt liten (usynlighet i lysmikroskopet ).
Denne barrieren med utilstrekkelig mikroskopisk oppløsning kunne bare overvinnes på 1930-tallet med utviklingen av elektronmikroskopet av Helmut og Ernst Ruska . Selv de første opptakene med denne nye teknologien viste omrissene av virus med langstrakt eller rund form. En differensiering av den fine strukturen til virusene og representasjon av viruskonvolutten var ennå ikke mulig med den tidlige kontrastfargingen. I 1943, etter å ha undersøkt de virusisolatene som var tilgjengelige på den tiden, foreslo Helmut Ruska en første klassifisering av virus i henhold til størrelse og form. Inntil da ble virusene klassifisert i henhold til den infiserte verten og den respektive sykdommen.
På 1950-tallet kunne virus også dyrkes spesifikt i cellekulturene utviklet av Renato Dulbecco og Harry Eagle og forplantet seg i store mengder. Renheten og konsentrasjonen av dette viruspreparatet gjorde det mulig å bestemme mer nøyaktig den kjemiske sammensetningen og dermed lipidinnholdet i virus. Inntil denne teknikken ble etablert, måtte man begrense seg til virusisolering fra infiserte verter eller til kulturen i inkuberte kyllingegg utviklet i 1932 og forbedret i 1946 for reproduksjon av virus . Noen virus mistet evnen til å infisere kyllingembryoene hvis virusoppløsningen ble behandlet med forskjellige stoffer, inkludert fettoppløsende forbindelser som eter ( dietyleter ) eller vaskemidler som natriumdeoksykolat . Denne såkalte "etersensitiviteten" av virus ble bare observert med noen virus som influensavirus eller herpesvirus , andre som poliovirus eller munn- og klovsykevirus var fortsatt smittsomme selv etter behandling med eter. Følsomheten for eter ble dermed et ytterligere viktig kriterium i klassifiseringen av virus og kunne på 1950-tallet allerede være assosiert med påvisning av lipider i rensede virus. Ether-sensitive virus hadde et lipidinnhold på 20-30%.

Man mistenkte allerede den gang at lipiddelen av viruset kunne være relatert til en membranstruktur. Eksistensen av lipidholdige biomembraner i celler kunne allerede bevises ved studier av Gorter og Grendel i 1925, og det var åpenbart å anta en lignende struktur i lipidholdige virus. Den avgjørende faktoren var beviset på at sammensetningen av lipidkomponentene i virusene var lik den i vertscellene der virusene ble dyrket. Den første indikasjonen på en viruskonvolutt i elektronmikroskopiske bilder kan spores i ettertid i en studie av Coriell i 1950. Han isolerte herpes simplex-virus fra forkjølelsessår. Han observerte en merkelig, rund form på viruset med en sentral fordypning, som han beskrev som " smultringlignende ". I dag kalles dette typiske utseendet til herpesvirusene "stekt eggform", dette betyr en icosahedral kapsid inne omgitt av en veldig tykk viruskonvolutt. Det var først i 1959, da en spesiell kontrastprosess med uransalter ble utviklet for elektronmikroskopi, at virusstrukturen ble mye mer differensiert, slik at virushylsteret også kunne bli synlig. Denne såkalte negative kontrastfarging er fremdeles den viktigste metoden for elektronmikroskopisk visualisering av virus.
Utforskningen av cellulære membraner på 1960- og 1970-tallet ble ledsaget av en utvidelse av vår forståelse av viruskonvolutten. Dette ble muliggjort av raffinerte teknikker for strukturell belysning av konvoluttproteinene som røntgendiffraksjon , frysefraktur SEM og NMR-spektroskopi , men også takket være nye betraktninger om egenskapene til biomembraner som den flytende mosaikkmodellen av Singer og Nicholson. De siste tjue årene har spesielt kryo-elektronmikroskopi gitt avgjørende innsikt i viruskonvoluttets fine struktur. Med denne teknikken er det mulig å bestemme formen og arrangementet til individuelle konvoluttproteiner og å vise viruskonvolutten med en oppløsning på 0,6-1 nm ved bruk av Fourier-assistert bildebehandling.
Strukturen på viruskonvolutten
En viruskappe består alltid av virale kappeproteiner som er innebygd i et fosfolipid dobbeltlag. Konvoluttproteinene avsettes i membranen under syntesen på ribosomene i det grove endoplasmatiske retikulumet (rER). Enten kan viruskonvolutten allerede dannes her fra membranen til rER, eller membranområdene okkupert med konvoluttproteiner blir transportert til cellemembranen, kjernemembranen eller Golgi-apparatet ved normal cellemembranstrøm. Fordi konvoluttproteinene konsentrerer seg og akkumuleres i mindre membranområder under beleggingsprosessen, fortrenges cellulære membranproteiner , som deretter ikke blir innlemmet i viruskonvolutten. På grunn av denne forskyvningen av cellulære membranproteiner, består ikke lipid-dobbeltlaget i virushylsteret av uendrede cellulære membraner, men bare av lipiddelen.
Andelen lagrede kappeproteiner er vanligvis så høy at lipidandelen ikke blir avdekket på noe punkt på overflaten. Lipidmembranen i virushylsen er derfor ikke lenger direkte tilgjengelig for antistoffer . I noen virus, slik som Hepadnaviridae , er proteininnholdet i virushylsteret så høyt at virushylsteret nesten utelukkende består av tettpakket kappeproteiner. Disse ordnes veldig regelmessig og er mer motstandsdyktige mot miljøpåvirkninger og vaskemidler enn andre innhyllede virus.
Lipidinnhold

Lipidmembranen i virushylsteret, som alle cellulære membraner, består av et dobbelt lag fosfolipider . Disse har et hydrofilt hode, som danner overflaten av membranen, og to innadrettede, lipofile hydrokarbonkjeder . Fosfolipidene som er involvert i strukturen til virushylsteret er fosfatidylkoliner (også kjent som lecitiner ), fosfatidyletanolaminer , fosfatidylseriner , fosfatidylinositol og sfingomyeliner . Sistnevnte er bare til stede i det ytre laget av fosfolipidmembranen. I tillegg til fosfolipidene er det også en variabel andel kolesterol . Cellemembranene, og dermed også virushylser, varierer i sammensetningen av de forskjellige fosfolipider og kolesterolinnholdet. Et høyt kolesterolinnhold er typisk for cellemembranen, mens membranene i det endoplasmatiske retikulumet og Golgi-apparatet inneholder bare en liten mengde kolesterol. Kolesterolinnholdet i en membran, uttrykt som C / P-kvotienten ( molært kolesterol / fosfolipidkvotient ), har en avgjørende innflytelse på morfologien til en membran, det samme er kolesterolrike membraner (dvs. med en typisk C / P-kvotient på 0,4 til 0,8) mer stabil, mindre fleksibel og, ved 5-6 nm, rundt en tredjedel tykkere enn lavt kolesterol. Siden lipidsammensetningen i en virushylse tilsvarer en første tilnærming til den opprinnelige cellemembranen, kan disse forskjellene også bli funnet mellom virushylser som stammer fra cellemembranen eller fra intracellulære membransystemer.
Ved nærmere undersøkelse avviker lipidsammensetningen til de fleste viruskonvolutter i liten grad fra den opprinnelige membranen. Hvordan denne selektive absorpsjonen av lipidkomponenter i virushylsteret foregår, er fortsatt uklart. Det antas en foretrukket inkorporering av forskjellige fosfolipider under aggregering av beleggingsproteiner i membranen, idet beleggingsproteinene samhandler med lipidene i ulik grad og binding av beleggingsproteinene til hverandre foretrekker visse fosfolipider. Oppdagelsen av såkalte lipidflåter , dvs. mikroområder med høyt kolesterolinnhold som flyter i en cellulær membran, har vist en inhomogen struktur av disse membranene. Disse lipidflåtene ser også ut til å være viktige for selektiv innlemmelse i viruskonvolutten. Når det gjelder noen virus, er tilstedeværelsen av disse mikroområdene til og med en nødvendig forutsetning for lagring av konvoluttproteinene og dannelsen av viruskonvolutten, siden de øker tettheten av virale konvoluttproteiner regionalt og dermed muliggjør aggregering. Omvendt er tilstedeværelsen av kolesterol i viralhylsen til noen virus nødvendig for penetrering i cellen. For eksempel reduserte dyrking av hundesykevirus i cellekulturer som en hemmer for kolesterolsyntese ble tilsatt, evnen til å infisere andre celler med 80%. Det samme ble også observert i tilfelle varicella-zoster-virushylser som ikke oppstår på den kolesterolrike cellemembranen.
Tabell: Sammenligning av lipidkomponentene i typiske cellulære membraner (rER: grov ER, sER: glatt ER) og viruskonvolutter ( humant immunsviktvirus HIV-1, sfæriske antigenpartikler av hepatitt B-viruset sHBV). For bedre sammenlignbarhet omdannes lipidkomponentene hver til molprosent av lipidfraksjonen for rottelevercellen fra dataene fra MK Jain (1980). SER-membranen inneholder også 2,0% difosfatidylglyserin ( kardiolipin ).
| Lipidkomponent | Cellemembran | rER-membran | sER-membran | Golgi-membran | HIV-1 | sHBV |
|---|---|---|---|---|---|---|
| kolesterol | 34.5 | 6.6 | 10.4 | 9.1 | 46.8 | 3.1 |
| Fosfatidylkolin | 20.7 | 60.4 | 56.9 | 48.8 | 12.7 | 78.9 |
| Sphingomyelin | 16.0 | 3.3 | 12.4 | 12.2 | 15.1 | 1.9 |
| Fosfatidyletanolamin | 12.6 | 17.6 | 21.7 | 18.3 | 13.1 | 9.2 |
| Fosfatidylinositol | 4.6 | 8.8 | 6.9 | 7.3 | 1.1 | 3.6 |
| Fosfatidylserin | 10.3 | 3.3 | - | 4.3 | 8.0 | 0,9 |
| Lipidinnhold% | 87,0 | 91,0 | 96.6 | 82.0 | 28.0 | 24.0 |
| C / P kvotient | 0,53 | 0,07 | 0,11 | 0,10 | 0,88 | 0,03 |
Som det kan sees fra en sammenligning av lipidkomponentene oppført i tabellen ovenfor, ved å bestemme lipidsammensetningen i en virushylse, kan det trekkes konklusjoner om den cellulære opprinnelsesmembranen. I eksemplet gitt har HIV-1 den typiske sammensetningen av cellemembranen og de sfæriske, tomme HBV-partiklene - hvis lipidsammensetning tilsvarer de komplette virionene - lipidprofilen til den grove ER. Den spesifikke anrikningen og uttømmingen av komponentene sammenlignet med den opprinnelige membranen kan også sees. Siden lipidsammensetningen av membranene av forskjellige celletyper kan variere, kan tilsvarende avvik i virushylsteret også forventes i et virus når det reproduserer seg i forskjellige celletyper i organismen eller i cellekultur . Litt forskjellige lipidforhold kan også forekomme i en enkelt celle hvis cellemembranen har en rettet polaritet som f.eks. B. i celler som er ordnet på et lumen . Ulike viruskonvolutter kan dannes i apikale eller basale områder av cellemembranen.
Viktigheten av lipidkomponentene for viktige funksjoner i virushylsteret som virusopptak, smittsomhet, membranfusjon og montering av viruspartiklene ble ikke anerkjent på lang tid, siden hovedfokuset var å undersøke hylleproteinene. Imidlertid har mange studier på forskjellige virus nylig vist hvor mye lipidene gjør funksjonen til kappeproteinene mulig gjennom protein-lipid-interaksjoner ; spesielt akkumulering av kolesterol i lipidflåter ser ut til å ha en avgjørende innflytelse på virushylsterets funksjon. Lipidmembranen har en betydelig innflytelse på arrangementet av konvoluttproteinene og deres korrekte folding som en tertiær struktur .
Virushylleproteiner

På en måte som ligner på cellulære membranproteiner , er de virale omhyllingsproteinene ( engelsk omhyllingsproteiner , i motsetning til kapsidproteinene, en. Strøkprotein, kapsidproteinet , CP) innlemmet i lipidmembranen. Ett eller flere transmembrane, lipofile proteindomene krysser lipidmembranen og skiller dermed et mindre indre domene fra et større ytre. De fleste av konvoluttproteinene har karboksylterminalen på innsiden, slik at konvoluttproteinene tilhører klasse 1-membranproteiner.
Det innadrettede domenet (også kalt "intracellular anchor" eller anchor domain) er hydrofilt og kan formidle bindingen til påfølgende interne strukturer. I det klassiske tilfellet er dette kapsid. I virus med flere kapsider eller komplekse virus, binder det indre domenet til andre proteiner som også strekker undersiden av viruskonvolutten. Disse ligger mellom kapsiden og skallet i matriksrommet og blir derfor referert til som matriksproteiner . I det enkleste tilfellet består det indre domenet i kappeproteinet av en brettet ende av proteinet. Hvis kappeproteinet krysser lipidmembranen flere ganger ( “multipass” ), er det indre domenet en resulterende sløyfe. Samspillet mellom de indre domenene, enten direkte uten ytterligere bindingspartnere eller indirekte via matriksproteiner eller kapsid, er den avgjørende kraften for krumningen av membranen under konvolutten.
Det transmembrane domenet består av en lipofil α-helix , hvis lengde er tilpasset tykkelsen på lipidmembranen. De virusene som er innhyllet i den tykkere, kolesterolrike cellemembranen, trenger helix z. B. 26 aminosyrer ( influensavirus ). Hvis virusene er innhyllet på membranen til rER, er 18–20 aminosyrer ( gul feber-virus ) tilstrekkelig for en transmembran helix. Den struktur belysning av en konvolutt protein kan derfor gi en indikasjon av membranen på hvilken virionene dannes. Det virale kappeproteinet kan også ha flere transmembrane domener, hvor helixene danner bunter som ligger nær hverandre i membranen. Pelsproteinene i Flaviviridae- familien har to transmembrane helixer, hvor den nære båndet formidles av en hydrofil flanke; disse domenene har altså en amfifil struktur. Siden helixene fortrenger lipidene i membranen, kan den generelle regelen være at jo mer transmembrane domener konvoluttproteinene har, jo lavere er lipidinnholdet i en viruskonvolutt.

Den ytre delen av et kappeprotein er vanligvis glykosylert mange steder, dvs. kovalent bundet med korte sukkerrester ( oligosakkarider ), og det er derfor virale kappeproteiner telles blant glykoproteinene . Denne ytre delen av kappeproteinet er viktig for binding til reseptorer og for membranfusjon under virusopptak. De ytre domenene gjenkjennes også av antistoffer mot immunforsvaret, slik at eksponerte epitoper ofte inneholder svært variable seksjoner, som vanligvis blir referert til som hypervariable regioner (HVR). HVR av konvoluttproteinene fører til en høy immunologisk fleksibilitet av viruset, siden de begrenser bindingen av antistoffer gjennom hyppige mutasjoner og raskt kan tilpasse seg forskjellige cellereseptorer for nye verter .
Oppgavene til det ytre domenet - reseptorbinding og membranfusjon - kan kombineres i ett strøkprotein eller fordeles over flere samarbeidende strøkproteiner. Med bare noen få unntak samles konvoluttproteinene i komplekser som består av flere identiske eller forskjellige konvoluttproteiner. Hvis størrelsen på disse oligomerer er passende, kan de bli sett på som såkalte "pigger" eller peplomerer i elektronmikroskopet . Svært karakteristiske pigger kan for eksempel sees i virusfamiliene Orthomyxoviridae og Coronaviridae ; sistnevnte fikk også navnet sitt fra denne egenskapen til viruskonvolutten.
Antallet forskjellige kappeproteiner og sammensetningen av kappeproteinoligomerer er karakteristisk for mange virusgenrer. Rhabdovirus har bare ett strøkprotein som danner enkle trimere ([G] 3 ). I retrovirus , f.eks. B. Rous sarkomvirus , to glykoproteiner (SU og TM) kombineres for å danne en heterodimer , som igjen ordner seg med to andre heterodimerer for å danne en heksamer ([SU-TM] 3 ). Alfavirus har to (E1, E2) eller tre konvoluttproteiner (E1-3) som, når de er samlet, ordner seg for å danne større tredelte komplekser ([E1-E2-E3] 3 ).
Når det gjelder virus som spirer på cellemembranen, blir konvoluttproteinene først lagret i cellemembranen, og dette blir deretter beriket med proteiner som er i stand til membranfusjon. Denne endringen i cellemembranen kan føre til at cellemembranene i nabocellene kan smelte sammen med de virale kappeproteinene og dermed danne gigantiske celler, såkalt syncytia . Dette kan være fordelaktig for viruset, siden infeksjonen kan spre seg når cellene smelter sammen, og et større synteseapparat er tilgjengelig for virusene; dette er f.eks. B. saken med respiratorisk syncytialvirus . Fusjonen av celler i huden av kappeproteiner av meslingerviruset forårsaker lokal betennelse , som deretter blir synlig som de typiske rødlige flekkene til en meslingerinfeksjon. Imidlertid har mange virus utviklet strategier for å forhindre at syncytia dannes, da dette også kan hindre spiring av nye virus. I dette tilfellet aktiveres fusjonsegenskapene til kappeproteinene bare ved et ytterligere modningstrinn, hvor fusjonssekvensen enten bare blir eksponert etter fordøyelsen av en protease eller glykosidase eller et surt miljø ( pH <6,0) forårsaker en endring i konformasjon av kappeproteinet, gjennom hvilket fusjonssekvensen først blir vendt utover. Det best kjente eksempel er kappeproteinet hemagglutinin av de ortomyksovirus , som først har som skal aktiveres ved en neuraminidase , og har en pH-avhengig fusjonsaktivitet.
Konvoluttproteiner utfører også av og til andre funksjoner i cellemembranen under virusreplisering enn å bare omslutte virionen. For dette formålet kan de alternativt ordne seg til å danne nye strukturer og, som i SARS coronavirus, for eksempel, danne porer som fører til cellelyse .
Symmetriske viruskonvolutter

Den indre delen av konvoluttproteinene kan samhandle med et innhyllet kapsid på en slik måte at bare ett kappeprotein (eller en aggregert dimer eller trimer av kappeproteinene ) binder seg til bare en kapsomer . Dette faste arrangementet overfører formen og symmetrien til den indre icosahedriske kapsiden til den ytre virushylsteret, og til tross for mobiliteten til lipidmembranen, resulterer virushylster med en strengt icosahedral struktur. Denne formen for såkalt " morphogenesis inside out" finnes i slekten Alphavirus av familien Togaviridae (f.eks. Som Semliki Forest Virus og Sindbis virus ) og slekten Flavivirus av familien Flaviviridae .
I de større virusene i Bunyaviridae- familien (80–120 nm) kan det også påvises en regelmessig ordning av konvoluttproteinene i form av en icosahedron ( trianguleringstall T = 12), men ingen symmetrisk, icosahedral capsid som kan støtte symmetri fra innsiden. Her bestemmer den tette interaksjonen mellom konvoluttproteinene med hverandre formen på viruskonvolutten, som også kan beskrives som “morfogenese utenfra og inn”. Når det gjelder bunyavirus, er tre spiralformede kapsider pakket i virushylsteret, som, i likhet med influensavirusene, gjør det mulig å bytte RNA-segmenter ( reassortment ) og høy genetisk fleksibilitet. Denne fleksibiliteten til influensavirusene på grunn av flere, uregelmessige kapsider eller RNA- tråder kjøpes til prisen for en uorden og derfor meget ustabil virushylse, som kan inaktiveres ved å tørke ut og bruke milde vaskemidler . Bunyaviridae- familien gir derimot det symmetriske og dermed fastere arrangementet av kappeproteinene et relativt høyt nivå av stabilitet. B. i slekten Hantavirus - forblir smittsom i flere måneder i tørr tilstand og til og med overleve utskillelse i urinen, selv om urea fungerer som et vaskemiddel og inaktiverer andre innhyllede virus.
Spesielle skjemaer
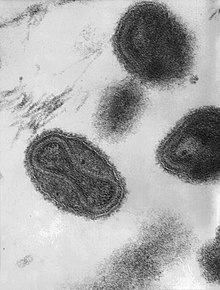
I noen få virusfamilier er en fosfolipidmembran ikke til stede som en ytre, omsluttende struktur, men ligger inne i virionene. To familier av bakteriofager , Corticoviridae og Tectiviridae , der lipidmembranen er plassert i en icosahedral capsid, er spesielt eksepsjonelle . Denne strukturen blir ikke referert til som viruskonvolutten, da den verken er på utsiden eller utfører typiske oppgaver for en viruskonvolutt, for eksempel å feste til celleoverflaten. Membranvesikelen som er tilstede i Tectiviridae brukes etter at kapsiden har festet seg til bakterieoverflaten for aktiv penetrasjon av det dobbeltstrengede bakteriofag-DNAet i vertscellen.
Hos medlemmer av Poxviridae- familien består virushylsteret av en dobbel membran med et ytre og et ekstra indre fosfolipid dobbeltlag. Innen cytosolen er koppevirusene tilstede med en enkel konvolutt. Denne første konvolutten er ikke opprettet ved spirende fra en cellulær membran, men ved å sette sammen en helt ny lipidmembran på utsiden av det umodne, senere dobbeltkonkave kapsiden. Nedbrytede membrankomponenter fra overgangsområdet mellom Golgi og ER-membran (mellomrom) brukes til å gjenoppbygge membranen. Den enkelt innhyllede viruspartikkelen får deretter en andre, ytre virushylse ved å spire på Golgi-membranen.
Dannelse under virusreplisering
Syntesen av konvoluttproteinene og dannelsen av viruskonvolutten markerer den siste fasen i replikasjonssyklusen til et innhyllet virus; på forhånd må virusgenomet replikeres og eventuelt pakkes i et kapsid.
Operasjonen av konvolutten til et virus, inkludert spirende ( "spirende" ) kalt, tilsvarer en spesifikk emballasje i en avklemt membranblære. Innen celler er konstant dannelse og fusjon av membranvesikler en fysiologisk prosess for transport av stoffer, den såkalte eksocytosen eller endocytosen . Et innhyllet virus bruker disse allerede eksisterende egenskapene og mekanismene for membranstrømning ved å modifisere det og kontrollere det gjennom de virale strukturelle proteinene. Energien som er nødvendig for krumningen av lipidmembranen og for dannelsen av bobler kommer utelukkende fra samspillet mellom kappeproteinene med hverandre, kappeproteinene med indre strukturer som matriksproteiner og kapsider eller kapsidene med lipidmembranen ; en tilførsel av energi, for eksempel i form av ATP, er ikke nødvendig for dette. Når det gjelder togavirus , overvinner for eksempel den energisk gunstigere aggregeringen av kappeproteinene krumningen, som er mindre energisk gunstig for lipidmembranen ved hjelp av hydrogenbindinger , ionebindinger og spesielt gjennom hydrofobe interaksjoner . Dannelsen av virushylsteret - uavhengig av membransystemet - kontrolleres derfor bare av translasjon , transport og konsentrasjon av virusproteinene på det respektive membranrommet. Spirende som den spontane aggregeringen av kapsid-, lipidmembran- og kappeproteiner er av stor interesse med hensyn til dens termodynamiske betraktning. Modeller ble ofte brukt for å beskrive dem for å kunne beregne samspillet mellom komponentene som var involvert. I samsvar med tiden målt in vitro som spirende prosess tar, kan 10 til 20 minutter også beregnes i modellen. Diffusjonen av kappeproteinene langs lipidmembranen og forskyvningen av vannmolekyler mellom kappe og kapsid ble avledet som begrensende prosesser . Modellberegningene antyder også en foretrukket spiring av virus på de punktene i cellemembranen der lipidmembranen allerede er morfologisk buet. Dette stemmer overens med elektronmikroskopiske undersøkelser av infiserte celler der spirende virus hovedsakelig ble funnet på de buede sidene av Golgi-apparatet eller cellemembranen.
Trekkmekanismene er i prinsippet like på den respektive cellemembranen. Den første modellen for spirende ble utviklet ved hjelp av eksemplet fra Semliki Forest Virus (SFV). Her fører bindingen av det intracellulære ankeret til konvoluttproteinene til et allerede lukket kapsid til krumningen av lipidmembranen. Fra dette ble avhandlingen avledet at tilstedeværelsen av konvoluttproteiner og bindingen til kapsidproteiner er helt nødvendig for utvikling av en viruskonvolutt . Denne tidlige modellen ble betydelig begrenset når et belegg av kapsider ble observert i retrovirus selv uten tilstedeværelse av kappeproteiner ( Env-protein ) når kapsidproteinene ( Gag-proteiner ) er tilgjengelige alene i transfekterte cellekulturer.

I tillegg til det spesielle tilfellet for Gag-proteinet fra retrovirusene, er det tre andre viktige varianter av spirende (se illustrasjon). Den enkleste måten er den lette krumningen av lipidmembranen på grunn av samspillet mellom konvoluttproteinene via deres indre ankerdomener. En lukket kapsid binder seg til disse aggregerte kappeproteinene og driver spirende gjennom interaksjonen med kappeproteinene (se figur, tilfelle A). I det andre tilfellet (B) foregår montering av kapsiden først etter binding til konvoluttproteinene. Samspillet mellom kapsidproteiner og kappeproteiner gjør at nukleinsyren kan binde og fullføre viruset under spiring. Denne varianten kan også suppleres med et matriksprotein som formidler mellom skallet og kapsiden. For virus som ikke har symmetriske kapsider (for eksempel bovint virus diarévirus og det relaterte hepatitt C-viruset ), er det tilstrekkelig å binde nukleinsyren til basiske proteiner ( nukleo- eller kjerneproteiner ), som ligner på matriseproteinene på innsiden av membranen interagerer konvoluttproteinene.
I den tredje varianten (C) er interaksjonen mellom de intracellulære ankerene i konvoluttproteinene bare mulig ved binding til matriseproteiner. Etter at denne interaksjonen har ført til en innledende krumning av lipidmembranen, kan en kapsid (som i herpesvirusene) eller flere spiralformede kapsider (som i Orthomyxoviridae ) bindes og omsluttes.
- Dannelse av viruskonvolutten gjennom spirende: TEM- bilder av infiserte cellekulturer
Aggregering av konvoluttproteiner og krumning av cellemembranen i HIV- 1
Lassa-virus i sen fase av innsnevring av viruskonvolutten
Humant herpesvirus 6 etter frigjøring på cellemembranen
Innhyllede partikler av Rift Valley Fever- viruset ( Bunyaviridae ) i lumen i ER
Knopp på cellemembranen
Dannelsen av virushylsteret på cellemembranen krever først at hylleproteinene transporteres til celleoverflaten. Virusproteinene oppstår på ribosomene til den grove ER, med konvoluttproteinene som trenger inn i membranen til ER med deres transmembrane domener under syntesen og blir innlemmet i den. Konvoluttproteinene glykosyleres via membransystemet i Golgi-apparatet . De nå modifiserte (modne) konvoluttproteinene transporteres til cellemembranen i innsnevrede, eksocytotiske vesikler og smelter sammen med den. Disse domenene til konvoluttproteinene som tidligere ble ledet inn i lumenet til ER er nå ordnet ekstracellulært . De resterende viruskomponentene (kapsider, nukleinsyrer og mulige matriksproteiner) brakt til cellemembranen kan nå innhylles. Opprinnelsesveien via cellemembranen krever lagring av virale konvoluttproteiner, noe som kan føre til den nevnte dannelsen av syncytia (se avsnitt konvoluttproteiner ). Disse virusproteinene som presenteres på utsiden, kan imidlertid også gjenkjennes som fremmede av immunceller, slik at en tidlig immunrespons mot konvoluttproteinene kan finne sted. Alle virus hvis konvolutter er avledet fra cellemembranen, blir også absorbert på nytt av fusjonen av konvolutten med cellemembranen. Denne typen opptak ( fusjon utenfra ) muliggjør infeksjon uten transport i et endosom .
Viktige virusfamilier som er preget av spirende på cellemembranen er for eksempel Retroviridae , Orthomyxoviridae , Togaviridae og alle virusfamilier med et enkeltstrenget RNA med negativ polaritet (ss (-) RNA) som genomet (bestill Mononegavirales ) , dvs. Bornaviridae , Rhabdoviridae , Filoviridae og Paramyxoviridae .
Knopp på Golgi og ER-membranen
Siden konvoluttproteinene i utgangspunktet alltid lagres i membranene i de intracellulære membransystemene, kan spiring også finne sted her. Enten lipidmembranen i ER eller - etter vesikeltransport - kan Golgi-apparatet velges for denne utviklingsveien. Dette bestemmes hovedsakelig av de muligens nødvendige modifikasjonene av konvoluttproteinene, som nesten bare kan utføres av enzymene i Golgi-apparatet. Den spirende meget ofte forekommer ved overgangen mellom de to membransystemer, det såkalte mellomliggende rom . Etter spiring er den innhyllede viruspartikkelen alltid plassert i lumen i membransystemet, hvorfra den transporteres til utsiden inne i en transportvesikkel ( eksosom ). Denne intracellulære innhyllingen av viruset kan finne sted uten å ødelegge cellen, siden ingen virusproteiner endrer celleoverflaten og normal eksocytose brukes til å utslette viruset. Når neste vertscelle er infisert, må alle disse virusene tas opp av et endosom, med membranen som virushylsteret smelter sammen ( fusjon fra innsiden ). Viktige virusfamilier med intracellulær spirende er Coronaviridae , Hepadnaviridae og Flaviviridae .
Knopp på kjernemembranen
Medlemmene av virusfamilien Herpesviridae er et spesielt tilfelle i deres struktur, reproduksjonsstrategi og også i dannelsen av virushylsteret, siden de veldig store kapsidene til herpesvirusene er samlet i cellekjernen , der den dobbeltstrengede Virus fra DNA blir også syntetisert. Selv meget tidlige elektronmikroskopiske undersøkelser av celler der herpes simplex-viruset multipliserer, avslørte spirende kapsider på innsiden av kjernemembranen og innhyllet viruspartikler i den perinukleære sisternen som omgir kjernen . Siden den perinukleære sisternen er koblet til den grove ER via membranrør, ble det antatt at de innhyllede virionene deretter ble kanalisert ut av cellen via membranvesikler i Golgi-apparatet. Imidlertid viste en undersøkelse av lipidsammensetningen i virushylsteret at lipidkomponentene ikke tilsvarer de i kjernemembranen, men heller har lipidprofilen til Golgi-membranen. Dette funnet førte til oppdagelsen at herpesvirusene først skaffer seg en viral konvolutt ved spirende på kjernemembranen. Imidlertid smelter dette igjen med den ytre membranen i den perinukleære sisternen og frigjør den bare kapsiden i cytosolen. Bare gjennom en ny spirende i en innsnevret membranvesikkel av Golgi-apparatet, som er beriket med viral konvolutt og matrise proteiner, får kapsiden sin endelige konvolutt. Denne såkalte sekundære konvolutten tilsvarer da bare viruskonvolutten til de frigitte virusene.
Tomme viruskonvolutter og "defekte virus"
I noen virus er konvoluttproteinene i stand til å forårsake spirende uten ytterligere binding til en indre struktur. Dette er spesielt tilfelle når interaksjonen mellom de indre ankerdomenene til konvoluttproteinene er spesielt høy. Resultatet er tomme eller ufullstendig fylte viruskonvolutter. Eksistensen av disse tomme skallene ble først oppdaget under studier av det såkalte "Australia Antigen", som førte til oppdagelsen av hepatitt B-viruset (HBV) av B. Blumberg . Det oppdagede antigenet består av de tre kappeproteinene til HBV (HBs-antigen). I blodet til mennesker som er smittet med HBV, finnes HBs-antigenet hovedsakelig i tomme, sfæriske partikler med en diameter på 22-24 nm og tomme rørformede strukturer (“tubuli”) med variabel lengde. Bare ett smittsomt, komplett virus (42 nm) kan påvises av ca. 1000 til 10 000 partikler som inneholder HBs-antigen. Dette enorme overskuddet av tomme viruskonvolutter tjener primært til å nøytralisere antistoffer mot kappeproteinet og dermed forhindre at de binder seg til det komplette viruset.
Tomme viruskonvolutter, som, som i eksemplet med HBV, ofte er mindre enn hele viruset, finnes også med feil eller ufullstendig emballasje av segmenterte genomer (f.eks. Influensavirus) når de dyrkes i cellekulturer. Disse partiklene er også kjent som defekte interfererende partikler (DIP) eller viruslignende partikler (VLP). Når det gjelder hepatitt C-viruset , ble det mistenkt eksistensen av ufullstendige partikler i blodserumet til pasienter, siden det kan påvises et skiftende støkiometrisk forhold mellom kjerneprotein og RNA.
Hepatitt D- viruset gir et spesielt eksempel på virushylsteret , da det ikke i seg selv har noen gener for tilstrekkelig emballasje med hylsterproteiner. Det avhenger av tilstedeværelsen av HBV i den samme cellen, siden den bare kan pakkes og frigjøres med konvoluttproteinene til HBV. Det kalles derfor et defekt eller avhengig virus ( virusoid ).
Kapsidene av innhyllede og ikke-innhyllede virus
I viruskonvolutter med høyt lipidinnhold er konvoluttproteinene ordnet fleksibelt og kan bevege seg sideveis i membranen. Denne flytende egenskapen til viruskonvolutten betyr at en lukket konvolutt er til stede selv om det er en feil i arrangementet av konvoluttproteinene eller et gap i overflatesymmetrien. Når det gjelder ikke-innhyllede virus, vil en slik forstyrrelse føre til utilstrekkelig beskyttelse av genomet eller til oppløsningen av kapsiden. Under beskyttelse av en viruskonvolutt er det større frihet for strukturen til kapsiden sammenlignet med ikke-innhyllede virus, siden disse ikke lenger tjener direkte til å beskytte genomet mot nukleaser eller representerer et angrepspunkt for immunsystemet. Kapsidene til innhyllede virus kan derfor også ha hull eller bare dekke genomet som et nettverk. Dette er av stor betydning for retrovirus og de nært beslektede hepadnavirusene (f.eks. Hepatitt B-viruset ), siden kapsiden, som ennå ikke er innhyllet, men lukket, fortsatt kan absorbere ATP og nukleotider under replikasjon for å fullføre det allerede pakket genomet. I kapsidene til noen innhyllede virus tillater hullene også frigjøring av genomet z. B. til kjerneporen uten at kapsiden i cytosolen først måtte gå i oppløsning.
Biologisk betydning
Virushylse som en patogenisitetsfaktor
Som den ytre strukturen er viruskonvolutten ansvarlig for alle egenskapene til en virion som påvirker infeksjonsveien, dens opptak i cellen og immunforsvaret. I denne konfrontasjonen med vertsorganismen formidlet av virushylsteret har det utviklet seg mekanismer i løpet av viral evolusjon som er fordelaktige for replikasjonen av viruset og blir referert til som virulens- eller patogenisitetsfaktorer . Et av disse fenomenene er såkalt molekylær etterligning , dvs. etterligning av proteiner fra vertsorganismen av konvoluttproteiner, som ikke lenger gjenkjennes av immunsystemet som fremmede eller til og med kan etterligne funksjonene til disse proteinene.
Et eksempel på dette immunologisk kamuflasje er likheten av deler av kappeproteinet av noen virusarter i Coronaviridae familie med Fc-fragmentet av det IgG-antistoff . Konvoluttproteinet E2 av hepatitt C-viruset er strukturelt lik en del av IgG-antistoffet (ab-fragment). I tillegg til slik kamuflasje gjennom strukturell imitasjon, kan også den spesifikke binding av vertsproteiner til virushylsteret brukes. Dette er tilfelle når det gjelder den spesifikke bindingen av albumin til hylsen til hepatitt B-viruset.
I tillegg til å etterligne vertsens egne proteiner for kamuflasje, kan konvoluttproteinene også etterligne bindingsegenskapene til vertsproteinene. I tilfelle av retrovirusene fra slekten Lentivirus er likheten mellom det ytre domenet til kappeproteinet gp41 og interleukin-2 beskrevet. her etterlignes bindingen til interleukinreseptorer av immunceller som er målcellene til disse virusene.
Evnen til retrovirus i cellekultur til å indusere spirende uten eget kappeprotein brukes i genteknologi av kunstige viruspartikler for å produsere partikler med modifiserte overflateegenskaper. For eksempel kan fremmede konvoluttproteiner lagres i konvolutten til disse såkalte pseudotypene for å kunne undersøke for eksempel binding av disse til reseptorer eller å bruke dem som virale vektorer i forskning. Dannelsen av pseudotyper ser ut til å være knyttet til eksistensen av de allerede nevnte lipidflåtene .
Utviklingen av pseudotyper er også beskrevet i naturlige infeksjoner. For eksempel kan to typer virus lagre de forskjellige konvoluttproteinene blandet i en nylig voksende konvolutt når en celle blir infisert samtidig, eller ett virus kan pakkes helt med konvolutten til det andre viruset. Dette fenomenet med dannelse av pseudo-type kalles også fenotypisk blanding ( "fenotypisk blanding" heretter).
Viruskonvolutt og inaktivering av virus
Tapet av viruskonvolutten eller fjerningen av lipidkomponentene fra konvolutten hindrer det innhyllede viruset i å infisere vertscellen. Dette faktum brukes til å inaktivere innhyllede virus for å forhindre at viruset sprer seg. Den mest følsomme komponenten i virushylsteret, lipidmembranen, kan ødelegges av fettoppløsende alkoholer som etanol eller 2-propanol. Hvis virushylsteret har høyt lipidinnhold, som det er tilfelle med orthomyxoviruses, er milde vaskemidler eller såper tilstrekkelig for å redusere virusets smittsomhet . En kombinasjon av milde løsningsmidler og vaskemidler kan brukes til å inaktivere mulige innhyllede virus som HIV, HBV og HCV i blodprodukter for transfusjon .
Utvikling av pandemier og "nye virus"
Den høye immunologiske fleksibiliteten til konvoluttproteinene gjør at enkelte innhyllede virus kan formere seg i forskjellige vertsarter. Infeksjoner kan utvikle seg på tvers av arter, eller mellomliggende verter kan brukes som vektorer. Virusene som overføres av leddyr ( f.eks. Mygg og flått ), de såkalte arbovirusene , er derfor overveiende innhyllede virus. Den eneste ikke-innhyllede slekten Coltivirus , hvis medlemmer kan overføres som arboviruses, har en andre capsid for å erstatte fleksibiliteten til viruskonvolutten. Virus er vanligvis spesielt patogene når de vises i en vertspopulasjon. De innhyllede virusene, som er spesielt gunstige for vertsovergangen fra dyr til mennesker, har derfor et spesielt høyt potensial for nye infeksjoner som forekommer hos mennesker.
litteratur
Gjeldende litteratur
- Stephen C. Harrison: Prinsipper for virusstruktur . I: David M. Knipe, Peter M. Howley et al. (red.): Fields 'Virology . 4. utgave. Philadelphia 2001, ISBN 0-7817-1832-5 , s. 53-85
- John AT Young: Virusinnføring og uncoating . I: Fields 'Virology .
- SJ Flint, LW Enquist, VR Racaniello og AM Skalka: Principles of Virology. Molekylærbiologi, patogenese og kontroll av dyrevirus. 2. utgave. ASM-Press, Washington DC 2004, ISBN 1-55581-259-7
- Joe Bentz (red.): Viral Fusion Mechanisms . CRC-Press, Boca Raton 1993, ISBN 0-8493-5606-7
- Robert Brasseur (red.): Molekylær beskrivelse av biologiske membraner ved datamaskinstøttet konformasjonsanalyse . Bind 1, CRC-Press, Boston 1990, ISBN 0-8493-6375-6
Historisk litteratur
- Wolfhard Weidel: Virus - Historien om lånt liv . Berlin / Göttingen / Heidelberg 1957
- Frank Fenner , BR McAuslan et al. (red.): Biologien om dyrevirus. Academic Press, New York / London, 1. utgave 1968, 2. utgave 1974, ISBN 0-12-253040-3
- Alena Lengerová: Membrane Antigener . Fischer, Jena 1977
weblenker
- Graf over de ytre og indre lipidkomponentene i HIV-1 (PNAS 2006)
- Cryo-EM-analyse av konvolutten til et alfavirus
Individuelle bevis
- ↑ Karlheinz Lüdtke: Om historien om tidlig virusforskning . (PDF; 222 kB), MPI for vitenskapshistorie, 1999 (oversikt)
- ^ W. Reed: Nyere undersøkelser angående etiologi, forplantning og forebygging av gul feber av United States Army Commission . I: J. Trop. Med. , 1901, 5, s. 143-158
- ↑ B. v. Borries, E. Ruska, H. Ruska: Bakterier og virus i et mikroskopisk bilde . (PDF; 925 kB) Klin. Wochenschrift , 1938, 17, s. 921–925
- ^ H. Ruska: Forsøk på å bestille virustypene . I: Arch. Ges. Virusforskning , 1943, 2, s. 480-498
- ^ EW Goodpasture , AM Woodruff, GJ Buddingh: Vaksinell infeksjon i chorio-allantoisk membran i kyllingembryoet . I: Amer. J. Pathol. , 1932, 8, s. 271
- ↑ WIB Beverige, FM Burnet: Dyrking av virus og rickettsiae i kylling embryo . I: Med. Res. Council Spec. Rept. Ser , 1946, s. 256
- ^ WB Dunham, WJ Macneal: Culture on the Chick Chorio-allantois as a Test of Inactivation of Vaccinia Virus . I: J. Bacteriology , 1942, 44 (4), s. 413-424, PMID 16560579
- U M. Uhler, S. Gard: Lipidinnhold i standard og ufullstendig influensa A-virus . I: Nature 1954, 173 (4413), s. 1041-1042, PMID 13165714
- G E. Gorter, F. Grendel: På bimolekylære lag av lipoid på kromocyttene i blodet . I: J. Exp. Med. , 1925, 41, s. 439-443, jem.org
- ^ LH Frommhagen, NK Freeman, CA Knight: Lipidbestanddelene av influensavirus, kyllingallantoisk membran og sedimenterbart allantoisk protein . I: Virology , 1958, 5 (1), s. 173-175, PMID 13519759
- ↑ LL Coriell, G. et al.: Rake Elektronmikroskopi av herpes simplex . I: J Bacteriol. , 1950, 59 (1), s. 61-68, PMID 15400321
- ↑ S. Brenner, RW Horne: En negativ farging metode for høy oppløsning elektronmikroskopi av virus . I: Biochim. Biophys. Acta , 1959, 34, s. 103-110, PMID 13804200
- ^ D. Branton: Bruddflater på frosne membraner . I: PNAS , 1966, 55, s. 1048-1056, PMID 5334198
- ^ SJ Singer, GL Nicholson: Den flytende mosaikkmodellen av strukturen til cellemembraner . I: Science , 1972, 175, s. 720-731, PMID 4333397
- W JW Corran, WC Lewis: lecitin og kolesterol i forhold til cellemembraners fysiske natur . I: Biochem J . , 1924, 18 (6), s. 1364-1370, PMID 16743417
- ^ RP Rand, V. Luzzati: Røntgendiffraksjonsstudie i vann av lipider ekstrahert fra humane erytrocytter: kolesterolets posisjon i lipidlamellene . I: Biophys. J. , 1968, 8 (1), s. 125-137, PMID 5641398
- ↑ JP Laliberte, LW McGinnes et al.: Integritet av membranlipidflåter er nødvendig for bestilt montering og frigjøring av smittsomme Newcastle-partikler . I: J. Virol. 2006, 80 (21), s. 10652-10662, PMID 17041223
- ^ H. Imhoff, V. von Messling et al.: Infeksjon med hundesykevirus krever kolesterol i viralhylsen . I: J. Virology , 2007, 81 (8), s. 4158-4165, PMID 17267508
- ↑ S. Hambleton et al. Kolesterol avhengighet av varicella-zoster virion inntreden i målceller . I: J. Virology , 2007, 81 (14), s. 7548-7558, PMID 17494071
- ↑ MK Jain, RC Wagner: Introduksjon til biologiske membraner . Wiley, New York 1980, ISBN 0-471-03471-1
- ↑ omdannet til molprosent fra: RC Aloia et al.: Lipidsammensetning og fluiditet av humant immunsviktvirus . I: PNAS , 1988, 85 (3), s. 900-904, PMID 2829209
- ↑ beregnet fra tabell 1 og 4 i: O. Satoh et al.: Membranstruktur av hepatitt B-virusets overflateantigenpartikkel . I: J. Biochemistry Tokyo , 2000, 127 (4), s. 543-550, PMID 10739944
- ↑ G. van Meer, K. Simons: Virus spirende fra enten den apikale eller den basolaterale plasmamembran domene av MDCK-celler som har unike fosfolipidpreparater . I: EMBO J. , 1982, 1 (7), s. 847-852, PMID 6329709
- ↑ N. Chazal, D. Gerlier: Virus Entry, Assembly, Spirende, og Membran flåtene . I: Microbiol. Mol. Biol. Rev. , 2003, 67 (2), s. 226-237 (gjennomgang PMID 12794191 )
- , BA, G. Meyers: Pestivirus glykoproteinet Erns er forankret i plan i membranen via en amfipatisk helix . I: J. Biol. Chem. , 2007, E-pub, PMID 17848558
- ^ B. Rentier, E.L. Hooghe-Peters, M. Dubois-Dalcq: Elektronmikroskopisk studie av meslingervirusinfeksjon: cellefusjon og hemadsorpsjon. J. Virol. , 1978, 28 (2), s. 567-577, PMID 722861
- ↑ J. Torres, K. Parthasarathy et al. : Modell av en formodet pore: den pentameriske alfa-heliske bunten av SARS coronavirus E-protein i lipid-dobbeltlag . I: Biophys. J. , 2006, 91 (3), s. 938-947, PMID 16698774
- ^ RH Cheng, RJ Kuhn et al.: Nukleokapsid og glykoproteinorganisasjon i et innhyllet virus . I: Cell , 1995, 80 (4), s. 621-630, PMID 7867069
- ^ RH Vogel, SW Provencher et al.: Konvoluttstruktur av Semliki Forest-virus rekonstruert fra kryo-elektronmikrografier . I: Nature , 1986, 320 (6062), s. 533-535, PMID 3960136
- ^ CH von Bonsdorff, R. Pettersson: Uukuniemi-virusets overflatestruktur . I: J. Virology , 1975, 16 (5), s. 1296-1307, PMID 52726
- ↑ C. Risco et al.: Endoplasmatisk retikulum-Golgi mellomromsmembraner og vimentinfilamenter deltar i montering av vaccinia-virus . I: J. Virol. , 2002, 76 (4), s. 1839-1855, PMID 11799179
- ↑ for en oversikt over virusmodning og spirende se: H. Garoff, R. Hewson, D.-JE Opstelten: Virusmodning ved spirende . I: Microbiol. Mol. Biol. Rev. , 1998, 62, s. 1171-1190, PMID 9841669
- ↑ S. Tzlil, M. Deserno et al.: En statistisk-termodynamisk modell for viral spirende . I: Biophys. J. , 2004, 86 (4), s. 2037-2048, PMID 15041646
- ↑ DM Lerner, JM Deutsch, GF Oster: Hvordan spirer et virus ut? Biophys J. , 1993, 65 (1), s. 73-79, PMID 8369463
- ↑ H. Garoff, K. Simons: Plassering av piggglykoproteinene i Semliki Forest- virusmembranen . I: PNAS , 1974, 71 (10), s. 3988-3992, PMID 4530279
- ↑ M. Delchambre et al.: GAG-forløperen til simian immunsviktvirus samles i viruslignende partikler . I: EMBO J. , 1989, 8 (9), s. 2653-2660, PMID 2684654
- C TL Cadd, U. Skoging, P. Liljeström: Spiring av innhyllede virus fra plasmamembranen . I: Bioessays , 1997, 19 (11), s. 993-1000, PMID 9394621
- ↑ D. Falke, R. Siegert, W. Vogell: Electron mikroskopiske funn på spørsmålet om dobbelt membran dannelsen av herpes simplex virus . I: Arch Gesamt Virusforschung 1959, 9, s. 484-496, PMID 13821428
- ↑ IL van Genderen, R. Brandimarti et al.: Fosfolipid-sammensetningen av ekstracellulære herpes simplex virioner Ulike fra gjorde av vertscellekjerner . I: Virology , 1994, 200 (2), s. 831-836, PMID 8178468
- ↑ LM Stannard et al.: Elektronmikroskopisk studie av distribusjonen av Australia-antigenet i individuelle sera på 50 serologisk positive blodgivere og to pasienter med serum hepatitt . I: J. Clin. Pathol. , 1973, 26 (3), s. 209-216, PMID 4700502
- ↑ CG Schüttler et al.: Variabelt forhold mellom RNA fra hepatitt C-virus og viralt kjerneantigen i pasientsera . I: J. Clin. Microbiol. , 2004, 42 (5), s. 1977-1981, PMID 15131157
- Hopp opp ↑ F. Bonino, KH Heermann, M. Rizzetto, WH Gerlich: Hepatitt delta virus: proteinsammensetning av delta antigen og dets avledet konvolutt av hepatitt B-virus . I: J. Virology , 1986, 58 (3), s. 945-950, PMID 3701932
- ^ RA Crowther, NA Kiselev et al.: Tredimensjonal struktur av kjernepartikler av hepatitt B-virus bestemt ved elektronkryomikroskopi . I: Cell , 1994, 77 (6), s. 943-950, PMID 8004680
- ↑ EL Oleszak et al.: Molekylær etterligning mellom Fc-reseptor og S peplomerprotein fra mus hepatittvirus, bovint koronavirus og overførbart gastroenterittvirus . I: Hybridoma , 1995, 14 (1), s. 1-8, PMID 7768529
- ↑ YW Hu et al.: Immunoglobulin-etterligning ved hepatitt C-virushylsterprotein E2 . I: Virology , 2005, 332 (2), s. 538-549, PMID 15680419
- ↑ JA Quiroga et al.: Inhibering av albuminbinding til hepatitt B-virioner av monoklonalt antistoff mot preS2-domenet i viralhylsen . I: Fordøyelse , 1987, 38 (4), s. 212-220, PMID 2452108
- ↑ PF Serres: Molekylær etterligning mellom trimerisk ektodomene i det transmembrane proteinet fra immunsuppressive lentivirus (HIV-SIV-FIV) og interleukin 2 . I: CR Acad. Sci. III , 2000, 323 (11), s. 1019-1029, PMID 11144025
- A JA Briggs, T. Wilk, SD Fuller: medierer lipidflåter virusmontering og pseudotyping? J. General Virology , 2003, 84 (Pt 4), s. 757-768 (Gjennomgang PMID 12655075 )
- Drag J. Dragunova et al.: Fenotypisk blanding mellom vesikulær stomatitt og Uukuniemi-virus . I: Acta Virol. , 1986, 30 (6), s. 512-514, PMID 2881472
- ^ WR Moorer: Antiviral aktivitet av alkohol for desinfisering av overflaten. Int. J. Dent. Hyg. , 2003) 1 (3), s. 138–142 (Gjennomgang PMID 16451513 )
- ↑ B. Horowitz et al. Virus av løsningsmiddel-detergentbehandlet blodprodukter . I: Dev. Biol. Stand. , 1993, 81, s. 147-161 (gjennomgang PMID 8174797 )






