magnesium
| eiendommer | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Som regel | |||||||||||||||||||||||||||||||||||||||||||
| Navn , symbol , atomnummer | Magnesium, Mg, 12 | ||||||||||||||||||||||||||||||||||||||||||
| Elementkategori | Jordalkalimetaller | ||||||||||||||||||||||||||||||||||||||||||
| Gruppe , periode , blokk | 2 , 3 , s | ||||||||||||||||||||||||||||||||||||||||||
| Se | sølvhvit | ||||||||||||||||||||||||||||||||||||||||||
| CAS-nummer | |||||||||||||||||||||||||||||||||||||||||||
| EF-nummer | 231-104-6 | ||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.276 | ||||||||||||||||||||||||||||||||||||||||||
| ATC-kode | |||||||||||||||||||||||||||||||||||||||||||
| Massedel av jordens konvolutt | 1,94% | ||||||||||||||||||||||||||||||||||||||||||
| Atomisk | |||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 24.305 (24.304-24.307) u | ||||||||||||||||||||||||||||||||||||||||||
| Atomeradius (beregnet) | 150 (145) pm | ||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 141 pm | ||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-radius | 173 | ||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfigurasjon | [ Ne ] 3 s 2 | ||||||||||||||||||||||||||||||||||||||||||
| 1. Ioniseringsenergi | 7..646 236 (4) eV ≈ 737.75 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| 2. Ioniseringsenergi | 15..035 271 (6) eV ≈ 1 450.68 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| 3. Ioniseringsenergi | 80.1436 (6) eV ≈ 7 732.68 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| 4. Ioniseringsenergi | 109.2654 (12) eV ≈ 10 542.51 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| 5. Ioniseringsenergi | 141.33 (3) eV ≈ 13 636 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| Fysisk | |||||||||||||||||||||||||||||||||||||||||||
| Fysisk tilstand | fast | ||||||||||||||||||||||||||||||||||||||||||
| Krystallstruktur | sekskantet | ||||||||||||||||||||||||||||||||||||||||||
| tetthet | 1.738 g / cm 3 (20 ° C ) | ||||||||||||||||||||||||||||||||||||||||||
| Mohs hardhet | 2.5 | ||||||||||||||||||||||||||||||||||||||||||
| magnetisme | paramagnetisk ( Χ m = 1,2 · 10 −5 ) | ||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 923 K (650 ° C) | ||||||||||||||||||||||||||||||||||||||||||
| kokepunkt | 1383 K (1110 ° C) | ||||||||||||||||||||||||||||||||||||||||||
| Molar volum | 14.00 10 −6 m 3 mol −1 | ||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 132 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||
| Fusjonsvarme | 8,7 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighet | 4602 m s −1 ved 293.15 K. | ||||||||||||||||||||||||||||||||||||||||||
| Spesifikk varmekapasitet | 1023 J kg −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||
| Arbeidsfunksjon | 3,66 eV | ||||||||||||||||||||||||||||||||||||||||||
| Elektrisk ledningsevne | 22,7 · 10 6 A · V −1 · m −1 | ||||||||||||||||||||||||||||||||||||||||||
| Termisk ledningsevne | 160 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||
| Kjemisk | |||||||||||||||||||||||||||||||||||||||||||
| Oksidasjonstilstander | 1, 2 | ||||||||||||||||||||||||||||||||||||||||||
| Normalt potensiale | −2,372 V (Mg 2+ + 2 e - → Mg) | ||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1,31 ( Pauling skala ) | ||||||||||||||||||||||||||||||||||||||||||
| Isotoper | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| For andre isotoper se liste over isotoper | |||||||||||||||||||||||||||||||||||||||||||
| NMR- egenskaper | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| sikkerhetsinstruksjoner | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
|
Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . | |||||||||||||||||||||||||||||||||||||||||||
Magnesium er et kjemisk element med grunnstoffsymbolet Mg ( alkymi : ⚩) og atomnummeret 12. I det periodiske elementet er det i den andre hovedgruppen eller den andre IUPAC-gruppen og tilhører dermed jordalkalimetallene .
Magnesium er en av de ti mest vanlige elementer i den jordskorpen . Det forekommer i mange mineraler så vel som i bladgrønne av planter.
historie

Opprinnelsen til elementbetegnelsen presenteres annerledes i litteraturen:
- fra gammelgresk μαγνησία λίθος som betyr "magnetisk stein",
- av Magnisia , et område i det østlige Hellas ,
- fra Magnesia , en by i Lilleasia i det som nå er Tyrkia.
Imidlertid synes alle de oppgitte avledninger etymologisk å komme fra magneter eller deres eponyme helt Magnes .
Magnesiumforbindelser var kjent og ble brukt århundrer før produksjonen av elementært magnesium. Magnesia alba refererte til magnesiumkarbonat , mens magnesia var det vanlige navnet på magnesiumoksid .
Den skotske fysikeren og kjemikeren Joseph Black var den første som systematisk studerte magnesiumforbindelser på 1700-tallet. I 1755 anerkjente han i sitt arbeid De humore acido a cibis orto et Magnesia alba forskjellen mellom kalk ( kalsiumkarbonat ) og magnesia alba (magnesiumkarbonat), som ofte ble forvirret på den tiden. Han forstod Magnesia alba som karbonat av et nytt element. Det er derfor Black ofte blir sitert som oppdageren av magnesium, selv om han aldri representerte elementært magnesium.
I 1808 skaffet Sir Humphry Davy magnesium ved elektrolyse av fuktet magnesiumhydroksid ved hjelp av en voltaisk askesøyle - ikke i ren form, men som et amalgam , da han jobbet med en katode laget av kvikksølv . Han viste at magnesia er oksidet av et nytt metall som han opprinnelig kalte magnium .
I 1828 lyktes den franske kjemikeren Antoine Bussy i å produsere små mengder rent magnesium ved å varme opp tørt magnesiumklorid med kalium som reduksjonsmiddel. I 1833 var Michael Faraday den første til å produsere magnesium gjennom elektrolyse av smeltet magnesiumklorid. Basert på disse eksperimentene jobbet den tyske kjemikeren Robert Wilhelm Bunsen i 1840- og 1850-årene med prosesser for produksjon av magnesium ved elektrolyse av smeltede salter ved hjelp av Bunsen- elementet han hadde utviklet . I 1852 utviklet han en elektrolysecelle for produksjon av store mengder magnesium fra smeltet, vannfritt magnesiumklorid. Denne prosessen har vært foretrukket den dag i dag for produksjon av magnesium.
Den tekniske produksjonen av magnesium startet i Frankrike i 1857 ved hjelp av en prosess av Henri Etienne Sainte-Claire Deville og H. Caron. I den såkalte Deville-Caron-prosessen reduseres en blanding av vannfritt magnesiumklorid og kalsiumfluorid med natrium . I England begynte Johnson Matthey å produsere magnesium ved hjelp av en lignende prosess rundt 1860. På grunn av produksjonsvansker forble disse tidlige virksomhetene imidlertid uøkonomiske.
Hendelse

Magnesium forekommer ikke i elementær form i naturen på grunn av dets respons. Som mineral forekommer det hovedsakelig i form av karbonater , silikater , klorider og sulfater . I form av dolomitt er et magnesiummineral til og med fjelldannende, f.eks. B. i Dolomittene .
De viktigste mineralene er dolomitt CaMg (CO 3 ) 2 , magnesitt (bitter spar) MgCO 3 , olivin (Mg, Fe) 2 [SiO 4 ], enstatitt MgSiO 3 og kieseritt MgSO 4 · H 2 O.
Andre mineraler er:
- Serpentin Mg 3 [Si 2 O 5 ] (OH) 4
- Talkum Mg 3 [Si 4 O 10 ] (OH) 2
- Sepiolitt Mg 4 [Si 6 O 15 ] (OH) 2
- Schönite K 2 Mg (SO 4 ) 2 · 6 H 2 O
- Karnallitt KMgCl 3 · 6 H 2 O
- Spinell MgAl 2 O 4
Når det er oppløst i vann, forårsaker det sammen med kalsium vannhardhet . I sjøvann er det mer enn 1 kg / m³ inkludert.
Utvinning og presentasjon
Magnesium utvinnes hovedsakelig på to måter:
- Ved av smeltet salt elektrolysen av smeltet magnesiumklorid i Downs celler : Downs-celler består av store jern trau som er oppvarmet fra undersiden. Grafittstenger innebygd ovenfra fungerer som anoder , som er omgitt ved spissene av en ringformet katode . Det metalliske magnesiumet samler seg på det smeltede saltet og skummet av. Den resulterende klorgassen samles i den øvre delen av cellen og brukes igjen til å produsere magnesiumklorid fra magnesiumoksid . Kalsium og natriumklorid tilsettes det smeltede saltet for å senke magnesiumkloridets smeltepunkt.
- Ved termisk reduksjon av magnesiumoksid (Pidgeon-prosessen) helles brent dolomitt , baritt og et reduksjonsmiddel som ferrosilisium i en beholder laget av krom-nikkelstål . Den evakueres (pumpes av gassen ) og oppvarmes til 1160 ° C. Det dampige magnesiumet kondenserer på det vannkjølte hodestykket utenfor ovnen . Magnesium oppnådd i batcher blir ytterligere renset ved vakuumdestillasjon .
Pidgeon-prosessen er den viktigste produksjonsprosessen i dag og brukes hovedsakelig i Kina.
88% av den globale magnesiumproduksjonen finner sted i Kina, hvor rundt 800.000 tonn magnesiummetall ble produsert i 2015. Deretter følger Russland , Israel og Kasakhstan, hver med en markedsandel på bare noen få prosent .
Den produksjon av 1 kg magnesium av Pidgeon-prosessen produserer drivhusgasser med en CO 2 tilsvarer omtrent 31 kg (for sammenligning: 1 kg stål produserer mellom 0,5 og 2 kg CO 2 ekvivalenter).
Selv om magnesium finnes i mer enn 60 mineraler, er det bare dolomitt , magnesitt , brucitt , karnallitt , talkum og olivin som er av kommersiell betydning.
Mg 2+ - kationen er i sjøvann nest mest rikholdige kation, som sjøvann og havsalt gjør dem til attraktive kommersielle kilder til magnesium. For å ekstrahere det tilsettes kalsiumhydroksid til sjøvann for å danne et bunnfall av magnesiumhydroksid .
Magnesiumhydroksid (brucitt) er uoppløselig i vann og kan filtreres av og reageres med saltsyre for å danne konsentrert magnesiumklorid .
Ved elektrolyse oppstår magnesiumklorid magnesium.
eiendommer
Det faste, sølvfarvede, skinnende lette metallmagnesiumet er rundt en tredjedel lettere enn aluminium . Rent magnesium har dårlig styrke og hardhet. Dens elastisitetsmodul er omkring 45 GPa. I luft er magnesium dekket med et oksydlag som i motsetning til aluminium ikke er helt ugjennomsiktig. Grunnen til dette er at magnesiumoksidet har et mindre molart volum enn magnesium selv (MgO: 10,96 cm 3 / mol, Mg: 13,96 cm 3 / mol); se forholdet Pilling-Bedworth .
Tynne bånd eller folier er lette å antenne. Den brenner i luften med en lys hvit flamme for å danne magnesiumoksid MgO og litt magnesiumnitrid Mg 3 N 2 . Nyprodusert magnesiumpulver kan varme opp i luften til det spontant antennes. Det kan forventes farlige reaksjoner ved høyere temperaturer, dvs. spesielt med smeltede væsker. Magnesium brenner også i mange oksider som karbonmonoksid , nitrogenoksid og svoveldioksid .
Magnesium reagerer med vann og danner hydrogen:
- Reaksjon av magnesium med vann
Et lite løseløst belegg av magnesiumhydroksid dannes , noe som i stor grad bringer reaksjonen til stillstand ( passivering ). Selv svake syrer , som ammoniumsalter , er tilstrekkelig til å oppløse hydroksydlaget, da de omdanner hydroksydionene til vann og det dannes løselige salter. Uten passivering er den eksoterme reaksjonen voldelig; jo finere magnesiumstøv, jo mer voldsom er det. Med luft danner frigjort hydrogen lett en eksplosiv blanding ( oxyhydrogen ).
Magnesium reagerer eksotermt med karbondioksid og danner magnesiumoksid og karbon:
Reaksjon av magnesium med karbondioksid
Derfor slukker ikke karbondioksid magnesiumbranner, men gir heller drivstoff.
I motsetning til aluminium er den relativt motstandsdyktig mot flussyre og baser . Grunnen til dette er den lave oppløselighet av magnesiumfluorid (MGF 2 ) er utformet som et belegg, som forhindrer ytterligere dannelse av Mg (OH) 3 - ioner.
Isotoper
Totalt er 21 isotoper mellom 19 mg og 40 mg magnesium kjent. Av disse tre er isotopene 24 mg, 25 mg og 26 mg stabile og forekommer i naturen. Isotopen med den største andelen av den naturlige isotopiske sammensetningen er 24 mg med 78,99%, 25 mg har en andel på 10,0% og 26 mg på 11,01%. De lengstlevende ustabile isotopene er 28 Mg, som konverterer til 28 Al med en halveringstid på 20,915 timer med beta- forfall , og 27 Mg, som også forfaller til 27 Al med en halveringstid på 9,435 minutter med beta- forfall. Alle andre isotoper har bare korte halveringstider på sekunder eller millisekunder.
bruk
Metallisk magnesium
Magnesiumpulver og ledning brukes i branninnretninger, bomber og blussammunisjon, og tidligere også brukt som lommelyktpulver . Magnesiumstenger fungerer ofte som offeranoder , som beskytter deler laget av edle metaller mot korrosjon .
I metallurgi brukes magnesium på en allsidig måte,
- z. B. som et reduksjonsmiddel i Kroll-prosessen for ekstraksjon av titan ,
- som et reduksjonsmiddel for ekstraksjon av uran , kobber , nikkel , krom og zirkonium ,
- som en komponent av aluminiumlegeringer i gruppene AlSiMg og AlMg,
- som magnesiumgranulat for avsvovling av jern og stål ,
- som tilsetningsstoff for nodulært støpejern
Magnesium er basert på en gruppe standardiserte lette legeringer for konstruksjon av fly og motorvogner (som smelter krever et dekkende lag av smeltet magnesiumklorid for å beskytte mot eksponering for luft og oksidasjon, s. Smeltebehandling ), se også elektron (Materiale)
En annen applikasjon er fakler som brenner under vann.
I organisk kjemi brukes det til å produsere Grignard-forbindelser .
Fordi magnesium antennes veldig lett, brukes det også som en lighter som fungerer selv under ugunstige forhold. Magnesiumblokkene som selges som Fire Starter Kits leveres med en flint , hvis slitasje antennes spontant i luften. Fremgangsmåten ligner steinaldermetoden for å tenne bål med flint og tinder , med magnesium som tar over rollen som tinder. Først blir chips skrapt av magnesiumblokken med en kniv og plassert på eller under selve drivstoffet. Ved å skrape flinten (f.eks. Med knivens bakside) genereres gnister så nær magnesiumflisen som mulig for å antenne dem.
Magnesiumlegeringer
Den viktigste egenskapen til magnesiumlegeringer, som har gjort dem viktige sammenlignet med aluminium og dens legeringer, er den lette konstruksjonen de tillater. Med en tetthet på rundt 1,75 g / cm³ er forskjellen til lett aluminium med en tetthet på rundt 2,75 g / cm³ tydelig. I tillegg er smelteområdet mellom 430 og 630 ° C, noe som er lavere for å spare energi. Imidlertid er de mekaniske egenskapene som strekkfasthet og hardhet betydelig lavere enn aluminiumlegeringer . Den lave tettheten gjorde magnesium interessant for mobile applikasjoner på et tidlig stadium. Den første store søknaden fant sted før første verdenskrig i byggingen av stillaset for de stive Zeppelin-luftskipene . Magnesiumlegeringer ble brukt i motorkjøretøyer for produksjon av husdeler og for produksjon av hjulfelger til alle slags mobiler. Etter 1930 ble magnesiumlegeringer i økende grad brukt i flykonstruksjon fordi vektbesparelsene de gjorde tillot mer energieffektive flyvninger som samt høyere nyttelast. Alt dette førte til en rask utvidelse av magnesiumproduksjonen i Tyskland ( elektron fra den kjemiske fabrikken i Griesheim ) og etter 1940 også i USA. Rett etter produksjonsstart ble "Elektron" det varemerkebeskyttede navnet på de første magnesiumlegeringene.
Andre mulige bruksområder for magnesiumstøpegods ga seg i løpet av den tekniske utviklingen, delvis på grunn av krigen, delvis konstruktivt framsynt og samtidig optimalisert legeringene. Legeringene Mg-Al, Mg-Mn, Mg-Si, Mg-Zn og til slutt Mg-Al-Zn-legeringer ble utviklet som magnesiumbaserte materialer.

Den transmisjonshuset av den VW Beetle ble støpt i millioner fra en Mg-Si-legering. I dag brukes magnesiumlegeringer ikke bare for å spare vekt, men er også preget av høy demping. Når det utsettes for vibrasjoner, fører dette til en reduksjon i vibrasjoner og støyutslipp. Av denne grunn har også magnesiumlegeringer blitt interessante materialer i motorkonstruksjonen, som i bilkonstruksjon generelt. Så deler er ikke bare motoren av magnesiumlegering, men i økende grad også for støping av motorblokker hybridprosess / hybridstøping som brukes for første gang i volumproduksjon i Alfa Romeo 156 og senere hos BMW (se også BMW N52 ).

I støpeprosessen (se også under støpegods ) kan mange tynnveggede komponenter, inkludert store områder, produseres nær deres endelige dimensjoner og uten kostbar etterbehandling. B. felger, profiler, hus, dører, hetter, koffertlokk, håndbremsespaker og andre. Deler laget av Mg-Al-Zn-legeringer brukes ikke bare i bilteknikk, men også i maskinteknikk.
Arbeidet mot lett konstruksjon førte allerede til magnesium-litiumlegeringer på slutten av 1900-tallet , til og med lettere legeringer laget av magnesium med tilsetning av litium .
Magnesiummaterialer i medisin
Den siste forskningen lover et høyt utviklingspotensial for magnesiummaterialer som resorberbart implantatmateriale (f.eks. Som en stent ) for menneskekroppen. Magnesiummaterialer må beskyttes mot korrosjon under bruk. Den korrosjonsmotstand til normale atmosfæriske påvirkninger, men er god. Kontaktkorrosjon vil være en avgjørende fordel hvis det brukes som et implantatmateriale som skal brukes i en begrenset periode, siden det vil oppløses trygt etter en viss tid. Dette eliminerer risikoen og kostnadene ved å fjerne implantater.
fysiologi
Magnesium er et av de essensielle stoffene og er derfor uunnværlig for alle organismer. De grønne bladene av planter, klorofyll , inneholder rundt 2% magnesium. Der danner det det sentrale atomet i klorofyll. I magnesiummangel etiolate planter så vel som med mangel på lys. Menneskekroppen må også forsynes med tilstrekkelige mengder magnesium daglig for å forhindre magnesiummangel.
En voksnes kropp inneholder rundt 20 g magnesium (til sammenligning: 1000 g kalsium ). I blodplasmaet er 40% av magnesium bundet til proteiner; det normale serumnivået er 0,8-1,1 mmol / l. Magnesium er involvert i rundt 300 enzymreaksjoner som en enzymkomponent eller koenzym. I tillegg påvirker frie Mg-ioner potensialet på cellemembranen og fungerer som en andre messenger i immunsystemet . De stabiliserer hvilepotensialet til spennende muskel- og nerveceller og cellene i det autonome nervesystemet . Magnesiummangel utløser rastløshet, nervøsitet, irritabilitet, mangel på konsentrasjon, tretthet, generell svakhet, hodepine , hjertearytmier og muskelkramper . Hjerteanfall kan også forekomme. I området metabolisme og psyke antas det at magnesiummangel forverrer depresjon og schizofrene psykoser . Et overskudd av magnesium i blodet kan oppstå på grunn av overdreven inntak og nedsatt nyrefunksjon og fører til forstyrrelser i nervesystemet og hjertet.
Den Magnesiumresorption første funnet i øvre tynntarm i stedet for, men i resten av fordøyelseskanalen. Det skilles ut gjennom nyrene og inneholder forskjellige mengder i all mat og drikkevann. Den nødvendige daglige dosen på rundt 300 mg oppnås vanligvis gjennom et balansert kosthold. Et økt behov kan dekkes med kosttilskudd eller medisiner . En liten magnesiummangel er mulig på grunn av alvorlig sykdom, graviditet eller konkurransesport. Alvorlige mangler oppstår med nyredysfunksjon, langvarig diaré, kronisk tarmbetennelse, dårlig kontrollert diabetes mellitus, kortikoider , visse diuretika eller alkoholisme med underernæring.
Magnesiumsalter som citrat , glukonat , aspartat og aspartat- hydroklorid er godkjent som legemidler i Tyskland i daglige doser på 100 til 400 mg mot mangler og nevromuskulære lidelser så som muskelkramper, migrene eller graviditet komplikasjoner . Bivirkninger er gastrointestinale plager og diaré, i tilfelle en overdose også tretthet og langsom puls. Kontraindikasjoner er nyresvikt og visse hjerterytmeforstyrrelser.
Når du tar magnesiumtilskudd oralt (tabletter, tygges eller pastiller, granulater som skal oppløses i væske), er doseringen viktig. Ulike studier har kommet til at rundt 35% absorberes når man tar 120 mg , men bare rundt 18% når man tar en komplett daglig dose på 360 mg. For absorpsjon i kroppen er formen av forbindelsene som brukes i dag i medikamenter irrelevant, fordi de er farmakologisk, biologisk og klinisk ekvivalente; Organiske salter som magnesiumaspartat eller magnesiumcitrat absorberes bare av kroppen raskere enn uorganiske forbindelser. På den annen side forblir det ekstra magnesium bare nyttig i kroppen hvis det er nok bindingsmolekyler tilgjengelig i kroppen; dette skjer bare ved biokjemiske justeringer etter en lengre økning i magnesiumforsyningen eller forbruket i minst fire uker.
Magnesiumsulfat ("Epsom salt") ble tidligere brukt som avføringsmiddel og brukes til å behandle hjerterytmeforstyrrelser.
Magnesiumsalter brukes i alternativ medisin .
Mat
Magnesium tjener som en kofaktor for rundt 300 forskjellige proteiner , særlig i ATP og nukleinsyre- bindende enzymer . Det anbefalte daglige inntaket av magnesium for mennesker er mellom 24 og 400 mg per dag, avhengig av alder og kjønn.
Magnesium forekommer som en forbindelse som i mange matvarer, særlig i helkornprodukter (for eksempel helkornbrød , fullkorn pasta , hele korn ris , havreflak , corn flakes ), mineralvann , spesielt medisinsk vann , vann fra springen med tilstrekkelig vann hardhet , lever , fjærfe , bordfisk , gresskarfrø , solsikkefrø , sjokolade , cashewnøtter , peanøtter , poteter , spinat , kålrabi , bær , appelsiner , bananer , sesamfrø , betesirup , melk og meieriprodukter .
Fare og beskyttelsestiltak
Farligheten med elementært magnesium avhenger sterkt av temperaturen og partikkelstørrelsen: kompakt magnesium er ufarlig ved temperaturer under smeltepunktet, mens magnesiumspon og pulver er svært brannfarlig . På grunn av det store overflatearealet kan sistnevnte lett reagere med oksygenet i luften. Med veldig fint magnesiumpulver er det en risiko for selvantennelse ; Luftpulverblandinger er til og med eksplosive . Flegmatisering er en risikoreduserende behandling når man behandler magnesium og metallpulver generelt. Smeltet magnesium antennes også selv i luften. Finkornet eller oppvarmet magnesium reagerer også med mange andre stoffer, for eksempel vann og andre oksygenholdige forbindelser. Magnesiumsmelter krever derfor permanent beskyttelse mot inntrenging av atmosfærisk oksygen. I praksis gjøres dette ved å dekke smelten med midler som er rike på magnesiumklorid. Svovelheksafluorid er også egnet som beskyttelse mot oksidasjon. Å dekke med elementært svovel, som var vanlig tidligere, praktiseres ikke lenger på grunn av den alvorlige plagen forårsaket av svoveldioksidet som produseres.
Temperaturer opp til rundt 3000 ° C forekommer i magnesiumbranner. Under ingen omstendigheter må vanlige slokkingsmidler som vann , karbondioksid , skum eller nitrogen brukes, da magnesium reagerer voldsomt med disse. Hvis vann kommer i kontakt med magnesiumbrann, er det en akutt risiko for en oksyhydrogenreaksjon .
For brannen ( metallbrannen ) i en smelte gjelder slukkingsprinsippet for kvelning, dvs. den raske forskyvningen av oksygen. I det enkleste tilfellet ved å dekke med tørr sand, ellers ved å påføre et dekkesalt for magnesiumsmelting. Slokkepulver i brannklasse D, magnesiumoksidpulver ( Magnesia usta / brent magnesia ) og, om nødvendig, tørre, rustfrie grå støpejernspon er også egnet .
Når du bruker magnesium, må alle gitte sikkerhetsinstruksjoner følges nøyaktig. Det må under ingen omstendigheter oppstå en eksplosiv atmosfære (magnesiumstøv, hydrogen, aerosoler og damper av brennbare kjølesmøremidler). De normale sikkerhetstiltakene , slik som å unngå antenningskilder , må også overholdes.
bevis
Den beste måten å detektere magnesium er ved hjelp av Magneson II , titan gul eller quinalizarin .
For påvisning med Magneson II (4- (4-nitrofenylazo) -1-naftol) er den opprinnelige substansen oppløst i vann og gjort alkalisk. Deretter tilsettes noen få dråper av en løsning av azofargestoffet Magneson II. Hvis magnesiumioner er til stede, opprettes en mørkeblå lakk. Andre jordalkalimetaller bør først fjernes som karbonater ved utfelling.
For påvisning med titangult ( tiazolgult G) blir den opprinnelige substansen oppløst i vann og forsuret. Deretter blandes den med en dråpe av den titangule løsningen og gjøres alkalisk med fortynnet natriumhydroksydoppløsning. Hvis magnesium er tilstede, dannes et lysrødt bunnfall. Nikkel-, sink-, mangan- og koboltioner forstyrrer denne påvisningen og bør utfelles som sulfider på forhånd.
For påvisning med quinalizarin tilsettes to dråper av fargestoffoppløsningen til den sure prøveoppløsningen. Deretter tilsettes fortynnet natriumhydroksydløsning til reaksjonen er basisk. En blå farge eller nedbør indikerer magnesium.
Dannelsen av utfellinger med fosfatsaltløsninger kan også brukes som en påvisningsreaksjon for magnesiumsalter. Den tungmetallfrie prøveoppløsningen, bufret til pH 8 til 9 med ammoniakk og ammoniumklorid, blandes med dinatriumhydrogenfosfatoppløsning . En hvit, syreoppløselig uklarhet som skyldes magnesium-ammoniumfosfat MgNH 4 PO 4 viser magnesiumioner:
Fra ammoniakkløsning kan Mg 2+ også påvises med oksin som en dårlig løselig gulgrønn forbindelse. Dette beviset er egnet for kationeseparasjonsprosessen .
lenker
I forbindelser forekommer magnesium nesten utelukkende som et divalent kation med oksidasjonstilstanden 2.
Oksider og hydroksider
Magnesiumoksid (magnesia) danner fargeløse krystaller av natriumklorid - struktur . I naturen forekommer det som en vulkansk mineral periklas . De er hvite til grå, på grunn av inneslutninger også mørkegrønne, glassglansende vanlige krystaller.
Magnesia pulver tilsettes matvarer som surhetsregulator eller separasjonsmiddel . Ulike varmebestandige gjenstander for laboratorier og industri er laget av keramikk av magnesiumoksid .
Magnesiumhydroksyd er et fargeløst, sterkt basisk salt og opptrer naturlig som mineralet brucitt . Den har en trigonal krystallstruktur i romgruppen P 3 m 1 (romgruppe nr. 164) og brukes som tilsetningsolje for matolje (for binding av svoveldioksid ), som flokkuleringsmiddel for behandling av avløpsvann , som flammehemmere i termoplastisk plast. ( polyolefiner , polyvinylklorid ) og elastomerer , samt tilsetningsstoff som brukes i vaskemidler . I medisinen er det brukt som et syrenøytraliserende for å nøytralisere den magesyre og som en mild avføringsmiddel som brukes.
Magnesiumperoksid er en fint pulverisert, fargeløs forbindelse som har en pyrittkrystallstruktur i romgruppe Pa 3 (romgruppe nr. 205) . Det ligner kalsiumperoksid og frigjør oksygen gjennom en kontrollert reaksjon med vandige løsninger . Den har forskjellige bruksområder innen landbruk , legemidler og kosmetikk .
gjødsel
Når kalking åker og gressletter områder brukes magnesium i form av magnesiumoksyd eller magnesiumkarbonat for å kompensere for den magnesium berøvelse av jord av planter . Videre økes jordens pH- verdi og tilgjengeligheten av ytterligere næringsstoffer forbedres. Magnesiumforbindelsen brukes vanligvis sammen med kalk som en kompleks gjødsel som inneholder magnesium og kalsium . Magnesiumfosfat Mg 3 (PO 4 ) 2 ( trimagnesiumfosfat ), som forekommer naturlig som Bobierrite, og magnesiumnitrat brukes også som komplekse gjødsel.
Halider

Magnesiumklorid er svært hygroskopisk og forekommer naturlig i mineralet bishopite ( MgCl 2 · 6 H 2 O), som dobbeltsalt karnallitt (KMgCl 3 · 6 H 2 O), i sjøvann og i saltvann . Det krystalliserer seg i det trigonale krystallsystemet i romgruppen R 3 m (romgruppe nr. 166) . I matteknologi brukes den som en syreregulator , oppstrammende middel , smakforsterker , bærer eller separasjonsmiddel . Som et termisk batteri, magnesiumklorid- heksahydrat kan lagre og frigjøring av varmeenergi .
Magnesiumfluorid danner fargeløse krystaller som krystalliserer tetragonalt i rutilstrukturen i romgruppen P 4 2 / mnm (romgruppe nr. 136) romgruppe . Dens optiske egenskaper, sammen med den kjemiske stabiliteten, gjør det til et viktig materiale for optiske applikasjoner.
Magnesiumbromid og magnesiumjodid er også hygroskopiske salter som har en trigonal krystallstruktur i romgruppen P 3 m 1 (romgruppe nr. 164) .
Andre uorganiske forbindelser
Magnesiumkarbonat forekommer naturlig i store mengder som magnesitt (bitter spar). Det krystalliserer trigonally i romgruppe R 3 c (romgruppe nr. 167) . I næringsmiddelindustrien tilsettes det som en surhetsregulator , bærer eller slippmiddel . Den brukes i klatring og gymnastikk og er også kjent under navnene magnesia og kritt . De utøverne tørk i det før i begynnelsen av øvelsen håndflatene slik at hennes hud mens dekker barer av bullion eller jernstenger av strekk eller lang dumbbell ikke så ansvarlig. Det har også medisinsk og industriell bruk.
Magnesiumnitrat er et fargeløst, hygroskopisk salt som er lett løselig i vann . Den heksahydrat (Mg (NO 3 ) 2 · 6 H 2 O) har en monoklinisk krystallstruktur med romgruppen P 2 1 / c (romgruppe nr. 14) . Den brukes som gjødsel , latent varmelagring (som heksahydrat) eller i keramikkindustrien .
Magnesiumsulfatheptahydrat (Mg (SO 4 ) 7H 2 O) er kjent som mineralet epsomitt (Epsom salt). Den danner fargeløse krystaller som danner et rombisk pseudotetragonal krystallgitter . Krystallene blomstrer ofte i fiberaktige aggregater og danner stalaktitter . Den brukes til gjødsel , som et tørkemiddel og til medisinske applikasjoner.
Magnesiumfosfater (magnesiumdihydrogenfosfat (Mg (H 2 PO 4 ) 2 ), magnesiumhydrogenfosfat (MgHPO 4 ) og magnesiumfosfat (Mg 3 (PO 4 ) 2 )) brukes i industrien som keramiske råvarer og som flammehemmere . I næringsmiddelindustrien brukes de som tilsetningsstoff , avføringsmiddel og tilsetningsstoff . De tilsettes matvarer som surhetsregulatorer eller frigjøringsmidler.
Spinell er en hyppig forekommende mineral fra mineral klasse av oksyder og hydroksyder med den idealiserte kjemiske sammensetning MgAl 2 O 4 og er derfor en magnesium- aluminat fra et kjemisk synspunkt syn . Den krystalliserer isotypisk med magnetitt i det kubiske krystallsystemet i romgruppen Fd 3 m (romgruppe nr. 227) .
Dolomitt er et veldig vanlig mineral fra mineralklassen karbonater og nitrater med den kjemiske sammensetningen CaMg [CO 3 ] 2 og er derfor kjemisk et kalsium- magnesiumkarbonat. Det krystalliserer i den trigonal i romgruppe R 3 (romgruppe nr. 148) .
Magnesiumhydrid kan brukes til å lagre hydrogen og energi . Ved hydrogen , som frigjøres fra magnesiumhydrid , dannes et metallskum med interessante egenskaper som er lettere enn vann .
Andre interessante krystallinske magnesiumforbindelser er for eksempel magnesiumdiborid , magnesiumkarbid , magnesiumnitrid , magnesiumsulfid , magnesiumsilicid , magnesiumgermanid , magnesiummetasilikat , magnesiumtitanoksid og magnesiumpolonid .
Magnesium organyls
Magnesiumorganyler er organometalliske forbindelser der det er en binding mellom magnesium og karbon . Blant magnesiumorganylene er Grignard-forbindelser ( R -Mg- X ) uten tvil de viktigste. Binære organyler av magnesium og alkenylmagnesiumhalogenider spiller en tydelig underordnet rolle.
Organylmagnesiumhalogenider
Organylmagnesiumhalogenider (vanligvis kalt Grignard-forbindelser ) oppnås i en direkte prosess gjennom reaksjon av organylhalogenider med magnesiumspon. Grignard-reagenser er i oppløsning i Schlenk-likevekt . De reagerer med halogen - organyl - erstatning med grunnorganer:
Som regel:
z. B .:
eller med tilsetning av organyler med flere bindingssystemer :
Som regel:
z. B.:
Binære organyler av magnesium
Binær magnesium- organyls (R 2 Mg, også kalt magnesium diorganyls) kan fremstilles på forskjellige måter:
- gjennom transmetalisering , for eksempel av kvikksølv-diorganyler:
- på grunn av dismutasjon når Schlenk-likevekten forskyves ved hjelp av 1,4-dioksan :
- Magnesacycles ( sykliske alkaner med magnesium i ringen) kan også fremstilles ved hjelp av 1,4-dioksan .
- ved metatese av Grignard-forbindelser med litiumorganyler
- ved hydromagnesering (tilsetning av MgH 2 til 1-alkener):
- på grunn av tilsetning av elementært magnesium til C = C dobbeltbindinger i noen umettede hydrokarboner som 1,3-butadien eller antracen (metalltilsetning). For eksempel er reaksjonen av 1,3-butadien i tetrahydrofuran mulig ved romtemperatur :
- Magnesiumbutadien som er produsert, og (2-buten-1,4-diyl) magnesium nevnt, kan brukes som kilde til butadien - anioner i ytterligere synteser blir brukt. Det orangegule magnesiumantracenet vises analogt . Magnesium antracen kan deretter brukes som katalysator for hydrogenering av magnesium.
Alkenylmagnesiumhalogenider
I det som er kjent som karbomagnesering reagerer alkyner med alkyner for å danne alkenylmagnesiumhalogenider:
Andre organiske forbindelser
Magnesiumhydrogencitrat og trimagnesiumdicitrat er magnesiumsalter av sitronsyre . Magnesiumcitrat brukes som medisin .
Magnesiummonoperoksyftalat er et desinfeksjonsmiddel for overflatedesinfeksjon .
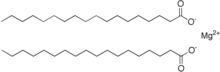
Magnesiumstearat er magnesiumsaltet av stearinsyre og er en av kalksåpene . Den består av en magnesium- ioner og to langkjedede stearat- ioner.
weblenker
Individuelle bevis
- ↑ a b Harry H. Binder: Leksikon av de kjemiske elementene. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Verdiene for egenskapene (infoboks) er hentet fra www.webelements.com (magnesium) , med mindre annet er oppgitt .
- ↑ IUPAC, standard verdi som anbefales av IUPAC er gitt, ettersom den isotopiske sammensetning av dette element kan variere lokalt, bør masseområdet som er angitt i parentes resultater for den midlere atomvekt. Standard Atomic Weights Revised 2013 .
- ↑ a b c d e entry on magnesium in Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Red.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Hentet 11. juni 2020.
- B a b c d e entry on magnesium at WebElements, https://www.webelements.com , åpnet 11. juni 2020.
- ^ NN Greenwood, A. Earnshaw: Elementets kjemi. 1. utgave. VCH, Weinheim 1988, ISBN 3-527-26169-9 , s. 136.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Magnetic Susceptibility of the Elements and Inorganic Compounds, s. 4-144. Verdiene der er basert på g / mol og er gitt i cgs-enheter. Verdien gitt her er SI-verdien beregnet ut fra den, uten en måleenhet.
- ^ A b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. I: Journal of Chemical & Engineering Data. Volum 56, 2011, s. 328-337, doi: 10.1021 / je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Textbook of Experimental Physics. Volum 6: faste stoffer. 2. utgave. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , s. 361.
- ↑ A. Stasch, C. Jones: Stabile dimere magnesium (I) forbindelser: fra kjemiske landemerker til allsidig reagenser. I: Dalton Transaksjoner . Volum 40, 2011, s. 5659-5672, doi: 10.1039 / C0DT01831G .
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Electrochemical Series, s. 8-22.
- ↑ a b Oppføring av magnesium, pulver, ikke stabilisert i GESTIS stoffdatabase til IFA , åpnet 9. august 2016. (JavaScript kreves)
- ↑ Oppføring av magnesium i Klassifiserings- og merkelisten til European Chemicals Agency (ECHA), tilgjengelig 1. august 2016. Produsenter eller distributører kan utvide den harmoniserte klassifiseringen og merkingen .
- ↑ Definisjon av tegn 26A9 (Hex) som magnesium i Unicode Standard, versjon 5.2 (PDF; 291 kB).
- ^ US Geological Survey, Mineral Commodity Summaries, januar 2016
- ↑ Volker Hasenberg: Livssyklusanalyse og økologisk evaluering av magnesiumproduksjon. PE INTERNATIONAL, Materials Forum for Intelligent Lightweight Trees 24. april 2012, Hannover Fair.
- ↑ Reaksjonen mellom magnesium og CO 2 . Purdue University, åpnet 15. juni 2016 .
- ↑ G. Audi, FG Kondev, Meng Wang, WJ Huang, S. Naimi: Den NUBASE2016 evaluering av kjernefysiske egenskaper. I: Chinese Physics C. 41, 2017, S. 030001, doi: 10.1088 / 1674-1137 / 41/3/030001 (fulltekst)
- ↑ FY Li, B. Chaigne-Delalande et al .: Andre messenger-rolle for Mg 2+ avslørt av human T-celleimmunmangel. I: Natur. Volum 475, nummer 7357, juli 2011, s. 471-476; doi: 10.1038 / nature10246 . PMID 21796205 ; PMC 3159560 (fri fulltekst).
- ↑ a b c Sighart Golf: Biotilgjengelighet av organiske og uorganiske forbindelser. I: Farmasøytisk avis . Juli 2009, åpnet 4. mars 2015 .
- ^ R. Swaminathan: Magnesiummetabolisme og dens lidelser. I: Clin Biochem Rev. 24 (2), mai 2003, s. 47-66. PMID 18568054 .
- ↑ z. B. Kenneth D Fine, Carol A Santa Ana, Jack L Porter, John S Fordtran: Tarmabsorpsjon av magnesium fra mat og kosttilskudd. I: J Clin Invest . Volum 88 (2), august 1991, s. 396-402, PMC 295344 (gratis fulltekst, PDF), doi: 10.1172 / JCI115317 .
- ↑ Se for eksempel K. Knudsen, J. Abrahamson: Antiarytmiske effekter av magnesiumsulfat. Rapport om tre saker. I: Acta Anesthesiologica Scandinavica. Volum 39, nr. 6, (København) 1995, s. 850.
- ↑ German Nutrition Society : Referanseverdiene for næringsinntak: Magnesium . Hentet 20. oktober 2013.
- Try Inntasting av magnesiumhydroksid. I: Römpp Online . Georg Thieme Verlag, åpnet 13. juni 2014.
- Bra Georg Brauer (red.), Med samarbeid mellom Marianne Baudler og andre: Handbook of Preparative Inorganic Chemistry. 3., reviderte utgave. Volum II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s. 907.
- ↑ Kalking av dyrkbar mark og gressletter. (PDF; 43 kB) (Ikke lenger tilgjengelig online.) DLR Rheinhessen-Nahe-Hunsrück, arkivert fra originalen 14. februar 2016 ; åpnet 14. februar 2016 .
- ↑ Science-Online-Lexica: Magnesiumfosfat. I: Lexicon of Chemistry. Hentet 26. mai 2011.
- Try Inntasting av magnesiumnitrat. I: Römpp Online . Georg Thieme Verlag, åpnet 26. mai 2011.
- ↑ Varmelagring laget av salt . Artikkel fra 2012.
- ↑ Oppføring for CAS-nr. 7783-40-6 i GESTIS stoffdatabase til IFA , åpnet 17. oktober 2012. (JavaScript kreves)
- ^ MA Brogan, AJ Blake, C. Wilson, DH Gregory: Magnesium diiodide, MgI 2 . I: Acta Crystallographica , C59, 2003, s. I136-i138, doi: 10.1107 / S0108270103025769 .
- ^ Hans Lohninger: Magnesia for idrettsutøvere. Hentet 6. juli 2019 .
- ↑ Oppføring av magnesiumnitrat i GESTIS stoffdatabase til IFA , åpnet 23. juli 2016. (JavaScript kreves)
- ↑ Spinel. I: mindat.org. Hudson Institute of Mineralogy, åpnet 15. mai 2019 .
- ^ Hugo Strunz , Ernest H. Nickel : Strunz Mineralogical Tables. Kjemisk-strukturelt mineral klassifiseringssystem . 9. utgave. E. Schweizerbart'sche Verlagbuchhandlung (Nägele og Obermiller), Stuttgart 2001, ISBN 3-510-65188-X , s. 188 .
- ^ Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Kjemisk-strukturelt mineral klassifiseringssystem . 9. utgave. E. Schweizerbart'sche Verlagbuchhandlung (Nägele og Obermiller), Stuttgart 2001, ISBN 3-510-65188-X , s. 287 .
- ↑ Reuben D. Rieke: Fremstilling av svært reaktive metallpulver og deres bruk i organisk og organometallisk syntese. I: Accounts of Chemical Research. Volum 10, nummer 8, august 1977, s. 301-306, doi: 10.1021 / ar50116a005 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Lærebok for uorganisk kjemi . 102. utgave. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 1233.
- ↑ Christoph Elschenbroich : Organometallchemie . 6., revidert utgave. Vieweg + Teubner, 2008, ISBN 978-3-519-53501-0 ( forhåndsvisning av bok i Google-boksøk).
- ↑ Yukitami Saheki, Katsuhiko Sasada, Nobumasa Satoh, Noriyuki Kawaichi, Kenji Negoro: En praktisk fremstilling av rent dialkylmagnesium fra et Grignard-reagens. I: Chemistry Letters. Volum 16, 1987, s. 2299-2300, doi: 10.1246 / kl.1987.2299
- ↑ Borislav Bogdanovic: Magnesium antracensystemer og deres anvendelse i syntese og katalyse. I: Kontoer for kjemisk forskning. Volum 21, nummer 7, juli 1988, s. 261-267, doi: 10.1021 / ar00151a002 .
- ↑ K. Fujita, Y. Ohnuma, H. Yasuda, H. Tani: Magnesium-butadien-addisjonsforbindelser: Isolation, strukturell analyse og kjemisk reaktivitet. I: Journal of Organometallic Chemistry. Bind 113, nummer 3, juni 1976, s. 201-213, doi: 10.1016 / S0022-328X (00) 87329-5 .
- ↑ Ramsden, HE 63: US Patent 1967, 3, 354, 190.
- Try Inntasting av organiske magnesiumforbindelser. I: Römpp Online . Georg Thieme Verlag, åpnet 26. mai 2014.
- ↑ Franz v. Bruchhausen, Siegfried Ebel, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers håndbok for farmasøytisk praksis, bind 5: stoffer LZ . Springer-Verlag, 2013, ISBN 978-3-642-58388-9 , pp. 86 ( begrenset forhåndsvisning i Google Book-søk).