Hepatitt C-virus
| Hepatitt C-virus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
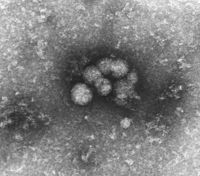
HCV-virioner fra serum | ||||||||||||||||||
| Systematikk | ||||||||||||||||||
| ||||||||||||||||||
| Taksonomiske egenskaper | ||||||||||||||||||
| ||||||||||||||||||
| Vitenskapelig navn | ||||||||||||||||||
| Hepacivirus C | ||||||||||||||||||
| Kort navn | ||||||||||||||||||
| HCV | ||||||||||||||||||
| Venstre | ||||||||||||||||||
|
Den hepatitt C-viruset er et omhyllet , enkelt-trådet RNA-virus med positiv polaritet (ss (+) RNA ), og er det forårsakende middel for hepatitt C . Det er det eneste kjente RNA-viruset som (uten å være et retrovirus ) kan forårsake en kronisk smittsom sykdom. Ved diagnose , sykdommer og forhindring se Hepatitt C .
Selv om et smittsomt middel hadde vært kjent for å forårsake det som den gang var kjent som "Non-A-Non-B-Hepatitis" siden de første rapportene i 1974, ble ikke viruset identifisert på lang tid. Det var først etter den første påføringen av kloningsgenomfragmenter fra serumet til en sjimpanse som var kunstig infisert med HCV, at patogenet, da kjent som hepatitt C-virus, ble oppdaget i 1989 og sekvensert i 1990 . Det er også det første viruset hvis genomssekvens og virusproteiner er underlagt omfattende patentbeskyttelse, noe som gjorde utviklingen av nye testmetoder betydelig vanskeligere. Etter overtakelsen av Chiron Corporation i 2006 er patentinnehaver legemiddelselskapet Novartis .
Hepatitt C-viruset (HCV) hører sammen med hepatitt B-viruset (HBV), Epstein-Barr-viruset (EBV), det humane papillomavirus (HPV), humant T-lymfotropisk virus 1 (HTLV-1) og det humane herpesviruset 8 (HHV-8, også Kaposis sarcoma herpesvirus, KSHV) til humane virus som kan forårsake kreft. Det anslås at disse virusene er ansvarlige for 10 til 15 prosent av alle kreftformer over hele verden .
Forskere Harvey J. Alter , Michael Houghton og Charles M. Rice ble tildelt den Nobelprisen i fysiologi eller medisin for sin oppdagelse av viruset i 2020 .
Molekylbiologi
Systematikk
Gjennom sekvenssammenligning og homologien med andre virusproteiner ble HCV gruppert i Flaviviridae- familien , selv om klassifiseringen til slægtene Flavivirus eller Pestivirus i utgangspunktet ikke var klar. Fylogenetisk, synes HCV å være nærmere beslektet med de ellers bare animalske patogene pestivirus, dette er foreslått av hydrofobisitet profiler av proteinene og den genomet organisasjon . Det virket taksonomisk fornuftig å gruppere HCV som den eneste representanten i en ny slekt Hepacivirus . GB-virusene (GB-virus A og B i New World-aper og tamariner ), spesielt GB-virus C , som også forekommer hos mennesker, men som ikke er patogene, er nært beslektet med HCV, men har ennå ikke blitt tildelt en slekt eller annen slekter .
Variasjon og undertyper
Variasjonen av HCV er også relativt høy sammenlignet med andre enkeltstrengede RNA-virus. På genomnivå, når man sammenligner forskjellige isolater, kan opptil 40% avvik bli funnet. Derfor er HCV delt inn i syv genotyper (1-7), hvor en ensartet genotype må ha minst 72% samsvar på aminosyrenivået. Disse genotypene er videre delt inn i 30 undertyper (1a, 1b, 3a osv.), Hvor homologien på aminosyrenivået er 73 til 86% innenfor undertypene.
På grunn av lese-unøyaktigheten til viral RNA-polymerase med en mutasjonshastighet på opptil per nukleotid og replikasjon, utvikler ytterligere avvik fra den opprinnelige sekvensen, som er referert til som kvasi-arter , i en infisert vert . Den raske fremveksten av denne kvasi-arten har vært knyttet til HCVs evne til å forårsake kronisk infeksjon. De stadig vises variantene (ligner på HIV- infeksjonen) unngår tilgang til immunforsvaret; denne mekanismen kalles også immununddragelse .
struktur
Det enkeltstrengede RNA-genomet (negativt ladet som syre) er festet til kjerneproteinet (basisk, positivt ladet) i virionen . Kjerneproteinet danner sannsynligvis ikke et klassisk kapsid med fast symmetri (f.eks. Icosahedral). Så langt kan gratis kapsider ikke på troverdig vis skildres eller lagres sammen.
Kjerneproteinet er fra innsiden i den virale konvolutten forankret og en transmembran helix til komplekset av de to konvoluttproteinene E1 / E2 ( envelope engl. Sheath) festet. Den transmembrane delen av HCV-kjerneproteinet tilsvarer sannsynligvis det (større) M (matriks) proteinet i virus av slekten Flavivirus (f.eks. Gul feber-virus , TBE-virus ). Dette M-proteinet er delt fra kjerneproteinet og strekker viruskonvolutten fra innsiden; i tilfelle HCV finner denne spaltning av tilsynelatende ikke sted.
HCV er ekstremt vanskelig å visualisere i et elektronmikroskop , så langt har ingen publikasjoner vært i stand til å vise et definitivt bevist bilde. Noen bilder viser partikler med en antatt størrelse på ca. 50 nm, som blir synlige etter visse rengjøringsprosesser (se ovenfor). Denne vanskelige visualiseringen, sannsynligvis på grunn av strukturell ustabilitet og følsomhet overfor normale prepareringsmetoder for HCV, er en av grunnene til at den er veldig sent til tross for intensiv søk.
I genomet til HCV er det et viktig sted for åpne leserammer ( åpen leseramme , ORF) hvorfra et enkelt polyprotein 3008-3037 aminosyrer i lengde blir lest. Dette proteinet er ved cellulære proteaser ( signalase ) ER-membranen og virale proteaser selv under translasjonen , og de ikke-strukturelle proteinene brytes ned i strukturproteinene (Core, E1 og E2) (NS2 til NS5). Dette betyr at bortsett fra virusgenomet som er tilstede, blir det ikke transkribert ytterligere messenger RNA . Tabellen viser disse proteinene med deres (delvis fremdeles uklare) funksjon, molære masse og aminosyreposisjon på polyproteinet:
| protein | Størrelse ( kDa ) | posisjon | funksjon |
|---|---|---|---|
| Kjerne | 21 (19) | 1-190 | Binding av RNA og E1 / E2 heterodimer
Oligomerisering og lipidbinding , aktivering og inhibering av cellulære gener ( leucin glidelås motiv) |
| E1 | 31-37 | 191-383 | Glykosylert membranprotein , viral kappeprotein, E1 / E2 heterodimerisering |
| E2 | 61-72 | 384-746 | Glykosylert membranprotein, viral kappeprotein, binding til cellulære reseptorer (CD81, SRB1),
Hypervariable Region (HVR1), antistoffbindende region |
| p7 | 7. | 747-809 | Membranprotein, muligens ionekanal |
| NS2 | 21-23 | 810-1026 | Sink metalloprotease , autoprotease i forbindelse med NS3 |
| NS3 | 70-72 | 1027-1657 | Protease , helikase |
| NS4A | 16-27 | 1658-1710 | Membranforening av NS3-NS4A-kompleksene, kofaktor for NS3 |
| NS4B | 27 | 1711-1971 | membranassosiert, ukjent funksjon |
| NS5A | 56-58 | 1972-2419 | Fosfoprotein, tidligere assosiert med interferonsensitivitet |
| NS5B | 68-70 | 2420-3010 | RNA-avhengig RNA-polymerase |
Den åpne leserammen på ca. 9,5 kb langt HCV-genom er av to ikke-kodende regioner (NCR, engl. Ikke-kodende region ) flankert som spiller en regulatorisk rolle under viral replikasjon. Foran startkodonet (definert som nukleotidposisjon 1) er det omtrent 340 baselange 5 'NCR, som viser den største sekvenskorrespondansen og en kompleks folding av RNA-strengen i HCV-isolatene. På slutten av genomet er den 250-300 basen lange 3'-NCR. Dette består i hovedsak av en polymer uracil (polyU) eller adenin ( polyA ) og en sterkt konservert nukleotidsekvens med 98 baser i lengde, som er kjent som X-Tail .
Replikering
Anerkjennelsen av levercellen ( hepatocytt ) som målcelle og innføring i cellen medieres mest sannsynlig via en eller flere reseptorer . HCV-reseptoren er ennå ikke klart identifisert; noen bevis tyder på binding til beta- lipoprotein reseptor, CD81 reseptor og HDL reseptor (SRB1). Ved å hemme CD81 og SRB1 kan opptaket av E1 / E2 i hepatocytter blokkeres, men ingen av disse reseptorene alene er tilstrekkelig til å infisere en celle. I tillegg er ingen av de nevnte reseptorene leverspesifikke.
I analogi med andre medlemmer av Flaviviridae antas det at HCV kommer inn i cellen gjennom en innsnevret vesikkel i cellemembranen ( endosom ), hvor den smelter endosommembranen med virushylsteret og derved frigjør kjerne protein-RNA-komplekset i den cytosol kommer. HCV-genomet, som kan leses som mRNA, når først ribosomene i det grove ER , der den første syntesen av virusproteiner finner sted. Dette første trinnet er nødvendig fordi viruset først trenger noen molekyler av den virale RNA-avhengige RNA-polymerase NS5B, og dette enzymet er ikke tilstede i cellen.
For å øke mengden tilgjengelig viralt mRNA, er neste trinn replikering av viralt RNA. For dette formål syntetiserer NS5B-polymerase en motstreng (negativ streng) av viralt (+) RNA som en mal (mal) for den påfølgende syntese av ytterligere pluss-tråder. De spesifikt brettede seksjonene i de to ikke-kodende regionene i viralt RNA tjener sannsynligvis som initieringssignal for NS5B-polymerasen. Det er indikasjoner på at begge ender av RNA-genomet nærmer seg å danne en ring ved å binde seg til cellulære proteiner, og dermed skape et replikasjonskompleks i betydningen av en rullende sirkelmekanisme . I HCV-replikerende cellekulturer, kunne iøynefallende membranstrukturer bli funnet under elektronmikroskopet, som betraktes som HCV-replikasjonskomplekser. Disse strukturene, kjent som " membranvev ", er indusert av det hydrofobe membranproteinet NS4B. Svært like spesifikke membranendringer kan bli funnet som såkalt viroplasma i alle (+) ss-RNA-virus som er undersøkt i denne forbindelse.
Etter at viral mRNA har blitt tilstrekkelig syntetisert, begynner oversettelsen av virusproteinene, overveiende strukturelle proteiner. For å initiere translasjon på ribosomene, bruker eukaryote mRNA vanligvis en modifisering av 5'-enden, den såkalte cap . Imidlertid har HCV ved folding av 5'-NCR en spesiell struktur for capuavhengig initiering, det såkalte interne ribosomale inngangsstedet (engl. Internal ribosomal entry site , IRES). Som et resultat trenger ikke HCV-RNA noen cellulære faktorer for å binde seg til ribosomene og for å starte proteinsyntese. IRES finnes vanligvis bare i noen picornavirus som poliovirus .
Selv under translasjon blir strukturproteinene avskåret av cellulære proteaser ( signalase ) fra den resulterende polyproteinstrengen; konvoluttproteinene E1 og E2 kommer inn i lumen i ER, lagrer seg i membranen og glykosyleres. Kjerneproteinet lagres eksternt i ER-membranen og binder på grunn av dets ladeegenskaper viralt mRNA. Nå kommer pakking av kjerne-RNA-komplekset og innsnevring (spirende, engl. Spirende ) av HCV-partikkelen i lumen i ER. De nye virionene forlater nå cellen gjennom cellulær sekresjon via Golgi-apparatet .
Verter
Mennesker er de eneste naturlige vertene for HCV. I studien av HCV på 1980-tallet og forsøk på å fremstille en vaksine fra 1990 ble aper (hovedsakelig sjimpanser ) smittet kunstig. Disse kan også bli smittet, men kronisk infeksjon er sjelden. Disse testene, som hovedsakelig ble utført i USA på den tiden, er av etiske grunner forbudt i Europa.
Til tross for intensive eksperimenter, har et virusproduserende cellekultursystem for HCV bare vært tilgjengelig siden 2004, noe som i betydelig grad burde akselerere forskning i replikering av viruset i celler og utvikling av nye antivirale stoffer.
Epidemiologi
Den prevalens ratio (antall syke mennesker i forhold til antall personer undersøkt) er 0.031 på verdensbasis, i Europa og USA mindre enn 0,02. I Japan, Mongolia og Egypt er det 0,181, i sistnevnte forårsaket av feil i behandlingen av schistosomiasis (forurensede kanyler). WHO antar at det er 170 millioner kroniske virusbærere over hele verden. Antall mennesker med hepatitt C er mye lavere i noen land.
Distribusjonen av genotypene og undertypene følger også geografiske mønstre: i Europa og Amerika er undertypene 1a, 1b og 3a, som forekommer over hele verden, hovedsakelig funnet (hovedsakelig blant rusmisbrukere); Undertype 1b er dominerende i Asia, genotype 4 i Afrika, genotype 5 i Sør-Afrika og genotype 6 i Hong Kong og Vietnam.Genotyper 2 og 3 er representert over hele verden, men i mye mindre grad.
Perioden med genotypisk separasjon av genotypene kunne estimeres til omtrent 500 år ved hjelp av sekvensvariabiliteten og den beregnede mutasjonsfrekvensen. Det kan derfor antas at diversifiseringen av genotyper gikk hånd i hånd med ankomsten av global sjøfart rundt år 1500.
overføring
Viruset overføres parenteralt , dvs. H. primært gjennom blod og blodprodukter; en seksuell overføring er sjelden. Dette definerer følgende risikoer: dialyse (spesielt før 1991), blodtransfusjon (før 1991), intravenøs narkotikabruk , tatovering og piercing . Overføringsveien er ukjent hos rundt 30% av pasientene.
Antivirale midler
Godkjent og eksperimentelle antivirale midler mot hepatitt C-virus inkluderer Ribavirin mot RdRP , NS3 / 4A-inhibitorer så asunaprevir , boceprevir , Ciluprevir , Danoprevir , Faldaprevir , Glecaprevir , Grazoprevir , Narlaprevir , Paritaprevir , Simeprevir , Sovaprevir , telaprevir , Vaniprevir , Vedroprevir , voxilaprevir og NS5A-hemmere daclatasvir , elbasvir (godkjent for HCV1 og HCV4), ledipasvir , MK-8408 , odalasvir , ombitasvir , ravidasvir og velpatasvir .
Rapporteringskrav
I Tyskland må direkte eller indirekte bevis på hepatitt C-virus rapporteres ved navn i samsvar med seksjon 7 i infeksjonsbeskyttelsesloven .
I Sveits, er den positive laboratorium analytiske funn et hepatitt C-virus pliktige , og at etter at Epidemider Act (EPG) i forbindelse med epidemisk forordning og Annex 3 av den Regulering av EDI på rapportering av observasjoner av smittsomme sykdommer hos mennesket .
hovne opp
- H.-J. Thiel et al: Genus Hepacivirus. I: CM Fauquet, MA Mayo et al.: Åttende rapport fra den internasjonale komiteen for taxonomi av virus . London, San Diego 2005, ISBN 0-12-249951-4 , s. 993-998.
- David M. Knipe, Peter M. Howley (red.-In-chief): Fields 'Virology. 5. utgave. 2 bind. Philadelphia 2007, ISBN 978-0-7817-6060-7 , s. 1113-1126 og 1253-1291.
weblenker
- Hepatitt C-virus (taksonomidatabase for NCBI)
- Referansesekvens NC 004102 for HCV
Individuelle bevis
- ↑ ICTV Master Species List 2018b.v2 . MSL # 34, mars 2019
- ↑ a b c d ICTV: ICTV taksonomihistorie: Yellow fever virus , EC 51, Berlin, Tyskland, juli 2019; Ratifisering av e-post mars 2020 (MSL # 35)
- ↑ D. Martin, JS Gutkind: Humane tumorassosierte virus og ny innsikt i kreftens molekylære mekanismer . I: Oncogene . teip 27 , nei 2 , 2008, s. 31-42 , PMID 19956178 .
- ^ Nobelprisen i fysiologi eller medisin 2020 . I: nobelprize.org, 5. oktober 2020.


