Glykolyse
Den glykolyse ( , gamle greske γλυκύς glykys , søt 'og λύσις lyse , Oppløsning') er av levende vesener av innfasingen monosakkarider (enkle sukker) som D - glukose (druesukker), hvorfra navnet glykolyse er avledet. Det er den sentrale prosessen i nedbrytningen av alle karbohydrater i alle eukaryoter , inkludert dyr , planter og sopp . I bakterier og arkeea er glykolyse også vanlig. Imidlertid bruker noen arter også andre metabolske veier for å bryte ned glukose, for eksempel Entner-Doudoroff-banen (ED-banen). Glykolyse er en sentral prosess i energimetabolismen og en av få metabolske veier som nesten alle organismer har til felles, noe som indikerer en veldig tidlig utvikling.
Demonteringen skjer i ti individuelle trinn. Dette skaper to pyruvatmolekyler fra ett glukosemolekyl . I tillegg dannes to molekyler av adenosintrifosfat (ATP) som er egnet for overføring av energi, og to molekyler av NAD + reduseres til NADH.
Glykolyse kalles også Embden-Meyerhof-Parnas-Weg eller EMP-Weg etter sine oppdagere Gustav Embden , Otto Meyerhof og Jakub Karol Parnas . Begrepet FDP-bane , som går tilbake til mellomproduktet D - fruktose-1,6-bisfosfat (utdatert: fruktosedifosfat), er ikke lenger i bruk .
Funnhistorie
Studier om nedbrytning av sukker går langt tilbake i 1800-tallet og startet opprinnelig med forskning på alkoholholdig gjæring eller senere melkesyregjæring . I disse fermenteringene er reaksjonstrinnene opp til dannelsen av pyruvat identiske. I 1837 demonstrerte forskerne Charles Cagniard-Latour , Theodor Schwann og Friedrich Traugott Kützing uavhengig at nedbrytningen av glukose til etanol, kjent i dag som alkoholholdig gjæring , er forårsaket av levende ting, nemlig gjær . Det faktum at de metabolske prosessene til levende gjærceller er ansvarlige for den anaerobe nedbrytningen av sukker, var fortsatt veldig kontroversiell den gangen. De fremtredende kjemikerne Jöns Jakob Berzelius , Friedrich Wöhler og Justus von Liebig var blant de mest voldelige motstanderne av dette synet. Liebig postulerte for eksempel at råtnende materiale overfører "vibrasjoner" til sukkeret som skal gjæres, som deretter brytes ned til etanol og karbondioksid.
Fra 1857 viet den franske forskeren Louis Pasteur seg også til nedbrytning av sukker i levende gjærceller . I 1860 publiserte han en bekreftelse av resultatene fra Cagniard-Latour, Kützing og Schwann og motarbeidet dermed Liebigs hypotese. Han observerte også at forbruket av glukose er høyere under anaerobe forhold enn når oksygen er tilgjengelig for gjæren. Denne observasjonen er i dag kjent som “ Pasteur-effekten ”.
På den tiden var den rådende doktrinen at bare en " livskraft " (vis vitalis) iboende i levende vesener kunne omdanne glukose til etanol. I 1858, derimot, foreslo Moritz Traube at kjemiske prosesser alene var ansvarlige for nedbrytningen av sukker i gjærceller, snarere enn "livlighet" som sådan. I 1897 oppdaget Eduard Buchner endelig at alkoholholdig gjæring også er mulig i et cellefritt gjærekstrakt. Han viste at den metabolske banen kan finne sted selv om cellene ikke lenger er intakte. Dette er kjent som in vitro . Han kalte det katalytisk aktive preparatet for “ zymase ” uten å vite at flere enzymer er involvert i den anaerobe nedbrytningen av glukose. Selv Marie fra Mannasein flyttet samme år i en publikasjon som liknet konklusjoner som Buchner. Arbeidet hennes klarte imidlertid ikke å overbevise andre fordi bevisene hennes var utilstrekkelige.

Avklaringen av de enkelte trinnene i glykolyse lyktes fra begynnelsen av det 20. århundre. Så kunne Arthur Harden og William John Young (1878-1942) være avgjørende for å løse den glykolytiske veien, og bidra og publiserte funnene sine i en serie publikasjoner fra 1905. De fant blant annet at isolerte gjærekstrakter glukose utvunnet langsomt til etanol og karbondioksid , hvis det ikke var noe uorganisk fosfat i ekstraktene. Med tilsetning av fosfat kunne imidlertid denne gjæringsreaksjonen , som fant sted in vitro , dvs. uten levende celler, gå raskere igjen. De lyktes også med å isolere fruktose-1,6-bisfosfat og demonstrere at det er et mellomprodukt av glykolyse. De separerte også cellefritt gjærekstrakt i to fraksjoner ved hjelp av dialyse . Forskerne kalte den ikke-dialyserbare fraksjonen, som vanligvis er større molekyler og proteiner, ifølge Buchner som "zymase". Hun var følsom for varme. Den dialyserbare fraksjonen består derimot av ioner og små molekyler som kan passere gjennom dialysemembranen. Denne var termisk stabil og ble kalt "Cozymase". Bare begge sammen kunne indusere en gjæringsreaksjon in vitro . Det viste seg at zymasen var en blanding av enzymer, mens koenzymasen inneholdt koenzymer som var nødvendige for disse enzymene .
I 1918 var Otto Meyerhof i stand til å bevise at de samme koenzymer kreves i melkesyregjæring i muskler som ved alkoholgjæring. På grunn av den korte levetiden til mange mellomprodukter, viste det seg vanskelig å videreutvikle den metabolske banen. Gustav Embden foreslo den første biokjemiske reaksjonssekvensen for glykolyse i 1932. To år senere var Karl Lohmann i stand til å bevise i Meyerhofs laboratorium at den universelle energibæreren adenosintrifosfat (ATP) produseres under glykolyse. Meyerhofs forskningsgruppe bidro til oppdagelsen av rundt en tredjedel av enzymene som var involvert i glykolyse.
Til slutt, på slutten av 1930-tallet, avklarte arbeidet til Otto Warburg og Hans von Euler-Chelpin reaksjonstrinnene i gjær; Embden, Meyerhof og Jakub Karol Parnas , derimot, jobbet med muskelceller. I tillegg spilte Carl og Gerty Cori , Carl Neuberg , Robert Robinson og Erwin Negel, som jobbet under Warburg, en viktig rolle i klargjøringen av glykolyse.
Alle trinn og enzymer involvert i glykolyse har vært kjent siden 1940-tallet. Deretter fulgte mer detaljerte studier av enzymene som var involvert.
Betydning for cellen
Glykolyse er den viktigste måten å bryte ned karbohydrater i stoffskiftet. Mest av alle heksoser og trioser er denne ene veien metabolisert og forberedt for videre nedbrytning. Glykolyse inntar dermed en sentral plass i den katabolske metabolismen . Enzymer involvert i reaksjonene forekommer i nesten alle levende ting, slik at glykolyse også er universell. Glykolyse har også andre viktige funksjoner:
Energiproduksjon under anaerobe forhold
I glykolyse oppnås energi og tilveiebringes i form av to ATP-molekyler per molekyl nedbrutt D- glukose, uavhengig av om det er oksygen i luftveiskjeden eller ikke. Glykolyse produserer omtrent en femtendedel så mye ATP per molekyl D- glukose som fullstendig oksidativ nedbrytning til karbondioksid og vann i sitronsyresyklusen og i luftveiskjeden. Derfor metaboliseres mindre glukose under aerobe forhold, noe som allerede ble observert i gjær av Louis Pasteur i 1861 ( Pasteur-effekt ).
Siden glykolyse også foregår under anoksiske forhold, åpner dette for noen gunstige muligheter i stoffskiftet. For eksempel kan mikroorganismer få energi på denne måten i et anoksisk miljø. Hos virveldyr , når musklene brukes i stor grad, forbrukes det mer oksygen enn det som transporteres inn i cellene. Av denne grunn må cellen trekke sin energi utelukkende fra glykolyse på kort sikt. Dette er ofte tilfelle med større dyr som alligatorer , krokodiller , elefanter , neshorn , hvaler og sel , der oksygen ikke kan tilføres raskt nok til oksidativ nedbrytning av glukose. Også hos mennesker omdannes glukose til laktat i muskelceller som raskt trekker seg sammen i løpet av glykolyse og melkesyregjæring . En stor fordel med glykolyse er det faktum at ATP kan gjøres tilgjengelig 100 ganger så raskt som via oksidativ fosforylering i luftveiskjeden.
Planter får sin energi enten fra fotosyntese eller fra luftveiskjeden. Imidlertid er det også situasjoner der lys og oksygen midlertidig ikke er tilgjengelig, for eksempel under imbibisjon under frøspiring eller når røttene oversvømmes midlertidig med vann. Under disse forhold opprettholdes den lokale metabolismen ved glykolyse.
Glukose som eneste drivstoff
Celler i hjernen må få mesteparten av energien fra glykolyse, noen spesialiserte celler får til og med sin energi utelukkende fra glykolyse. Dette inkluderer for eksempel celler i nyremedulla , også erytrocytter , som mangler mitokondrier og dermed luftveiskjeden, og sædceller . Tross alt inkluderer det også raskt voksende og delende tumorceller . Otto Warburg oppdaget i 1930 at tumorceller har en mye høyere glykolysehastighet enn friske celler. I positronemisjonstomografien brukes dette til å visualisere tumorvev.
Byggesteiner for cellemateriale
Glykolyse forbereder ikke bare glukose for oksidativ nedbrytning, men gir også forløpere for biosyntese av andre forbindelser. Dermed pyruvat utgangsmateriale for syntese av fettsyrer og, for noen aminosyrer ( L - alanin , L - valin og L - leucin ). Glyserol-3-fosfat , som spiller en rolle i syntesen av lipider , dannes reduktivt fra dihydroksyacetonfosfat . Fosfoenolpyruvat er utgangsmaterialet for biosyntese av de aromatiske aminosyrene L - fenylalanin , L - tryptofan og L - tyrosin , mens L - serin er dannet av 3-fosfoglyserat .
Levering av NADH
I tillegg til ATP produserer glykolyse også reduksjonsmiddelet NADH. Dette blir enten oksidert i luftveiskjeden for ytterligere forsterkning av ATP, eller brukt som et reduksjonsmiddel for syntesen av andre molekyler - i det minste med det formål å regenerere NAD + i gjæringer .
Reaksjonstrinn
Mobil lokalisering
Glykolyse foregår i cytoplasma i en celle . I flercellede organismer som mennesker utføres glykolyse i alle (differensierte) celletyper. Planter utfører også glykolyse i plastidene .
Generell oversikt

Glu-6-P = glukose-6-fosfat
Fru-6-P = fruktose-6-fosfat
Fru-1,6-bP = fruktose-1,6-bisfosfat
DHAP = dihydroksyacetonfosfat
GAP = glyseraldehyd-3-fosfat
1, 3-bPG = 1,3-bisfosfoglyserat
3-PG = 3-fosfoglyserat
2-PG = 2-fosfoglyserat
PEP = fosfoenolpyruvat
Pyr = pyruvat
Nedbrytningen av glukose til pyruvat skjer på samme måte både under oksygenmangelforhold ( anaerob ) og med tilstrekkelig oksygentilførsel ( aerob ). I motsetning til luftveiskjeden forbrukes ikke oksygen (O 2 ).
Glykolyse kan deles i to faser. Den første fasen er en forberedende fase der energi først investeres i form av ATP. Den består av splitting av heksose D- glukose i to triose fosfater: dihydroksyacetonfosfat (DHAP) og glyseraldehyd-3-fosfat (GAP) (se figur). Her er DHAP i CAP for isomerisering av andre fase . Dette forbereder sukkeret for den faktiske sammenbruddet.
I den andre fasen blir to GAP-molekyler omdannet til to pyruvat (Pyr) -molekyler via flere mellomtrinn. To molekyler av NADH og fire molekyler av ATP blir dannet i prosessen. Denne fasen gir energi i form av 4 ATP og 2 reduksjonsekvivalenter NADH.
Den totale balansen av glykolyse kan således formuleres som følger:
Forberedende fase
Det første trinnet i glykolyse er fosforylering av D- glukose (Glc) til glukose-6-fosfat (G6P). Avhengig av celletype, er denne reaksjonen en heksokinase eller glukokinase (heksokinase IV) katalyserer , der ett ATP-molekyl er investert. Dette har to fordeler: På den ene siden er cellemembranen permeabel for glukose på grunn av glukosekanalene (f.eks. GLUT-1 ) som er tilstede i den , men ikke glukose-6-fosfatet produsert av fosforylering. Som et resultat akkumuleres det i cellen. På den annen side reduserer fosforylering av glukose glukosekonsentrasjonen i cellen, mens konsentrasjonen av G6P øker i omvendt retning. Den innledende fosforyleringen har den effekten at det er mindre glukose inne i cellen enn utenfor cellen. Siden den intracellulære glukosekonsentrasjonen således er i ubalanse med den ekstracellulære, strømmer ytterligere glukose inn langs denne resulterende konsentrasjonsgradienten gjennom glukosekanalene i cellen. Som et resultat er absorpsjonen av glukose favorisert.
I bakterier, blir fosforylering i det første trinnet av glykolyse ikke katalysert av hexo- eller glucokinases men av fosfoenolpyruvat (PEP) -avhengig sukker -fosfo-system .
Glukose-6-fosfat omdannes deretter til isomer fruktose-6-fosfat (F6P) av glukose-6-fosfatisomerase . Enzymet foretrekker binding av alfa-anomeren til G6P, reaksjonsproduktet er α- D- fruktose-6-fosfat. Under standardbetingelser er likevekten til isomeriseringsreaksjonen på siden av G6P. Men siden F6P fortsetter å reagere raskt, trekkes det ut av reaksjonssystemet, slik at ingen likevekt er etablert, og isomeriseringsreaksjonen fortsetter til fordel for F6P.
 |
ATP ADP heksokinase eller glukokinase |
 |
Glukose- 6- fosfatisomerase  |

|
| α- D - glukose | α- D - glukose-6-fosfat | α- D - fruktose-6-fosfat |
Fruktose-6-fosfat blir deretter under påvirkning av det første nøkkelenzymet i glykolyse, fosfofruktokinase 1 , fosforyleres med et ATP-molekyl til fruktose-1,6-bisfosfat (F1,6bP), hvorved ADP dannes. Enzymet foretrekker beta-anomeren av F6P, mens alfa-anomeren ble dannet i for-reaksjonen. Dette er imidlertid ikke et problem siden de to anomerer er i likevekt ( mutarotasjon ). I anaerobe bakterier, noen planter, primitive eukaryoter og noen arkeaer, katalyseres dette trinnet av en pyrofosfatavhengig fosfofruktokinase (EC 2.7.1.90), der pyrofosfat (PP i , fra engelsk pyrofosfat, uorganisk ) brukes i stedet for ATP.
 |
ATP ADP phospho fructo kinase |

|
| β- D- fruktose-6-fosfat | β- D - fruktose-1,6-bisfosfat |
Den fornyede satsingen på energi er billig og nødvendig av to grunner: På den ene siden gjør dette trinnet - i tillegg til glukokinase og pyruvatkinase - glykolyse irreversibel under fysiologiske forhold. På den annen side muliggjør energien som tilføres her spalting av heksosen i neste trinn og dermed dannelsen av to fosforylerte trioser for videre nedbrytning, dihydroksyacetonfosfat (DHAP) og glyseraldehyd-3-fosfat (GAP). Karbonatomer C1-C3 av F1,6bP finnes i DHAP, mens C-atomer i GAP kommer fra C4-C6-enheten av F1,6bP.
Spaltingsreaksjonen er veldig ugunstig under standardbetingelser (ΔG 0 '= +24 kJ / mol) og vil ikke finne sted. På grunn av den raske metabolismen av begge reaksjonsproduktene, skjer det imidlertid i nær likevekt under fysiologiske forhold. Dihydroksyacetonfosfat omdannes til D- glyseraldehyd-3-fosfat av triosefosfatisomerase (TIM) . Denne stereospesifikke isomeriseringen i retning av GAP fremmes av det faktum at GAP brytes videre ned i glykolysen og dermed holdes konsentrasjonen i cellen lav. Uten ytterligere metabolisme ville balansen mellom DHAP og GAP være sterkt på siden av ketonen, dvs. DHAP (22: 1).
 |
Aldolase |
 |
Triose fosfat isomerase  |

|
| β- D- fruktose-1,6-bisfosfat | Dihydroxy aceton fosfat |
D - glycerol aldehyd 3-fosfat |
Avskrivningsfase
Hvert av de to resulterende glyseraldehyd-3-fosfatmolekylene oksyderes ved begynnelsen av amortiseringsfasen av glykolyse av en glyseraldehyd-3-fosfatdehydrogenase (GAPDH). I reaksjonen blir NAD + redusert til NADH. Oksydasjonen av aldehydgruppen (GAP) til karboksygruppen er energisk veldig gunstig. Den brukes til å koble uorganisk fosfat med karboksygruppen. Dette skaper blandet syreanhydrid 1,3-bisfosfoglyserat (1,3-BPG). Likevekten til denne reaksjonen er fra edukten GAP versus 1,3-BPG (10: 1). Imidlertid forhindrer den raske omdannelsen av produktet likevekten fra å bli etablert, og 1,3-BPG blir konstant dannet, og en høy konsentrasjon av NAD + sammenlignet med NADH favoriserer omdannelsen i en retning.
En alternativ byvei i erytrocytter , fra 1,3-bisfosfoglyserat til 3-fosfoglyserat, er Rapoport-Luebering-syklusen , som går via det mellomliggende 2,3-bisfosfoglyseratet og hvis sentrale enzym er trifunksjonell bisfosfoglyseratmutase .
 |
NAD + NADH + Pi + H + glyceraldehyde- 3-fosfat -dehydrogenase  |

|
| D- glyceraldehyd-3-fosfat | D - 1,3-bisfosfoglyserat |
I det neste trinnet genererer fosfoglyseratkinasen ett molekyl ATP når man omdanner 1,3-bisfosfoglyserat til 3-fosfoglyserat ved å overføre en fosfatrest til ADP. Energien som ble frigjort under forrige oksidasjon, blir dermed konservert ved å bygge opp ATP. Dannelsen av ATP fra ADP som finner sted her er et eksempel på substratkjedefosforylering . Hvis cellen allerede har mye ATP (og dermed lite ADP), fortsetter reaksjonen på dette punktet til nok ADP er tilgjengelig igjen. Denne tilbakemeldingsreguleringen er viktig fordi ATP går relativt raskt sammen når den ikke brukes. Dette forhindrer overproduksjon av ATP.
Den energibalanse i glykolysen er balansert i dette trinnet: to molekyler av ATP ble anvendt, og to ble gjenvunnet
 |
Fosfo -glycerat kinase ADP ATP 
|

|
| D -1,3-bisfosfoglyserat | D - 3-fosfoglyserat |
En kofaktoruavhengig fosfoglyseratmutase (PGM) katalyserer deretter omdannelsen av 3-fosfoglyserat til 2-fosfoglyserat. Under prosessen overføres fosfatgruppen midlertidig til en aminosyrerest av enzymet. I erytrocytter katalyseres denne reaksjonen av en kofaktoravhengig PGM der 2,3-bisfosfoglyserat dannes som et mellomprodukt.
2-fosfoglyserat blir deretter dehydrert til fosfoenolpyruvat (PEP) ved hjelp av enolase . Dette er grunnen til at enzymet også kalles 2-fosfoglyseratdehydratase. PEP er en fosforylerte forbindelse med et meget høyt gruppeoverføringspotensial . Dette brukes i det siste trinnet av glykolyse for å få et nytt ATP-molekyl. Her katalyserer en pyruvatkinase (PK) omdannelsen av PEP til pyruvat (= anion av pyruvinsyre) med ATP-forsterkning. Dette resulterer imidlertid ikke i pyruvat direkte, men heller likevekt enolpyruvat. Ved pH 7 er likevekten på siden av ketonformen. Dette trinnet er også regulert av ADP; det er den tredje, irreversible reaksjonen i løpet av glykolyse.
 |
Phospho glycerate glyceratmutase 
|
 |
−H 2 O enolase  |
 |
ADP ATP pyruvat kinase |
|
| D -3-fosfoglyserat | D - 2-fosfoglyserat | Fosfoenolpyruvat | Pyruvat |
Hvis det er mangel på fosfat, kan planter hydrolysere PEP til pyruvat uten å få ATP, som foregår i vakuolene . Enzymet som er involvert er en PEP fosfatase (EC 3.1.3.60), som frigjør uorganisk fosfat og dermed motvirker fosfatmangel.
Regenerering av kofaktoren NAD +
I glykolyse reduseres to molekyler av NAD + til NADH per syklus. Mesteparten av tiden er den cellulære konsentrasjonen av NAD + veldig lav, slik at den vil bli brukt opp raskt uten reoksidering. Som et resultat må NAD + regenereres, ellers vil glykolyse stoppe. Hvordan dette skjer, avhenger av om forholdene er anoksiske eller oksiske . I tillegg påvirker dette den videre nedbrytningsveien til pyruvat.
Giftige forhold
Under oksiske forhold blir pyruvat oksidativt dekarboksylert i pyruvatdehydrogenasekomplekset til acetyl-CoA . Dette skaper ett molekyl karbondioksid og ett molekyl NADH. Acetyl-CoA går deretter inn i sitronsyresyklusen der det er fullstendig oksidert til to molekyler karbondioksid. Ytterligere NADH-molekyler dannes i løpet av disse oksidasjonstrinnene. Disse og de som skyldes glykolyse blir til slutt reoksidisert i løpet av luftveiskjeden med forbruk av oksygen, slik at NAD + igjen er tilgjengelig for glykolyse og sitronsyresyklusen. Samtidig dannes ytterligere molekyler av ATP i løpet av disse trinnene. Mens prokaryoter kan produsere totalt 38 molekyler ATP per molekyl glukose, avhenger balansen i eukaryoter av måten NADH dannet i cytosolen passerer mitokondriell membran ( malat-aspartatskyttel eller glyserol-3-fosfatskyttel ).
I eukaryoter, tar i sitronsyresyklusen sted i matriksen i mitokondrie , mens glykolyse finner sted i cytosol. NAD + og NADH kan ikke diffundere fritt gjennom mitokondriens indre membran, og spesielle translokatorer mangler . Utvekslingen av NAD + og NADH skjer derfor enten gjennom malat-aspartat-skyttel eller glyserol-3-fosfat-skyttel.
I litteraturen er glykolyse og den påfølgende nedbrytningen av pyruvat til karbondioksid gjennom prosessene i sitronsyresyklusen og luftveiskjeden noen ganger feil oppsummert som aerob glykolyse . Glykolyse slutter imidlertid med dannelsen av pyruvat og foregår under både oksiske og anoksiske forhold.
Anoksiske forhold
→ se også hovedartikler alkoholgjæring , melkesyregjæring
Hvis oksygen ikke er tilgjengelig eller bare i begrenset grad, kan pyruvat omdannes ytterligere reduktivt, for eksempel i melkesyrefermentering eller i alkoholfermentering . I melkesyrefermentering reduseres pyruvat til L - laktat med NADH , i alkoholfermentering dekarboksyleres det og reduseres til etanol . I begge tilfeller oksyderes NADH til NAD + og er tilgjengelig for ytterligere glykolyserunder. I motsetning til den aerobe nedbrytingsbanen dannes ingen ATP i disse gjæringstrinnene .
Ved alkoholgjæring danner gjær etanol fra pyruvat i to reaksjonstrinn som katalyseres av to enzymer, pyruvatdekarboxylase (EC 4.1.1.1) og alkoholdehydrogenase . NADH produsert ved glykolyse oksyderes til NAD + . Bakterier, for eksempel melkesyrebakterier, samt muskelceller hos mennesker, driver melkesyregjæringen (se også figur til høyre). Her reduseres pyruvat til laktat ved laktatdehydrogenase ved bruk av NADH, slik at glykolyse kan fortsette. Denne reaksjonen er sterkt eksergonisk både under standardbetingelser og under fysiologiske forhold (ΔG 0 ′ = −25 kJ / mol eller ΔG = −14,8 kJ / mol).
Den (homofermentative) melkesyregjæringen blir noen ganger referert til som anaerob glykolyse . Dette er imidlertid misvisende ettersom glykolyse slutter med dannelsen av pyruvat og foregår under både oksiske og anoksiske forhold.
Siden glykolyse foregår i cellens cytosol, kan den også finne sted i celler uten mitokondrier. Her kan imidlertid ikke NADH oksideres til NAD + av sitronsyresyklusen og luftveiskjeden , men uten oksygenforbruk ved å redusere pyruvat til laktat, katalysert av laktatdehydrogenase. Når et glukosemolekyl brytes ned, blir det bare produsert to molekyler av ATP i erytrocyttene, som imidlertid tilfredsstiller behovene til disse cellene.
Energiske aspekter
Likevektsposisjon
| steg | Reaksjon i glykolyse | ΔG 0 '[kJ / mol] | ΔG [kJ / mol] |
|---|---|---|---|
| 1 | Glukose + ATP → glukose-6-P + ADP | −16.7 | −33.9 |
| 2 | Glukose-6-P uct fruktose-6-P | +1.7 | −2.9 |
| 3 | Fruktose-6-P + ATP → Fruktose-1,6-bP + ADP | −14.2 | −18.8 |
| 4. plass | Fruktose-1,6-bP ⇌ DHAP + G-3-P | +23,9 | −0.2 |
| 5 | DHAP ⇌ GAP | +7,6 | +2,4 |
| Sjette | GAP + P i + NAD + ⇌ 1,3-bis-P-glycerat + NADH + H + | +6,3 | −1.3 |
| 7. | 1,3-bis-P-glyserat + ADP ⇌ 3-P-glyserat + ATP | −18.9 | +0,1 |
| 8. plass | 3-fosfoglyserat ⇌ 2-fosfoglyserat | +4,4 | +0,8 |
| 9 | 2-P-glycerat ⇌ PEP + H 2 O | +7,5 og +1,8 | +1,1 |
| 10 | PEP + ADP → pyruvat + ATP | −31.7 | −23.0 |
De fleste glykolysereaksjoner er energisk ugunstige under standardbetingelser ved en pH på 7. Endringen i fri entalpi G 0 ' er ofte positivt, slik at disse reaksjonene er endergonic og ville ikke finne sted (se tabell Ag 0 ' verdier). Glykolysen ville ende i fjerde trinn.
| Metabolitt | Konsentrasjon [mM] |
|---|---|
| glukose | 5.0 |
| Glukose-6-P | 0,083 |
| Fruktose-6-P | 0,014 |
| Fruktose-1,6-bP | 0,031 |
| DHAP | 0,140 |
| Lokk | 0,019 |
| 1,3-bis-P-glyserat | 0,001 |
| 3-PG | 0,120 |
| 2-PG | 0,030 |
| PEP | 0,023 |
| Pyruvat | 0,051 |
| P i | 0,001 |
Per definisjon tilsvarer molakonsentrasjonen av reaktantene 1 mol·l −1 under slike forhold . Dette kan imidlertid ikke brukes som grunnlag for en beregning, da levende celler ikke kan generere eller opprettholde så høye konsentrasjoner. For en meningsfull vurdering, derimot, må man vite de faktiske stoffkonsentrasjonene. Hvis dette måles under fysiologiske forhold, kan endringen i fri entalpi G beregnes på nytt (se tabell ΔG-verdier, metabolittkonsentrasjon).
Erytrocytter er spesielt egnet for å beregne disse verdiene. Erytrocytter trekker all sin energi fra glykolyse. Alle andre cellulære reaksjoner finner også sted i cytoplasma, siden de verken har mitokondrier , en cellekjerne eller et endoplasmatisk retikulum . Dette letter også separasjonen av cellekomponentene. Uten mitokondrier er det ingen reaksjoner i luftveiskjeden eller sitronsyresyklusen . En kvantifisering av involverte koenzymer vil ellers være betydelig vanskeligere. Tross alt tar pentosefosfatveien bare en liten rolle i metabolismen av erytrocytter, det er heller ikke noe protein eller lipidbiosyntese. Dette gjør at de glykolytiske mellomproduktene enkelt kan isoleres og bestemmes.
I 1965 ble stoffkonsentrasjonene ( steady state ) av glykolytiske mellomprodukter bestemt fra humane erytrocytter (se tabellen til høyre). Det ble funnet at visse mellomprodukter er tilstede i svært lave konsentrasjoner. Når man tar hensyn til disse konsentrasjonene, endres likevektsposisjonen til de tilsvarende reaksjonene på en slik måte at hele glykolysen under fysiologiske forhold er reversibel med unntak av tre reaksjoner (ΔG ca. 0 kJ · mol −1 ).
I disse reaksjonene forblir molar konsentrasjonen så lav fordi produktene som genereres raskt blir omdannet og deretter fjernet fra systemet gjennom irreversible reaksjoner. Disse tre irreversible reaksjonene katalyseres av nøkkelenzymene glukokinase eller heksokinase, fosfofruktokinase 1 og pyruvatkinase. På grunn av den raske, irreversible konverteringen ved bruk av et av nøkkelenzymene, er stoffkonsentrasjonen av de tidligere genererte produktene tilstrekkelig redusert - glykolysen kan gå i en retning.
Ved beregning av likevektsposisjon under fysiologiske forhold, resulterer små, men positive ΔG-verdier for noen reaksjoner, for eksempel ved isomerisering av 3-fosfoglyserat til 2-fosfoglyserat (ΔG = +1,1 kJ mol −1 ). Strengt tatt kan ikke disse verdiene være helt korrekte, siden fremoverreaksjonen bare kan finne sted med negative ΔG-verdier. Siden glykolyse finner sted antas det imidlertid at målefeil ved bestemmelse av stoffkonsentrasjonen er ansvarlig for denne motsetningen.
Det er to konsekvenser av å ha tre kontrollpunkter. For det første kan glykolyse effektivt reguleres på disse punktene, slik at den kan slås på eller av raskt, avhengig av energistatusen til cellen. For det andre muliggjør den nåværende likevekten også omvendt reaksjon av glykolyse, glukoneogenese . Bortsett fra tre enzymer, brukes alle glykolyseenzymer.
Effektivitet
Under standardbetingelser frigjør omdannelse av D- glukose til to molekyler laktat 183,6 kJ / mol energi (ΔG 0 '= −183,6 kJ / mol):
Å bygge to molekyler av ATP fra to molekyler av ADP og uorganisk fosfat (P i ) hver, 61,0 kJ / mol er nødvendig:
Siden glykolyse kobler disse to reaksjonene gjennom substratkjedefosforylering, frigjøres en energi på 122,6 kJ / mol:
ΔG 0 '= (−183.6 + 61) kJ mol −1 = −122.6 kJ mol −1
Når glukose brytes ned til laktat anaerobt, under standardforhold, brukes 33% av den tilgjengelige energien til å bygge opp to ATP-molekyler. Siden det kreves rundt 50 kJ mol −1 under oppbygging av ATP under fysiologiske forhold , er også energiutbyttet noe høyere, rundt 50%.
regulering
Glykolyse brukes til å gi energi, spesielt hvis det resulterende pyruvat brytes ned under aerobe forhold. Hvis det derimot er en energisk gunstig tilstand, lagres glukose og omdannes til andre metabolitter i løpet av anabolisme med energiforbruk.
Reguleringen av glykolyse er derfor av avgjørende betydning. For eksempel skal det ikke gå parallelt med omvendt reaksjon, glukoneogenese . I et slikt tilfelle snakker man om en " inaktiv prosess ", som meningsløst bruker ATP og derfor er uproduktiv. Som et unntak bør varmegenerering i humler nevnes, som genererer varme gjennom tiltenkt, motroterende fosforylering og defosforylering av fruktose-6-fosfat til fruktose-1,6-bisfosfat og omvendt.
Fra et biokjemisk synspunkt kontrolleres irreversible reaksjoner. Under fysiologiske forhold er det tre reaksjoner i glykolyse som er irreversible. De katalyseres av hekso- eller glukokinase, fosfofruktokinase-1 og pyruvatkinase og er derfor målet for regulering.
Hekso- og glukokinase
Heksokinase er det første enzymet i glykolyse hvis aktivitet er regulert. Det fosforylerer glukose til glukose-6-fosfat (G6P) mens det bruker ATP, men kan også bruke andre heksoser som substrat. G6P er sluttproduktet av heksokinase reaksjonen og som sådan allosterisk hemmer enzymet .
Isoenzymet av heksokinase, glukokinase, som forekommer i leveren, hemmes ikke av produktet G6P. I motsetning til heksokinasen viser den også en høyere K M- verdi. Derfor erstatter glukokinasen bare heksokinasen ved svært høye glukosekonsentrasjoner. Under disse forholdene lagres G6P som glykogen i de følgende trinnene og brytes ikke ned i glykolyse, fordi G6P også blir viderekoblet for andre metabolske veier. Leveren derfor fungerer som en homeostat for den blodsukkernivået , idet det opprettholder den ved å bygge opp eller bryte ned glukose.
Et lever-spesifikt regulatorisk protein kan reversibelt binde seg til glukokinase og derved hemme det. Bindingen av denne regulatoren til glukokinasen foregår i cellekjernen , slik at den hemmede glukokinasen forblir inaktiv der og ikke kan påvirkes av andre cytosoliske effektorer. Denne bindingen styrkes deretter hvis enzymet er modifisert av allosterisk form med fruktose-6-fosfat. Derimot får glukose dette leverproteinet til å løsnes. Når blodsukkerkonsentrasjonen er høy, dominerer glukose slik at regulatoren kan dissosiere og glukose fosforyleres til glukose-6-fosfat. Imidlertid, hvis blodsukkernivået synker for mye (under 5 mmol·l -1 ), hemmes glukokinasen - formidlet av fruktose-6-fosfat. Glukose fosforyleres ikke lenger og kan forlate leveren igjen for å være tilgjengelig for andre organer.
Til slutt reguleres glukokinase på transkripsjonsnivå . Den hormonet insulin påvirker mengden av glukokinase i leveren. En metabolsk lidelse forekommer hos pasienter med diabetes mellitus fordi de ikke kan produsere nok insulin. De har for lave nivåer av glukokinase, tåler ikke høye blodsukkernivåer og har lite glukokinase i leveren.
Fosfofruktokinase-1
Hovedkontrollpunktet for glykolyse er fosforylering av Frc-6-P til Frc-1,6-bP av fosfofruktokinase-1 (PFK-1). Det representerer det første virkelige glykolysespesifikke trinnet og er irreversibelt under fysiologiske forhold. Enzymet har to bindingssteder for ATP. I tillegg til et substratbindingssted med høy affinitet, har PFK-1 også et regulatorisk bindingssted. Dermed kan ATP tjene både som substrat og hemme PFK-1 allosterisk. Hvis ATP-konsentrasjonen er tilstrekkelig høy, økes K M- verdien av enzymet. Dette senker aktiviteten til PFK-1, slik at glykolyse reduseres. Likevel, ATP-konsentrasjonene i en celle svinger bare litt, slik at ATP alene ikke ville være tilstrekkelig for presis regulering. Aktiviteten til PFK-1 avhenger derfor også av AMP- konsentrasjonen og reflekterer energiforsyningen til cellen. AMP fungerer som en allosterisk, ikke-kovalent aktivator. Hvis energitilstanden til cellen er høy (ATP-konsentrasjon høy, AMP-konsentrasjon lav), inhiberes enzymet, ellers økes aktiviteten til PFK-1 for å produsere mer ATP.
Selv sitrat hemmer PFK-1 allosteric. Sitrat er en nøkkelmetabolitt i sitronsyresyklusen , hvis primære formål er å produsere energi under aerobe forhold. Alternativt kan forskjellige forløpermolekyler tas fra sitronsyresyklusen. Hvis det er mye sitrat, er sitronsyresyklusen mettet. Derfor hemmer sitrat PFK-1 i betydningen sluttproduktinhibering, slik at glykolysen mater sitronsyresyklusen mindre sterkt.
Aktiviteten til fosfofruktokinase-1 påvirkes også av pH-verdien . En lav pH-verdi hemmer enzymet og bremser glykolyse. Dette skjer for eksempel når musklene blir anstrengt og det produseres mye melkesyre. Dette senker pH-verdien i cellene.
Til slutt aktiveres PFK-1 allosterisk i mikromolare konsentrasjoner av β- D- fruktose-2,6-bisfosfat (F-2,6-bP). F-2,6-bP fremmer glykolyse mens den hemmer fruktose-1,6-bisfosfatase . Dette er enzymet som katalyserer omvendt reaksjon i glukoneogenese på dette punktet . Under fysiologiske forhold forblir enzymet i en praktisk talt inaktiv tilstand uten F-2,6-bP. Etter binding av F-2,6-bP til PFK-1 reduseres også affiniteten til de to inhibitorene ATP og citrat.
I bakterier er fruktose-2,6-bisfosfat ikke funnet som en aktivator av PFK-1.
Pyruvat kinase
Det siste trinnet i glykolyse er irreversibel og katalyseres av pyruvatkinase (PK). Dette er også regulert, men i motsetning til de to andre enzymene på en relativt underordnet måte. Fruktose-1,6-bisfosfat og AMP stimulerer PK, mens ATP, acetyl-CoA og L - alanin hemmer det allosterisk. Isoenzymet (L-form) som dominerer i leveren og tarmene kan, i motsetning til M-formen som forekommer i muskler, også fosforyleres av proteinkinase A. Aktiviteten til proteinkinase A er hormonalt formidlet av glukagon . I den fosforylerte form inhiberes dette isoenzymet deretter relativt sterkere av ATP og alanin enn den umodifiserte PK. Dette skal redusere nedbrytningen av glukose i leveren slik at den er lettere tilgjengelig for andre organer. Defosforylering katalyseres av en fosfatase .
Inhibitorer
Enolasen inhiberes av fluor . Jodacetat hemmer glyseraldehyd-3-fosfatdehydrogenase, som oksyderer glyseraldehyd-3-fosfat med et uorganisk fosfat og med deltagelse av NAD + for å danne 1,3-bisfosfoglyserat. Det modifiserer en SH-gruppe av enzymet, slik at denne inhiberingen kan løftes igjen ved å tilsette merkaptaner .
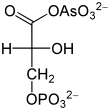
Arsenat , HAsO 4 2− , ligner på uorganisk fosfat HPO 4 2− og omdannes på stedet av glyseraldehyd-3-fosfatdehydrogenase. Dette skaper 1-arseno-3-fosfoglyserat fra glyseraldehyd-3-fosfat (se figur). I motsetning til 1,3-bisfosfoglyserat er denne arsenatforbindelsen, som ethvert annet acylarsenat, veldig ustabil; den brytes ned til 3-fosfoglyserat. Som et resultat kan oksidasjonsenergien ikke lenger utnyttes ved fosforylering av substratkjeden. Det er ikke lenger et trinn i dannelsen av ATP i glykolyse, som fortsetter å finne sted, men ikke lenger leverer noe netto ATP. Siden arsenat ikke konsumeres, fungerer det allerede i katalytiske mengder. Harden og Young demonstrerte effekten av arsenat på glykolyse tidlig på 1900-tallet ved bruk av gjærekstrakter.
patologi
På grunn av den sentrale rollen glykolyse har i metabolismen, manifesterer defekter seg relativt sjelden, fordi de berørte cellene dør i de fleste tilfeller. Derfor er bare noen få sykdommer og mutasjoner i glykolyse kjent.
Den mest kjente er defekter i pyruvatkinase som fører til hemolytisk anemi . Hvis pyruvatkinasen mislykkes, produseres ingen ATP i det siste trinnet av glykolyse, slik at blodcellene ikke kan gi nok energi til å drive ionepumper i den cytoplasmatiske membranen . Dette får de røde blodcellene til å hovne opp og sprekke. Hvis aktiviteten til triose fosfat isomerase reduseres ved en mutasjon, fører dette til den såkalte triose fosfat isomerase mangel . Det fører til nevrologisk skade og også til hemolytisk anemi, ofte også til døden. Mangel på fosfofruktokinase fører til Taruis sykdom , noe som resulterer i treningsavhengig muskelsvakhet med muskelsmerter og hemolytisk anemi.
Innføring av andre metabolitter
I tillegg til D- glukose kan andre metabolitter også forekomme i glykolyse, forutsatt at de kan omdannes til et av de mellomliggende produktene som forekommer deri. Pentoser og tetroser blir vanligvis omdannet til glyseraldehyd-3-fosfat eller fruktose-6-fosfat via pentosefosfatveien og kan deretter omdannes videre.
Nedbrytningsveiene til di- eller polysakkaridene fører også til glykolyse. For eksempel er sukrose delt i glukose og fruktose. Hvordan fruktose konverteres videre er beskrevet nedenfor. Når laktose brytes ned produseres D- glukose og D - galaktose , men sistnevnte omdannes også til glukose og brytes ned i glykolyse.
Individuelle monosakkarider dannes fra flere sukkerarter gjennom enzymatiske reaksjoner , som om nødvendig etter isomerisering til glukose-6-fosfat eller fruktose-6-fosfat, kan strømme direkte inn i den glykolytiske nedbrytingsveien. Et velkjent eksempel er lagringsstoffet glykogen . En glykogenfosforylase gjør det til glukose- 1-fosfat , som deretter isomeriseres til glukose-6-fosfat.
Glyserin
Glyserin produseres når triglyserider brytes ned og kan tjene som en forløper for glykolyse eller glukoneogenese. En cytosolisk glyserolkinase fosforylerer glyserol mens den bruker ATP til glyserol-3-fosfat , som deretter oksyderes til dihydroksyacetonfosfat. Dette katalyseres enten av et cytosolisk glyserol-3-fosfatdehydrogenase (cGDH) eller et isoenzym i membranen i mitokondrionen (mGDH). Førstnevnte reduserer NAD + , sistnevnte reduserer ubiquinon .
Fruktose
Når disakkaridet sukrose brytes ned, frigjøres glukose og fruktose. Hos høyere dyr fosforyleres fruktose til fruktose-1-fosfat i leveren , som katalyseres av en fruktokinase ( ketohexokinase , FK) med forbruk av ATP. Deretter deler aldolase B (fruktose-1-fosfat aldolase, ALD-B) fruktose-1-fosfat i dihydroksyacetonfosfat (DHAP) og glyseraldehyd . DHAP og glyseraldehyd omdannes begge til glyseraldehyd-3-fosfat. Disse to konverteringene katalyseres av en triose fosfatisomerase (TPI) eller en triose kinase (TK) beskrevet ovenfor med forbruk av ATP. Hvis fruktokinase mangler, fører dette til fruktosuri , en autosomal recessiv arvelig sykdom, hos høyere dyr .
I andre organer kan heksokinasen også ta over funksjonen til fruktokinase for å fosforylere fruktose. Deres affinitet for glukose sammenlignet med fruktose er mye høyere (95% glukose, 5% fruktose).
Mannose
D - mannose er en komponent i forskjellige glykoproteiner og polysakkarider . For å kunne komme inn i glykolysen, fosforyleres mannose først av en heksokinase til mannose-6-fosfat med ATP-forbruk. Dette isomeriseres til slutt til fruktose-6-fosfat , som katalyseres av mannose-6-fosfatisomerase (også fosfomannose- isomerase , EC 5.3.1.8).
Sorbitol
Sorbitol kan oksyderes til glukose eller fruktose i polyolveien .
Galaktose
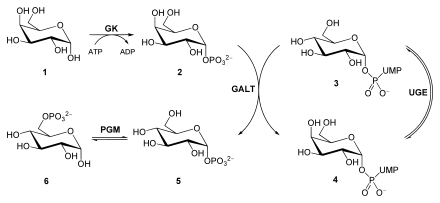
Når laktose brytes ned frigjøres D- glukose og D- galaktose. For å konvertere galaktose til C4-epimer glukose, blir sukkeret først omdannet til galaktose-1-fosfat av en galaktokinase (GK) ved bruk av ATP . En galaktose-1-fosfat uridyltransferase (GALT) katalyserer nå en utveksling av UDP- bundet glukose med galaktose. Dette produserer glukose-1-fosfat og UDP-galaktose . Mens glukose-1-fosfat isomeriseres til glukose-6- fosfat av en fosfoglukomutase (PGM), epimeriserer en UDP-glukose-4-epimerase (UGE) UDP-galaktose til UDP-glukose .
En defekt i galaktokinase manifesterer seg i den metabolske sykdommen galaktosemi .
Spesielle trekk ved grønne planter
I grønne planter er det noen variasjoner i glykolyse sammenlignet med dyr. Disse er beskrevet nedenfor.
Glykolyse i plastider
Det er kjent at i planter glykolysen utføres uavhengig av hverandre , ikke bare i cytoplasma, men også i plastider i cellen. Imidlertid går den ikke alltid helt der, da enzymer i amortiseringsfasen ofte mangler, for eksempel enolase eller fosfoglyseratmutase. Svært spesifikke translokatorer kan transportere mellomprodukter fra ett celleområde til et annet for å fullføre alle glykolysereaksjonstrinn. I cytosolen til mange encellede grønne alger mangler de cytosoliske enzymene for glykolyse, slik at dette foregår helt i kloroplastene.
Grønne planter bruker glykolyse i plastider for å bryte ned stivelse til pyruvat i mørket eller i ikke-fotosyntetisk vev med en gevinst i ATP og NADH. De gir også forskjellige forløpsmolekyler for konstruksjon av andre produkter, for eksempel for fettsyresyntese.
Isoenzymer er nødvendige for den parallelle driften av glykolyse både i cytoplasmaet og i plastidene . For eksempel er det en pyruvatkinase som er lokalisert i cytoplasmaet og en som katalyserer den analoge reaksjonen i plastiden. Alle isoenzymer er kodet i plantens genom . Plastidrepresentantene blir oversatt i cytoplasmaet til plantecellen og deretter transportert inn i organellen . Det er fremdeles uklart om isoenzymer skyldes genet duplisering fra et forløpergen. Horisontal genoverføring fra genomet til en prokaryot symbiont ( endosymbiont teori ) vil også være mulig .
Rollen av pyrofosfat
En annen spesiell funksjon er bruken av pyrofosfat (PP i ) i stedet for ATP som fosfatdonor i de første glykolytiske reaksjonene. Dette har også blitt observert hos noen bakterier. Normalt hydrolyseres pyrofosfat til to molekyler av fosfat av en pyrofosfatase (PPiase, EC 3.6.1.1). Hensikten med denne hydrolysen er å gjøre biokjemiske reaksjoner irreversible under fysiologiske forhold. Man snakker i det vanlige at denne hydrolysen "trekker" reaksjonen til den ene siden. Forklaringen på dette er at hydrolysen er eksergonisk, dvs. energi frigjøres i prosessen:
PPiase forekommer ikke i plantens cytosol, slik at en pyrofosfatkonsentrasjon på opptil 0,3 mmol / l kan oppstå der. Den pyrofosfatavhengige fosfofruktokinasen (PFP, EC 2.7.1.90), oppdaget i 1979, bruker pyrofosfat for fosforylering av fruktose-6-fosfat til fruktose-1,6-bisfosfat. Denne reaksjonen er også reversibel og kan også brukes til omvendt rute, glukoneogenese. I likhet med PFK-1 er PFP regulert av fruktose-2,6-bisfosfat.
Metabolisk mangfold i fosfoenolpyruvat
Planter bruker PEP fra glykolyse på forskjellige måter (se figur til høyre). Bruken av PEP er begrenset i den klassiske glykolytiske nedbrytningsveien: En pyruvatkinase (PK) bruker PEP som et substrat for direkte dannelse av pyruvat. ATP genereres av fosforylering av substratkjeder. I planter er dessuten PEP tjener også som et substrat for PEP carboxykinase (PEPC), som særlig i anlegg med C 4 - eller CAM-fotosyntese er viktig. Oksaloacetat , et mellomprodukt av sitronsyresyklusen, dannes av PEP og hydrogenkarbonat . Oksaloacetat reduseres deretter til L - malat av en cytosolisk malatdehydrogenase (MDH) . L- Malat blir deretter transportert til forskjellige organeller. I mitokondrionen kan den dekarboksyleres til pyruvat av et mitokondrie, NAD + -avhengig malatenzym (ME). Dette er en bypass-reaksjon av pyruvatkinase, hvor det ikke produseres ATP, men er nyttig i tilfelle fosfatmangel. Dette er fordi fosfatbundet i PEP frigjøres igjen og er tilgjengelig for anlegget for andre reaksjoner. Denne omkjøringsveien er demonstrert i røttene til erten .
Et plastid, NADP-avhengig malatenzym kan produsere pyruvat fra L- malat produsert av PEPC og MDH . Der kreves pyruvat for fettsyresyntese eller transporteres tilbake til cytosolen. Dette omgår også reaksjonen av pyruvatkinasen, noe som er fordelaktig hvis det er mangel på fosfat.
Hvis det mangler fosfat, kan en PEP-fosfatase (PEPase, EC 3.1.3.60) også frigjøre verdifull fosfat. Her transporteres PEP inn i vakuolen , hvor den hydrolyseres til pyruvat av en PEPase. Pyruvat og fosfat blir deretter transportert tilbake til cytoplasmaet. Hvis det ikke er fosfat mangel, blir det PEPase inhiberes ved en tilstrekkelig høy P i konsentrasjon.
Til slutt er det også et cytosolisk, fosfatuavhengig GADH (EC 1.2.1.9) som oksyderer glyseraldehyd direkte til 3-fosfoglyserat. Bare NADPH produseres, men ingen ATP.
regulering
Det er noen viktige forskjeller mellom reguleringen av enzymene som er involvert i glykolyse og hos dyr. PEP er en spesiell allosterisk effektor som, i motsetning til prosessen hos dyr, kan hemme PFK. Fruktose-1,6-bisfosfat kan derimot ikke aktivere pyruvatkinase. Mens fruktose-2,6-bisfosfat aktiverer PFK hos dyr, skjer ingenting som dette i planter.
Glykolyse i grønne planter reguleres primært av aktivitetene til pyruvatkinase og PEP-karboksykinase, og for det andre av PFK-1 og PFP. I prinsippet er det omvendt med dyr.
Glykolyse i archaea
I den sukkernedbrytende archaea brytes karbohydrater ned på forskjellige måter. I hypertermofile og termofile aerober, for eksempel Thermoplasma acidophilum ( Euryarchaeota ) eller Sulfolobus solfataricus (nå omklassifisert til Saccharolobus solfataricus [en] , Crenarchaeota ), omdannes glukose til pyruvat via en variant av Entner-Doudoroff-banen (ED-sti). I motsetning til dette bruker hypertermofile, gjærende anaerober karbohydrater i en modifisert EMP-vei, for eksempel:
- blant Euryarchaeota:
- Pyrococcus furiosus ,
- Archaeoglobus fulgidus [en] (en sulfatreduserende) og
- Representanter for slekten Thermococcus [en] ;
blant Crenarchaeota:
Metabolittene som forekommer i den ligner på glykolysen av eukaryoter og bakterier, men enzymer brukes til dette som ikke har noen likhet med bakterier eller eukaryoter. Archaea inneholder ADP- i stedet for ATP-avhengige kinaser, for eksempel glukokinase (EC 2.7.1.147) eller fosfofruktokinase (EC 2.7.1.146). I motsetning til bakterier har de ikke et PEP-avhengig sukkertransportsystem. Det siste trinnet i glykolyse, omdannelsen av PEP til pyruvat, kan også utføres av en pyruvatfosfatdikinase (PPDK, EC 2.7.9.1) i tillegg til PK. Dette enzym katalyserer den reversible omdannelse av PEP, AMP og PP jeg til pyruvat, ATP og P i , selv om dannelsen av pyruvat er foretrukket i Thermoproteus Tenax . T. tenax er en anaerobisk levende, fakultativ, heterotrofisk arkeon fra avdelingen Crenarchaeota . PPDK har også blitt påvist i bakterier og eukaryoter.
Det er en viktig forskjell i oksidasjonen av glyseraldehyd-3-fosfat. Dette oksyderes enten direkte til 3-fosfoglyserat av en NAD (P) + -avhengig (GAPN) eller en ferredoksin- avhengig dehydrogenase (GAPOR), men uten å inkorporere uorganisk fosfat. Derfor, i dette trinnet, dannes ingen ATP gjennom fosforylering av substratkjeden, slik at det i de fleste arkiaer ikke oppnås ATP formelt gjennom denne modifiserte glykolysen. Den best studerte glykolyse metabolske banen i archaea er den av P. furiosus . Der er nettresponsen:
En annen viktig forskjell er mangelen på allosterisk regulering av nøkkelenzymene med effektorene, som ble beskrevet ovenfor for bakterier og eukaryoter. I T. tenax er det i det minste indikasjoner på at GAPN er allosterisk aktivert av AMP, glukose-1-fosfat, fruktose-6-fosfat, fruktose-1-fosfat, ADP og ribose-5-fosfat, mens NAD (P) H , NADP + og ATP hemmer enzymet. Regulering på transkripsjonsnivå kan også finne sted, slik det er tilfelle med GAPDH funnet i T. tenax .
utvikling
Glykolyse finnes i de fleste bakterier og eukaryoter, og i en noe modifisert form i archaea og hyperthermophilic bakterier. Dette antyder at glykolyse ble etablert veldig tidlig i evolusjonen og allerede var tilstede i de første organismer. Ved fylogenetiske sammenligninger med termofile og hypertermofile mikroorganismer mistenkes at EMP-banen etter ED-banen har dukket opp. I tillegg var den opprinnelige betydningen av EMP-banen sannsynligvis ikke i nedbrytningen av karbohydrater, men det var omvendt som glukoneogenese å bygge opp glukose. Dette støtter også teorien om at metabolske veier for å bygge karbohydrater dukket opp tidligere i evolusjonen enn de som bryter ned karbohydrater; "Dagens" glukoneogenese er mer utbredt i organismer på alle tre domener enn glykolyse.
Enzymer i den nedre grenen av glykolyse (amortiseringsfase) katalyserer for det meste reaksjoner som er reversible og som er mest konserverte. De finnes også i den fylogenetisk eldre ED-banen. Som andre metabolske veier, var de sannsynligvis allerede til stede før separasjonen av de tre domenene til levende ting, og er derfor blant de eldste enzymene. På grunn av deres viktige betydning kunne de verken gå tapt eller erstattes av andre enzymer over tid. Glyseraldehyd-3-fosfatdehydrogenase er den mest konserverte av alle glykolytiske enzymer; bare 3% av det katalytiske domenet har endret seg på 100 millioner år.
Den øvre grenen av glykolyse (forberedende fase) etablerte seg sannsynligvis senere. Mens enzymene som er involvert i bakterier og eukaryoter viser høye homologier, er enzymene som finnes i archaea unike. Det diskuteres fremdeles om enzymer for den første delen av glykolyse opprinnelig gikk tapt i archaea og først ble introdusert senere gjennom horisontal genoverføring . Alternativt kunne enzymer med lignende funksjoner ha blitt brukt til den opprinnelige glykolysen, som deretter var gjenstand for store modifikasjoner og sekvensendringer. I begge tilfeller kan dette forklare hvorfor glykolytiske enzymer i archaea er så forskjellige fra de i andre organismer.
litteratur
- Geoffrey Zubay: biokjemi. Mcgraw-Hill Professional. 4. utgave. 1999, ISBN 3-89028-701-8 , s. 293ff.
- Donald Voet, Judith G. Voet: Biokjemi. Wiley-VCH 1994, ISBN 3-527-29249-7 , s. 420ff.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 6 utgave. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 , s. 486ff.
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (oversetter): Biokjemi. 4. oppdaterte utgave. Pearson Studium, 2008, ISBN 978-3-8273-7312-0 , s. 442ff.
- Reginald Garrett, Charles M. Grisham: Biokjemi. (International Student Edition). 4. utgave. Cengage Learning Services, 2009, ISBN 978-0-495-11464-2 , s. 535-562.
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (første): Lehninger Biochemie. 4., fullstendig revidert og eksp. Utgave. Springer, Berlin 2009, ISBN 978-3-540-68637-8 , s. 607-730.
- Ron S. Ronimus, Hugh W. Morgan: Distribusjon og fylogenier av enzymer i Embden-Meyerhof-Parnas-banen fra archaea og hyperthermophilic bakterier støtter en glukoneogen opprinnelse av metabolisme. I: Archaea 1 (3) 2003, s. 199–221, PMID 15803666 , PMC 2685568 (fri fulltekst)
- WC Plaxton: Organisering og regulering av plante glykolyse. I: Annu Rev Plant Physiol Plant Mol Biol.47 (1996), s. 185-214, PMID 15012287 , doi : 10.1146 / annurev.arplant.47.1.185
- T. Dandekar, S. Schuster, B. Snel, M. Huynen, P. Bork: Pathway alignment: anvendelse på den komparative analysen av glykolytiske enzymer . I: Biochem. J .. 343 Pt 1, oktober 1999, s. 115-24. PMID 10493919 . PMC 1220531 (gratis fulltekst).
Individuelle bevis
- ↑ C. Cagniard-Latour: Mémoire sur la fermentation vineuse. I: Annales de chimie et de physique . Vol. 68, 1837, s. 206-222.
- ↑ Theodor Schwann: Foreløpig kommunikasjon om eksperimenter med gjæring og forråtnelse. I: Annaler for fysikk og kjemi . Vol. 41, 1837, s. 184-193.
- ↑ FT Kützing: Mikroskopiske undersøkelser av gjær og modereddik , sammen med flere andre tilknyttede vegetabilske strukturer. I: Journ. Praktisk kjem . 11 (1837), s. 385-409.
- ^ E. Racker: Historie om Pasteur-effekten og dens patobiologi. I: Mol Cell Biochem. 5 (1-2) 1974, s. 17-23, PMID 4279327 , doi : 10.1007 / BF01874168 .
- Lie J. Liebig: Om fenomenene gjæring, forråtnelse og forråtnelse og deres årsaker. I: Annals of Pharmacy. (Heidelberg) 30 (1839), s. 250-287.
- ^ L. Pasteur: Memoire sur la fermentaçion alcoolique. I: Annales de chimie et de physique. 58 (1860), s. 323-426.
- ↑ M. Traube In: Ann. Phys. Chem. (Poggendorff) 103 (1858), s. 331-344.
- Buch E. Buchner: Alkoholholdig gjæring uten gjærceller (foreløpig kommunikasjon). I: Ber. Dt. Chem. Ges . 30 (1897), s. 117-124. (på nett)
- ↑ Athel Cornish-Bowden: Ny ølflaske i en gammel Eduard Buchner og veksten av biokjemisk kunnskap. ISBN 84-370-3328-4 , s. 60.
- ↑ A. Harden, WJ Young: The Alcoholic gjære av gjær Juice. I: Proc. R. Soc. Lond. B 77 (519) 1906, s. 405-420, doi : 10.1098 / rspb.1906.0029 .
- ↑ A. Harden, WJ Young: The Alcoholic gjære av gjær Juice. Del III.-Funksjonen til fosfater i gjæringen av glukose med gjærsaft. I: Proc. R. Soc. Lond. B 80 (540) 1908, s. 405-420, doi : 10.1098 / rspb.1908.0029 .
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (red.), Werner Müller-Esterl (red.): Biochemie. Wiley-VCH 1992, ISBN 3-527-28242-4 , s. 421f.
- ^ N. Kresge, RD Simoni, RL Hill: Otto Fritz Meyerhof og belysning av glykolytisk vei. I: J Biol Chem . 280 (4) 2005, s. E3, PMID 15665335 , PDF (gratis fullteksttilgang, engelsk)
- ^ Albert L. Lehninger, David L. Nelson, Michael M. Cox: Lehninger Biochemie. 3., fullstendig revidert og eksp. Utgave. Springer, Berlin 2009, ISBN 978-3-540-41813-9 , s. 584ff.
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (red.), Werner Müller-Esterl (red.): Biochemie. Wiley-VCH, 1992, ISBN 3-527-28242-4 , s. 444.
- ↑ Hans W. Heldt, Birgit Piechulla: Plant biokjemi . 4. utgave. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , s. 334.
- ^ Reginald Garrett, Charles M. Grisham: Biokjemi. (International Student Edition). 4. utgave. Cengage Learning Services, 2009, ISBN 978-0-495-11464-2 , s. 535.
- ↑ Hans W. Heldt, Birgit Piechulla: Plant biokjemi . 4. utgave. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , s. 334.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 6 utgave. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 , s. 764.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plantebiokjemi. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5 , s. 145.
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (oversetter): Biochemie. Pearson-studie. 4. oppdaterte utgave. 2008, ISBN 978-3-8273-7312-0 , s. 448.
- ↑ a b c R. & nnbsp; S. Ronimus, H. & nnbsp; W. Morgan: Distribusjon og fylogenier av enzymer i Embden-Meyerhof-Parnas-banen fra archaea og hyperthermophilic bakterier støtter en glukoneogen opprinnelse av metabolisme. I: Archaea . 1 (3) 2003, s. 199-221, PMID 15803666 , PMC 2685568 (fri fulltekst).
- ↑ a b Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plantebiokjemi. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5 , s. 148.
- ↑ David Nelson, Michael Cox: Lehninger Biochemie. Springer, Berlin; 4., fullstendig revidert og eksp. Utgave. 2008, ISBN 978-3-540-68637-8 , s. 713.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plantebiokjemi. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5 , s. 150.
- ^ A b c d Reginald Garrett, Charles M. Grisham: Biochemistry. (International Student Edition). 4. utgave. 2009, Cengage Learning Services, ISBN 978-0-495-11464-2 , s. 538.
- ^ A b David L. Nelson, Michael M. Cox: Lehninger Principles of Biochemistry. 5. utgave. Palgrave Macmillan, 2008, ISBN 978-0-7167-7108-1 , s. 553.
- ^ Reginald Garrett, Charles M. Grisham: Biokjemi. (International Student Edition). 4. utgave. Cengage Learning Services, Australia 2009, ISBN 978-0-495-11464-2 , s. 539.
- ^ S. Minakami, H. Yoshikawa: Studier på erytrocytglykolyse. II Fri energiendringer og hastighetsbegrensende trinn i erytrocytglykolyse. I: J. Biochem. Vol. 59 (2) 1966, s. 139-144, PMID 4223318 .
- Min S. Minakami, H. Yoshikawa: Termodynamiske betraktninger ved erytrocytglykolyse. I: Biochem. Biophys. Res. Commun. Vol. 18 (3) 1965, s. 345-349, PMID 14300746 , doi : 10.1016 / 0006-291X (65) 90711-4 .
- ^ Reginald Garrett, Charles M. Grisham: Biokjemi. (International Student Edition). 4. utgave. Cengage Learning Services, Australia 2009, ISBN 978-0-495-11464-2 , s. 554.
- ↑ Athel Cornish-Bowden: Ny ølflaske i en gammel Eduard Buchner og veksten av biokjemisk kunnskap. Universitat de Valencia, Valencia 1997, ISBN 84-370-3328-4 , s. 148.
- ^ Reginald Garrett, Charles M. Grisham: Biokjemi. (International Student Edition). 4. utgave. 2009, Cengage Learning Services, ISBN 978-0-495-11464-2 , s. 537.
- ^ EA Newsholme et al.: Aktivitetene med fruktose difosfatase i flymusklene fra humla og rollen til dette enzymet i varmegenerering. I: Biochem J . 128 (1) 1972, s. 89-97, PMID 4343671 , PMC 1173573 (fri fulltekst).
- ^ A b Reginald Garrett, Charles M. Grisham: Biochemistry. (International Student Edition). Cengage læringstjenester; 4. utgave. 2009, ISBN 978-0-495-11464-2 , s. 539f.
- ↑ a b c David Nelson, Michael Cox: Lehninger Biochemie. 4., fullstendig revidert og eksp. Utgave. Springer, Berlin 2008, ISBN 978-3-540-68637-8 , s. 773ff.
- ^ Reginald Garrett, Charles M. Grisham: Biokjemi. (International Student Edition). Cengage Learning Services. 4. utgave. 2009, ISBN 978-0-495-11464-2 , s. 542f.
- ↑ Müller-Esterl, Werner.: Biokjemi: en introduksjon for leger og naturforskere . 1. utgave. Elsevier, Spektrum, Akad. Verl, München 2004, ISBN 3-8274-0534-3 , pp. 496 f .
- ↑ a b c H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (oversetter): Biochemie. Pearson-studie. 4. oppdaterte utgave, 2008, ISBN 978-3-8273-7312-0 , s. 468.
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (oversetter): Biochemie. Pearson-studie. 4. oppdaterte utgave, 2008, ISBN 978-3-8273-7312-0 , s. 470.
- D Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman: BRS Biochemistry, Molecular Biology, and Genetics. 5. utgave. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , s.65 .
- ↑ A. Harden, WJ Young: The Alcoholic gjære av gjær Juice. Del VI.-Innflytelsen av arsenater og arsenitter på gjæringen av sukker med gjærsaft. I: Proc. R. Soc. Lond. B 83 (566) 1911, s. 451-475, doi : 10.1098 / rspb.1911.0028 .
- D Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman: BRS Biochemistry, Molecular Biology, and Genetics. 5. utgave. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , s. 123.
- ^ A b W. C. Plaxton: Organiseringen og reguleringen av plante glykolyse. I: Annu Rev Plant Physiol Plant Mol Biol. 47 (1996), s. 185-214, PMID 15012287 , doi : 10.1146 / annurev.arplant.47.1.185 .
- ^ Rudolf K. Thauer, Kurt Jungermann, Karl Decker: Energibesparelse i kjemotrofiske anaerobe bakterier. I: Bakteriologiske anmeldelser . Vol. 41, nr. 1, 1977, s. 101.
- ^ B. Siebers, P. Beauty: Uvanlige veier og enzymer av sentral karbohydratmetabolisme i Archaea. I: Curr Opin Microbiol . 8 (6) 2005, s. 695-705, PMID 16256419 , doi : 10.1016 / j.mib.2005.10.014 .
- ↑ M. Zaparty et al.: Den sentrale karbohydratmetabolismen til den hypertermofile crenarchaeote Thermoproteus tenax: veier og innsikt i deres regulering. I: Arch Microbiol . 190 (3) 2008, s. 231-245, PMID 18491075 , doi : 10.1007 / s00203-008-0375-5 .
- ↑ C. & nnbsp; H. Verhees et & nnbsp; al. : De unike egenskapene til glykolytiske veier i Archaea. I: Biochem J . 375 (Pt & nnbsp; 2) 2003, s. 231-246, PMID 12921536 , PMC 1223704 (fri fulltekst).
- ^ AH Romano, T. Conway: Evolusjon av karbohydratmetabolske veier. I: Res. Microbiol. Vol. 147 (6-7), 1996, s. 448-455, PMID 9084754 ; doi : 10.1016 / 0923-2508 (96) 83998-2
- ↑ RS Ronimus, HW Morgan: Distribusjon og phylogenies av enzymer av Embden-Meyerhof-Lotte reaksjonsvei fra archaea og hyperthermophilic bakterier understøtte en gluconeogenisk opprinnelse av metabolismen. I: Archaea 1 (3) 2003, s. 199-221, PMID 15803666 , PMC 2685568 (fri fulltekst).
weblenker
- Glykolyse på Ulrich Helmichs hjemmeside
- Jennifer McDowall / Interpro: Månedens protein: Enzymer av glykolyse. (engl.)