Åndedrettskjede

| Foreldre |
|
Elektrontransportkjeden Cell åndedrett oksidativ fosforylering |
| Underordnet |
| Åndedrettskjede av cellemembranen Åndedrettskjede av mitokondriell membran |
| Genontologi |
|---|
| QuickGO |
| Foreldre |
|
Cellemembran mitokondrie membran |
| Underordnet |
|
Kompleks I Kompleks II Kompleks III Kompleks IV |
| Genontologi |
|---|
| QuickGO |
Den respiratoriske kjeden er en del av energiomsetningen i de fleste levende ting . På den ene siden betegner uttrykket respirasjonskjede en metabolsk vei , nemlig en kjede av biokjemiske redoksreaksjoner som finner sted etter hverandre , som de levende vesener bruker til å generere energi, og på den andre siden også hele proteinkompleksene deltar i den metabolske banen .
Åndedrettskjeden er et spesielt tilfelle av en elektrontransportkjede og danner sammen med kjemiosmose prosessen med oksidativ fosforylering .
Elektroner levert av NADH , FMNH 2 og FADH 2 overføres til et oksidasjonsmiddel i en serie redoks-prosesser . Så - spesielt med eukaryoter, - den exergonic reaksjonen av hydrogen (H 2 ) og oksygen (1/2 O 2 ) til vann er delt opp i enkelte trinn. I stedet for en potensielt eksplosiv varmeutvikling, blir den frigitte energien brukt til å syntetisere den universelle "energivalutaen" til cellen , ATP , fra ADP og fosfat ( oksidativ fosforylering ). Hydrogenet og elektronbærerne NADH og FADH 2- bundet elektroner og hydrogen bundet dertil stammer fra oksydasjon av eksterne elektrondonorer, for eksempel - ved hjelp av Krebs-syklusen - nedbrytningen av fettsyrer og glykolyse .
I eukaryoter er luftveiskjeden lokalisert i mitokondriens indre membran , i prokaryoter i cellemembranen . Det er også andre elektrondonorer enn fett og sukker og andre elektronakseptorer enn oksygen.
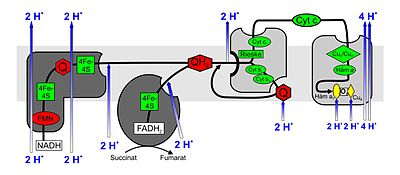
Åndedrettskjede som en elektrontransportkjede
Elektrontransportkjeder består av en serie redoksmolekyler koblet i serie som er i stand til å akseptere eller frigjøre elektroner. Via denne kjeden overføres elektroner fra høyere energinivåer til lavere, faller de så å si nedover i trinn, hvorved de enkelte redoksmolekylene har et stadig lavere energinivå. I eukaryoter er enzymkompleksene I til IV og hydrogen- eller elektronbærerne ubiquinon (koenzym Q) og cytokrom c , som er innebygd i den indre mitokondriale membranen, involvert i reaksjonskjeden . Proteinene som er involvert i elektrontransportkjeden (kompleksene I - IV) og elektronbærerne ubiquinon og cytokrom c danner et (komplekst) redoks-system .
Elektrontransport er assosiert med opptak og frigjøring av protoner. Gjennom den romlige organisasjonen av disse prosessene eller ved hjelp av konformasjonsendringer i proteinstrukturen forårsaket av strømmen av elektroner , blir "protoner (H + )" transportert "(reell eller som en nettoeffekt). Dette skaper en “elektrokjemisk protongradient ” (sammensatt av forskjellen i konsentrasjon av protonene og det negative membranpotensialet inne i mitokondriene som genereres ved fjerning av de positivt ladede protonene). Energien i denne “elektrokjemisk proton-gradient” ( proton bevegelseskraft , “pmf”) blir brukt ved en ATP-syntase gjennom tilbakediffusjon av protoner i den indre mitokondrie-membran , i henhold til nå generelt akseptert chemiosmotic teori av Peter D. Mitchell , ATP fra ADP og uorganisk For å syntetisere fosfat (i sjeldne tilfeller også fruktose). Denne fosforyleringen kalles respiratoriske kjede fosforylering eller oksidativ fosforylering (forkortelse: Oxphos ) på grunn av koplingen til den respiratoriske kjede .
Funksjoner av kompleksene i luftveiskjeden
I tillegg til den ytre membranen inneholder en mitokondrion også en indre membran . Rommet mellom disse to membranene kalles det intermembrane rommet (perimitokondrieområdet).
Tre av de fire kompleksene i luftveiskjeden strekker seg hver over den indre mitokondriale membranen (integrert), mens kompleks II ender "blind" (perifer). En protonkonsentrasjonsforskjell genereres mellom intermembranrommet og det indre ( matriksen ) av mitokondrionen, som deretter brukes i ATP-syntase for syntese av ATP.
Kompleks I.
NADH: ubiquinonoksydoreduktase eller NADH dehydrogenase . Dette enorme enzymkomplekset (940 kDa ) redusert av NADH , spesielt fra sitronsyresyklusen , ubiquinon (UQ eller Q) for Ubihydrochinon også ubiquinol (UQH 2 eller QH 2 gitt). Komplekset består av to deler som sammen skaper den karakteristiske L-formen. Flavinholdige nukleotider ( FMN ) og jern-svovelsentre kreves som protesegrupper i en enhet for å katalysere redoksreaksjonen. På grunn av elektrontransporten som er forbundet med redoksreaksjonene, pumpes 3–4 protoner per oksidert NADH inn i mellomrommet. Det antas at koblingen med protontransporten skjer gjennom en konformasjonsendring av enzymet.
Kompleks II
Succinat: ubiquinonoksydoreduktase eller succinatdehydrogenase . Kompleks II er enzymet succinatdehydrogenase fra sitronsyresyklusen. Under reaksjonen i sitronsyresyklusen oksyderes suksinat til fumarat . FAD er en protesegruppe i enzymet. Den overfører elektronene i kompleks II til ubiquinon, som er redusert til ubihydrokinon. Kompleks II inneholder også jern-svovelsentre, slik som kompleks I; Imidlertid pumpes ingen protoner inn i mellomrommet.
Kompleks III
Ubihydrokinon (ubiquinol): cytokrom c oksidoreduktase eller cytokrom c reduktase . Ved kompleks III bidrar Q-syklusen til genereringen av protonkonsentrasjonsforskjellen gjennom asymmetrisk absorpsjon og frigjøring av protoner. Under oksydasjonen av ubiquinol (QH 2 ) til ubiquinon (Q) reduseres ett molekyl av cytokrom c i en syklus for hver frigitt elektron (fra ubiquinol) og to protoner frigjøres i mellomrommet. Den annen elektron reduserer en annen ubikinon på et annet bindingssted på den mitokondrielle matriks, først til den frie radikaler ubisemiquinone (QH), deretter til QH 2 , hvorved to protoner er absorbert fra matrisen.
Etter de to halvsyklusene frigjøres fire protoner per ubiquinolmolekyl i intermembranområdet, to protoner fjernes fra mitokondriell matrise og to cytokrom c reduseres. I kompleks III finner en avledning fra en to-elektrontransportør (ubiquinol) til en en-elektrontransportør (cytokrom c ) sted.
Kompleks IV
Cytokrom c : O 2 oksidoreduktase eller cytokrom c oksidase . I kompleks IV oksyderes cytokrom c og oksygen reduseres til vann. Den energi som frigjøres anvendes til protoner fra matrisen plass i intermembranrommet pumpen .
Ved kompleks IV oksyderes cytokrom c og et elektron overføres til komplekset. Etter den påfølgende overføringen av fire elektroner (e - ), kan et bundet oksygenmolekyl reduseres til to vannmolekyler (H 2 O). De fire protonene (H + ) som kreves for dette, trekkes ut av matrisen. Energien som frigjøres under reduksjon av oksygen til vann , brukes av enzymet til å pumpe ytterligere fire protoner per oksygenmolekyl fra matrisen via den indre mitokondrie-membranen inn i mellomrommet. Dette skjer ved endringer i den romlige strukturen: I en konformasjon har et protein høy affinitet for H + og aksepterer derfor et proton. I motsatt konformasjon er det lav affinitet og protonen frigjøres på utsiden av membranen.
Cytochrome c oxidase er et transmembranprotein med to hem a- molekyler (hem a og hem a 3 ) som protesegrupper og to kobbersentre (Cu A og Cu B ) som medfaktorer . Den enzym er ansvarlig for nesten alle oksygenforbruk (dannelse av vann fra oksygen og hydrogen i respirasjonskjeden) av alle oksygenpuste organismer.
Åndedrettskjedehemmere

Det er identifisert en rekke hemmere som hemmer elektrontransportkjeden på forskjellige punkter:
- Rotenon og amobarbital (Amytal) hemmer kompleks I (NADH oksidase). Imidlertid, siden elektronoverføringen fra FADH2 til kompleks II ikke påvirkes, kan oksidativ fosforylering fortsatt finne sted.
- Malonat og en rekke soppdrepende stoffer (SDHI) hemmer kompleks II (succinatdehydrogenase).
- Antibiotikumet antimycin A hemmer kompleks III (cytokrom c reduktase); den blokkerer overføringen av elektroner fra cytokrom b til cytokrom c1 ; komponentene i luftveiskjeden foran virkningsstedet til antimycin A i kompleks III forblir redusert, alt bak forblir oksidert. Dette hemmer forbruket av oksygen i kompleks IV og syntesen av ATP i kompleks V. Soppdrepende stoffer fra klassen strobiluriner hemmer også kompleks III ved punkt Q o .
- Cyanider , azider og karbonmonoksid hemmer kompleks IV (cytokrom c oksidase); disse molekylene blokkerer bindingsstedet for oksygen . Som et resultat fører dette til en akkumulering av elektroner, som et resultat av at komponentene i åndedrettskjeden er fullstendig redusert og åndedrettskjeden stopper opp. Cyanidforgiftning får venene til å se røde ut fordi oksygenet fra hemoglobinet i arterioler ikke kan diffundere inn i cellene fordi det ikke konsumeres der. Slik kommer oksygenrikt blod inn i venene.
- antibiotikumet oligomycin hemmer ATP-syntase ved å binde seg til dets bane (F o del, o for olygomycinsensitiv), noe som betyr at protongradienten brytes ned mye saktere. Som et resultat avtar elektronstrømmen for å opprettholde denne gradienten betydelig, og oksygenforbruket avtar. Oligomycin fungerer også som en avkobler. I den aktuelle litteraturen skilles det ikke mellom F 0 (null) og F o .
- Biguanider som diabetesmedikamentet metformin virker antagelig ved å hemme kompleks I.
Alle de tidligere nevnte hemmere av luftveiskjeden fører til redusert oksygenforbruk. Hemmere, kjent som avkobler, oppfører seg annerledes.
Avkobler av luftveiskjeden
Avkoblerne ( protonoforer ) reduserer mitokondriell membranpotensial (protongradient). Ved å gjøre dette avbryter de koblingen mellom oksidasjon og fosforylering. Som et resultat foregår elektrontransporten og funksjonen av kompleksene I til IV fullstendig, men protongradienten som er bygd opp under denne prosessen blir kansellert av avkoblingen. Dette betyr at ingen syntese av ATP kan forekomme. Fordi protoner ikke lenger trenger å bli translokert mot en elektrokjemisk gradient, går oksidasjonstrinnene i kompleksene I til IV mye raskere. Samtidig fører dette til økt forbruk av oksygen.
- naturlige frakoblinger:
- Thermogenin , se også brunt fettvev .
- kunstige frakoblinger:
- 2,4-Dinitrophenol er en svak syre. Den protoneres over den indre mitokondrielle membranen på grunn av overflod av H + -ioner (lavere pH ), kan deretter passere gjennom membranen og deprotoneres intramitokondrialt (høyere pH).
- Karbonylcyanid-m-klorfenylhydrazon (CCCP)
- Karbonylcyanid p- trifluormetoksyfenylhydrazon (FCCP)
- Pentaklorfenol (PCP)
litteratur
- M. Saraste: Oksidativ fosforylering ved fin de siecle . I: Science , bind 283, 1999, nr. 5407, s. 1488-1493, PMID 10066163 .
- Löffler, Petrides: Human biochemistry . 7. utgave.
weblenker
- Oksidativ fosforylering - Referansebane . KEGG (grafisk fremstilling av mitokondrie respirasjonskjedekomplekser, engelsk)
- Mitokondrieveier: Oksidativ fosforylering . (Engelsk)
- Pedro Silva: Den kjemiske logikken bak ... Respirasjon og gjæring . (Engelsk)
- Elektron transportkjede (animert illustrasjon)
- Elektron transportkjede . Jassal / reactome
Individuelle bevis
- ↑ a b Bruce Alberts et al.: Molecular biology of the cell . 4. utgave. New York 2002, s. 773-793
- ↑ RG Efremov, R. Baradaran, LA Sazanov: Arkitekturen til respirasjonskompleks I. I: Nature . Volum 465, nummer 7297, mai 2010, s. 441-445, doi: 10.1038 / nature09066 . PMID 20505720 .
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biochemistry . 6. utgave. Spektrum-Verlag, 2007.
- ↑ Bruce Alberts et al.: Molecular biology of the cell . 4. utgave. New York 2002, s.791
- D Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman: BRS Biochemistry, Molecular Biology, and Genetics . 5. utgave. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , s. 89.
- ↑ LS Huang, D. Cobessi et al. Binding av respirasjonskjeden inhibitor antimycin til den mitokondrielle BC1 komplekset: en ny krystallstruktur viser en endret intramolekylær hydrogenbinding mønster. I: Journal of molecular biology . Volum 351, nummer 3, august 2005, s. 573-597, doi: 10.1016 / j.jmb 2005.05.053 . PMID 16024040 . PMC 1482829 (fri fulltekst).
- Brid HR Bridges, VA Sirviö et al.: Molekylære trekk ved biguanider som kreves for målretting av mitokondrie respiratorisk kompleks I og aktivering av AMP kinase. I: BMC biologi. Volum 14, august 2016, s. 65, doi: 10.1186 / s12915-016-0287-9 , PMID 27506389 , PMC 4977651 (fri fulltekst).