Oxyhydrogen

Elektrolytisk gass , også kjent som oxyhydrogen eller HHO i engelskspråklige land, er en eksplosiv blandet gass laget av hydrogen (H 2 ) og oksygen (O 2 ). Når den kommer i kontakt med åpen ild (glør eller gnister), oppstår den såkalte oksyhydrogenreaksjonen. En ferdig blanding av hydrogen og oksygen i molforholdet 2: 1 er eksplosiv selv i små mengder. Hvis det derimot bare brukes hydrogen som utgangsprodukt og det blandes med luft under atmosfærisk trykk, må volumfraksjonen av hydrogen være mellom 18 og 76 volumprosent . Hvis disse grenseverdiene faller under eller overskrides, oppstår ikke lenger en eksplosjon / detonasjon . Blandinger av luft og 4 til maksimalt 18 vol% hydrogen er også brannfarlige, men ikke eksplosive. En kontinuerlig oksyhydrogengassflamme kan oppnås ved kontrollert forbrenning ved en blandedyse .
Dannelsen av oksyhydrogen ble observert på 1600-tallet av Théodore Turquet de Mayerne (rundt 1620) og Robert Boyle (rundt 1670) gjennom virkningen av syrer på metaller. Henry Cavendish og Joseph Priestley fulgte etter på 1770- og 1780-tallet .
Produksjon
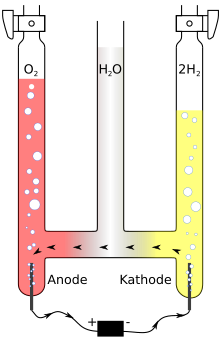
Knall kan fremstilles ved elektrolyse av vann , det vil si den elektrolytiske spaltning av vann (H 2 O) eller ved termisk spaltning av vann. Den termiske nedbrytningen av vann krever temperaturer over 2500 ° C.
Ved vannelektrolyse skjer spaltingen ved hjelp av elektrisk strøm . Elektrodene er nedsenket i vann, og den elektriske ledningsevnen kan forbedres enormt ved å tilsette en syre eller base . For å redusere risikoen for utilsiktet antenning, blir gassene som bobler opp fra de to elektrodene - dvs. hydrogenet over katoden (negativ pol) og oksygen over anoden (positiv pol) - samlet i en såkalt Hofmann-vannnedbrytning apparater .
Oxyhydrogen reaksjon
Den knall reaksjon er en eksoterm og detonasjon-lignende reaksjon av hydrogen med oksygen og løper på en detonasjon hastighet på 2820 m / sek. Det er en form for forbrenning ( oksidasjon ) og ofte også en eksplosjon .
Den reaksjon ligning er:
Det er et sterkt forgrenet kjede reaksjon som omfatter hydrogen, oksygen og hydroksyl - radikaler som kjeden bærer.
og andre reaksjoner
Reaksjonsproduktet er vann .
Den energi som frigjøres pr molar formel konvertering er 571,6 kJ / mol (Δ r H 0 = -571,6 kJ / mol). Dette endrer entalpi H for en mol av det resulterende vannet med −286 kJ / mol.
I tillegg produseres hydrogenperoksid :
Oksyhydrogenreaksjonen er sterkt trykk- og temperaturavhengig. Ved veldig lave trykk kan de resulterende kjedebærerne nå karveggen og rekombinere der. Dette forhindrer kjedeforlengelse eller forgrening og forhindrer eksplosjon. Hvis trykket økes, når blandingen den nedre eksplosjonsgrensen. Den gjennomsnittlige frie banen er nå blitt så liten at kjedebærerne kolliderer med andre partikler før de når karveggene og fortsetter kjedereaksjonen. Hvis trykket økes ytterligere, når systemet den øvre eksplosjonsgrensen. Det høye trykket øker sannsynligheten for trepartikkelskollisjoner, slik at kjedebærere også kan rekombinere i gassfasen og kjedereaksjonen brytes av. Ved enda høyere trykk oppstår endelig en termisk eksplosjon. Her kan ikke energien som frigjøres under reaksjonen lenger spres raskt nok, og reaksjonstemperaturen økes. Dette fører til ytterligere reaksjoner, hvis energi ikke lenger kan spres. Den termiske eksplosjonen er basert på en drastisk økning i temperatur og ikke på en kjedeforgreningsreaksjon.
I de eukaryote cellene som lever i mitokondriene , fører sluttoksidasjonen i kompleks IV i luftveiskjeden til en analog, men strengt kontrollert, eksergonisk reaksjon (noen ganger, ikke helt riktig, referert til som en "biologisk oksyhydrogenreaksjon"). H. dannelsen av ATP- molekyler tjener:
Den frie entalpi ΔG ° 'av reaksjonen skyldes redokspotensialet (+0,5 V) og er under fysiologiske forhold (pH 7) -193 kJ / mol.
Den samme reaksjonen skjer også i brenselcellen . I sin konstruksjon brukes energien som frigjøres under oksyhydrogenreaksjonen ( entalpiforskjell ), her mer presist: fri entalpi eller Gibbs energi AG, uten å forårsake en eksplosjon . Entalpien som frigjøres frigjøres delvis som elektrisk strøm og delvis som varme. Imidlertid skjer reaksjonen i brenselcellen sakte og på en kontrollert måte.
Oxyhydrogen-prøve
I kjemi betegner begrepet oxyhydrogen sample bevis på hydrogen . Dette er imidlertid uspesifikt, siden z. B. metan danner en eksplosiv blanding med oksygen, og brukes derfor bare til å demonstrere eksplosjonen. En trygg måte å oppdage oxyhydrogen er å kontrollere blandingsforholdet, som vanligvis bare er enkelt å gjøre med lukket apparat i liten skala.
For deteksjonen holdes gassen som skal kontrolleres vanligvis i et prøverør med åpningen nedover, slik at hydrogen ikke kan slippe ut på grunn av dens lavere tetthet enn luft, nær en antennelseskilde - for eksempel en Bunsen-brenner eller lighter .
Tilfelle 1: Gassen som er samlet er rent hydrogen. Det er en rolig forbrenning eller muligens en svak deflagrasjon (negativ oksyhydrogengassprøve).
Tilfelle 2: Oppsamlet gass er en blanding av hydrogen og oksygen (oxyhydrogen). Forbrenningen skjer med en plystrende lyd (positiv detonerende gassprøve).
På grunn av de forskjellige lydene av rent hydrogen og blandingen av hydrogen og oksygen, brukes oksyhydrogenprøven også til å kontrollere renheten av hydrogengass for å unngå en eksplosjon i et lukket kar.
En lignende reaktiv gassblanding av hydrogen og klor er kjent som klordetonerende gass .
bruk
Johann Wolfgang Döbereiner oppdaget at oksyhydrogenreaksjonen også kan settes i gang ved hjelp av en platinatråd som katalysator . Noen år senere lyktes han i å tenne en oksyhydrogengassblanding under påvirkning av en platinsvamp . Denne oppdagelsen førte til oppfinnelsen av den første lighter (Döbereiner platina lighter ).
I dag brukes en blanding av hydrogen og oksygen også i tekniske applikasjoner (for sveising og skjæring) i såkalte oxyhydrogenblåsere, som kan nå en flammetemperatur på opptil ca. 2000 ° C (en type oxy-fuel sveiseinnretning. ). En av de første slike blåserne var " Daniellsche Hahn " fra 1833.
Ulykker
Det har allerede skjedd mange ulykker over hele verden på grunn av oksyhydrogeneksplosjoner, noen av dem katastrofale.
Krasjet av Hindenburg Zeppelin i 1937, ofte nevnt som et eksempel , der hydrogengassen slapp ut i luftatmosfæren gjennom en mindre lekkasje når den nærmet seg ankermasten og forårsaket en enorm hydrogenbrann, var ikke en oksyhydrogenreaksjon fordi volumfraksjonen av hydrogen var for høy og oksygenkonsentrasjonen i luften for lav.
Mer nylig har hydrogeneksplosjoner blitt spesielt kjent under Tsjernobyl-katastrofen i 1986 og Fukushima-atomkatastrofen i 2011 .
litteratur
- Gerhart Jander, Hans Spandau, Jürgen Fenner, Rolf Minkwitz: Kort lærebok for uorganisk og generell kjemi. 10. utgave, Springer, Berlin / Heidelberg 1987, ISBN 978-3-540-16749-5 .
- Peter W. Atkins, Julio de Paula: Kort lærebok for fysisk kjemi . 4. utgave. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31807-0 , pp. 512-513 .
Individuelle bevis
- ↑ Grunnleggende om uorganisk kjemi I: Hovedgruppeelementer (PDF; 722 kB), 2003.
- ↑ Peter W. Atkins, Julio de Paula: Kort lærebok i fysikalsk kjemi . 4. utgave. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31807-0 , pp. 512-513 .
- ^ Aircraft katastrofer , Gondrom-Verlag (ed.), 1996.