Häme (gruppe stoffer)
Häme (fra gamle greske αἷμα haima , blod) er komplekse forbindelser med et jernioner som sentralatom og et porfyrin molekyl som en ligand . Den mest kjente representanten er Fe-Protoporphyrin IX, også kalt "Häm b " eller bare "Häm". Som en prostetisk gruppe, kan heme bli funnet i en rekke proteingrupper , inkludert globiner og cytokromer .
Stoffgruppen er oppkalt etter hem b , som er en del av de røde blodcellene som et jernholdig fargestoff . Sammen med proteinet som finnes i erytrocyttene , globin , danner det hemoglobin , som spiller en sentral rolle i kroppens absorpsjon av oksygen. Heme annet enn heme b finnes i bakterier og planter.
Medlemmer
Haeme er jernholdige porfyrinkomplekser. Hem i smalere forstand skiller seg utgangspunktet i de funksjonelle gruppene som er bundet til porfyrinskjelettet.
| Etternavn | Grunnleggende struktur | R 3 | R 8 | R 18 | Hendelse |
|---|---|---|---|---|---|
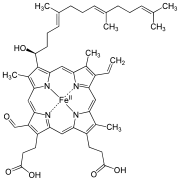
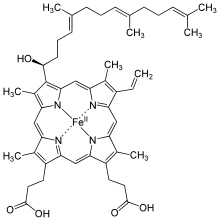
| Heme a |
|
Hydroksyfarnesyl | −CH = CH 2 | −CH = O | Cytokrom c oksidase |
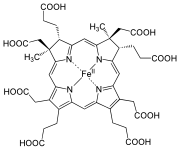
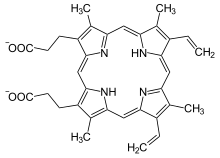
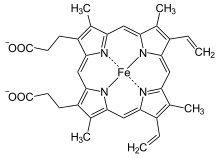
| Heme b | −CH = CH 2 | −CH = CH 2 | −CH 3 | Hemoglobin , myoglobin , katalase , suksinatdehydrogenase , cytokrom c reduktase , cyklooksygenase , cytokrom P450 | |
| Heme c | −CH (CH 3 ) SH | −CH (CH 3 ) SH | −CH 3 | Cytochrome c , cytochrome cd 1 | |
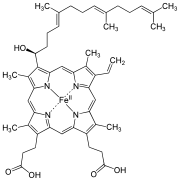
| Haem o | Hydroksyfarnesyl | −CH = CH 2 | −CH 3 | (Mellomprodukt) | |
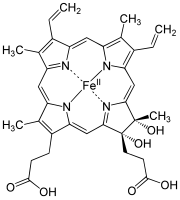
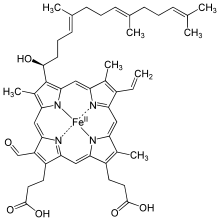
| Hamm s | –CHO | −CH = CH 2 | −CH 3 | Klorokruorin |
Mens hem c er kovalent bundet til tiolgruppene av cysteinrester i proteinet, er hem a og b på en ikke-kovalent måte. Ellers er heme b og c ikke forskjellige . Ved å erstatte visse aminosyrer med cystein i det bundne proteinet, kan b / c blandede former genereres som har forskjellige egenskaper.
Andre forbindelser som hører til hem er
- Häm d ,
- Häm d 1 , protesegruppen til cytokrom cd 1 , en bakteriell nitrittreduktase ( EC 1.7.2.1 )
- Heme P460 , den protetiske gruppen av hydroksylaminoksidoreduktase i Nitrosomonas europaea ( EC 1.7.3.4 )
- Sirohäm , den prostetiske gruppe av ferredoksin nitritt reduktase i planter, alger og cyanobakterier ( EC 1.7.7.1 ), så vel som bakterielle og plante sulfittreduktasene ( EC 1.8.1.2 og EC 1.8.7.1 )
fysiologi
Hems blir syntetisert i levende ting fra porfyrinene. Nedbrytningsveiene fører derimot via biliverdin og bilirubin til tetrapyrroler , gallepigmentene , som ikke kan nedbrytes ytterligere og som skilles ut.
biosyntese
I menneskekroppen starter biosyntese av alle porfyriner fra succinyl-CoA og aminosyren glycin . Det første og samtidig hastighetsbestemmende trinn katalyseres av enzymet δ-aminolevulinatsyntase og fører til δ-aminolevulinat . Planter , alger , bakterier (med unntak av alphaproteobacteria ) og arkebakterier kan også produsere δ-aminolevulinat fra glutaminsyre , som er referert til som C5- eller Beale-banen. Hvert to δ-aminolevulinatmolekyler kondenseres for å danne porfobilinogen, fire av disse molekylene omdannes deretter til hydroksymetylbilan . Ytterligere konvertering skjer trinnvis via uroporfyrinogen III og koproporfyrinogen III til protoporfyrinogen IX og protoporfyrin IX .
Heme b produseres ved inkorporering av toverdig jern i protoporfyrin IX ved hjelp av enzymet ferrogelatase .
Hos mennesker produseres hem a, en komponent av cytokrom c oksidase, fra hem b i to trinn . Mitokondrieprotoheme IX farnesyltransferase (COX10) produserer opprinnelig hem o , som hydroksyleres i 18-stillingen ved bruk av et annet enzym kalt COX15; Ferredoksin og den tilsvarende ferredoksinreduktase er nødvendige som medfaktorer . Det siste trinnet med konvertering til aldehydet katalyseres av et ukjent i det humane enzymet i Bacillus subtilis da genproduktet til CTAA - genet ble identifisert.
Nedbrytning og utskillelse
Jernionen kan oksidere og danne hematin , f.eks. B. i methemoglobin eller i methaemalbumin .
Nedbrytningsproduktene til hem kalles gallepigmenter . Den heme oksygenase omdanner den røde heme fortsatt i blod under riving av porfyrinringen og jern, og fjerning av karbonmonoksyd til grønt biliverdin til. Galle har en typisk gulaktig til grønnaktig farge, avhengig av skiftende innhold av biliverdin og oransjerød bilirubin ; sistnevnte er produsert av biliverdinreduktase ved reduksjon fra biliverdin. Gallepigmentene skilles hovedsakelig ut med urinen (som gul til oransje Urochrome Sterkobilin , Urobilinogen og Urobilin ) eller med avføring (som Coprochrome også Sterkobilin , Bilifuscin og Mesobilifuscin ).

Andre bilirubin-nedbrytingsprodukter som det fargeløse sterkobilinogenet (som omdannes til det brune dipyrroles mesobilifuchsin og bilifuchsin av tarmbakterier) bidrar også til normal avføringsfarge. Noen av nedbrytningsproduktene for bilirubin absorberes på nytt og skilles ut med urinen.
patologi
Hvert av enzymene som er involvert i biosyntese og nedbrytning kan ha en defekt, noe som fører til en typisk arvelig (sjelden) metabolsk forstyrrelse . Manglene som forekommer i porfyrinbiosyntese så vel som ferrogelatase-mangel er oppsummert under navnet porfyri . Defekter i hem en syntese, dvs. COX-10 og COX-15 mangler, derimot, fører til Leigh syndrom .
Se også
litteratur
- Ivano Bertini: Biologisk uorganisk kjemi: struktur og reaktivitet University Science Books, 2007, ISBN 978-1-891389-43-6 .
- PM Jordan: Høydepunkter i haems biosyntese. I: Curr. Opin. Struktur. Biol . Bind 4, 1994, s. 902-911. PMID 7712294 .
- H. Panek, MR O'Brian: En hel genomvisning av biosyntese av prokaryotisk hem. I: Mikrobiologi. Vol. 148, 2002, s. 2273-2282. PMID 12177321 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 5. utgave. Spectrum Academic Publishing House, Heidelberg 2003, ISBN 3-8274-1303-6 .
weblenker
- Heme and Porphyrin Metabolism (engelsk).
Individuelle bevis
- ^ A. Pallavicini, E. Negrisolo, R. Barbato et al.: Den primære strukturen til globin- og linkerkjeder fra klorocruorin av polychaete Sabella spallanzanii . I: J. Biol. Chem. Bind 276 , nr. 28. juli 2001, s. 26384-26390 , doi : 10.1074 / jbc.M006939200 , PMID 11294828 .
- ↑ M. Bugiani, V. Tiranti, L. Farina, G. Uziel, M. Zeviani: Nye mutasjoner i COX15 hos en langlevende Leigh syndrom pasient med cytokrom c oksidase mangel . I: J. Med. Genet. teip 42 , nei 5. mai 2005, s. e28 , doi : 10.1136 / jmg.2004.029926 , PMID 15863660 , PMC 1736058 (fri fulltekst).
- ↑ AL Sonenshein, James A. Hoch, Richard Losick : Bacillus subtilis og dens nærmeste slektninger. ASM Press, 2002, ISBN 1-55581-205-8 , s. 174.
- ↑ MH Barros, FG Nobrega, A. Tzagoloff: Mitokondrieferredoksin kreves for hem A-syntese i Saccharomyces cerevisiae . I: J. Biol. Chem. Bind 277 , nr. 12. mars 2002, s. 9997-10002 , doi : 10.1074 / jbc.M112025200 , PMID 11788607 .
- ^ F. Fontanesi, IC Soto, D. Horn, A. Barrientos: Montering av mitokondrie cytokrom c-oksidase, en komplisert og sterkt regulert cellulær prosess . I: Am. J. Physiol., Cell Physiol. teip 291 , nr. 6 , desember 2006, s. C1129-C1147 , doi : 10.1152 / ajpcell.00233.2006 , PMID 16760263 ( physiology.org ).