Glykogen
| Strukturell formel | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Generell | |||||||
| Etternavn | Glykogen | ||||||
| andre navn |
|
||||||
| CAS-nummer | 9005-79-2 | ||||||
| Monomer | glukose | ||||||
| Molekylformel for den gjentakende enheten | C 6 H 10 O 5 | ||||||
| Molarmasse av den gjentakende enheten | 162,14 g mol −1 | ||||||
| Type polymer | |||||||
| Kort beskrivelse |
luktfritt hvitt pulver |
||||||
| eiendommer | |||||||
| Fysisk tilstand |
fast |
||||||
| Smeltepunkt |
270–280 ° C ( spaltning ) |
||||||
| løselighet |
|
||||||
| sikkerhetsinstruksjoner | |||||||
| |||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . | |||||||
Den glykogen (også glykogen , dyr stivelse eller lever stivelse ) er et oligosakkarid eller et forgrenet polysakkarid ( polysakkarid ), som er bygget opp av glukose- monomerer. Som et karbohydrat lagret i celler (spesielt leveren ), tjener glykogen til kort til middels sikt lagring og tilførsel av energibæreren glukose i dyret, dvs. også menneskelig organisme. Også sopp og noen bakterier bruker denne formen for energilagring, mens vegetabilsk stivelse brukes som karbohydratforretninger. Prosessen med å bygge glykogen fra glukose er kjent som glykogensyntese , og den omvendte prosessen med glykogennedbrytning er kjent som glykogenolyse .
Spesielt i lever- og muskelceller, hvis det er et overforbruk av karbohydrater, bygges glykogen opp til massefraksjonen i leveren er 20%. Når det er et økt behov for energi, bruker muskelcellene sitt lagrede glykogen. Glykogenet som er lagret i leveren og nyrene brytes også ned til glukose igjen om nødvendig, med glukosen som blir gjort tilgjengelig for hele organismen via blodet.
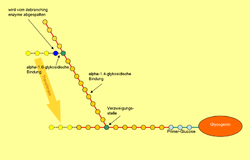
Struktur av glykogen
Glykogen består av et sentralt protein ( glykogenin ) som opptil 50000 glukosekomponenter vanligvis er a-1,4-glykosidisk bundet til. Hver 8. til 12. glukose / monosakkarid- byggestein, i tillegg til α-1,4-glykosidbinding, er det en ytterligere α-1,6-glykosidbinding, hvorved molekylet er forgrenet som et tre. Om nødvendig kan glykogen brytes ned til glukose på mange forskjellige punkter i et molekyl. Amylopektin , en komponent av vegetabilsk stivelse, har samme struktur som glykogen, men har en lavere forgreningsgrad fordi bare omtrent hvert 25. glukosemolekyl har en 1,6-glykosidisk kobling. Den molare massen av glykogen er ca 10 6 10 7 dalton .
Glykogen i menneskets metabolisme
Stivelse inntatt med mat brytes ned av enzymet alfa-amylase (nærmere bestemt ptyalin) i munnen og i tolvfingertarmen til de to disakkaridene maltose og isomaltose , som omdannes til glukose av ytterligere enzymer .
Musklene bruker bare glykogenforsyningen selv, leveren og nyrene fungerer som glykogenlagre og gjør den hovedsakelig tilgjengelig for andre celler. Dette er spesielt viktig i søvntilstand som en energiforsyning for celler i binyrene og erytrocytter , siden disse cellene er avhengige av glukose som energileverandør.
Den blodsukkernivå blir regulert ved hjelp av glykogendannelse og sammenbrudd av forskjellige hormoner : adrenalin og glukagon stimulerer glykogen sammenbrudd, insulin fremmer glykogen oppbygging . Insulin og glukagon er laget i deler av bukspyttkjertelen . Glykogeninnholdet i leveren varierer avhengig av menneskekroppens ernæringsstatus. Når du er sulten, er den mindre enn 1% av leverens vekt. Med god ernæringsstatus og en diett rik på karbohydrater, kan den vokse til opptil 20% av leverens vekt. Glykogenkapasiteten i nyrene er høyere enn leverens når beregnet per gram vev. Men siden leveren er det mye større organet, er leverens absolutte kapasitet høyere.
Glykogensyntese

Et såkalt kjerneprotein er nødvendig for syntesen av et glykogenmolekyl . Dette molekylet , kalt glykogenin , danner sentrum for hvert glykogenmolekyl. Selve det har noen molekyler av α-1,4-glykosidisk bundet glukose, som kreves som en primer av glykogensyntase - dette enzymet glir langs den eksisterende kjeden av glukosemolekyler som et lysbilde på glidelås og kan ikke selv bestemme et utgangspunkt.
Glukose forekommer sjelden i sin frie form i kroppens celler, men fosforyleres ved 6-karbonatomet slik at det ikke diffunderer ut gjennom cellemembranen og også lettere kan metaboliseres. For at glukose-6-fosfat kan dyrkes på eksisterende glykogen, må det først isomeriseres til glukose-1-fosfat av enzymet fosfoglukomutase og deretter aktiveres av uridintrifosfat - UDP-glukose og fritt pyrofosfat dannes , som brukes til å drive syntesen raskt blir videre brutt ned i 2 uorganiske ( i = uorganiske ) fosfatmolekyler . Denne aktiveringen katalyseres av enzymet UDP-glukose-pyrofosforylase og følger følgende ligning:
- Glukose-1-fosfat + UTP → UDP-glukose + PP i
- PP i + H 2 O → 2 P i
Den aktiverte glukosen festes deretter til primeren eller den eksisterende glykogenkjeden i den ikke-reduserende enden av glykogensyntasen :
- Glykogen (n glukose) + UDP-glukose → glykogen (n + 1 glukose) + UDP
Mens glykogensyntasen genererer en lang kjede, er en annen enzymet for den ansvarlige forgreningen: 1,4-α-glukanforgreningsenzymet ( forgreningsenzym ), kutter kjeden hver 7 til 12 glukosemolekyler og legger til kuttstykket "lateralt "(alfa-1,6-glykosid) på en kjede på minst 11 molekyler.
Uttømming av glykogen
Den lineære delen av glykogen brytes ned av enzymet glykogenfosforylase . Dette er pyridoksal fosfatavhengig . Det katalyserer bindingen av fritt fosfat til C1- atom av glukose . Den glykosidiske bindingen mellom glukosemolekylene er delt og glukose-1-fosfat dannes . Dette kan omdannes til glukose-6-fosfat ved en mutase . Glukose-6-fosfat er den normale formen for glukose i en celle. Hvis det ble produsert fri glukose, ville heksokinase IV , et enzym som også spiller en rolle i glykolyse , måtte produsere glukose-6-fosfat fra ATP ved hjelp av en fosforylgruppe . I tillegg forårsaker en økt konsentrasjon av glukose i cellen en reduksjon i konsentrasjonsgradienten mellom cytosolen og det ekstracellulære rommet , slik at glukosetransporten inn i cellen reduseres.
Glykogenfosforylase kan bare bryte ned glykogen opp til det fjerde glukosemolekylet før et forgreningspunkt. Det er her 4-α-glukanotransferase (en enzymatisk aktivitet av det forgrenende enzymet ) kommer til spill: Dette enzymet overfører tre av de fire glukosemolekylene foran forgreningspunktet til en annen kjede og legger dem lineært. Det gjenværende alfa-1,6-glykosidisk bundne glukosemolekylet er nå delt fra den andre enzymatiske aktiviteten til det forgrenende enzymet , med fri glukose som dannes. Når glykogen brytes ned, produseres omtrent 90% glukose-1-fosfat, siden i gjennomsnitt bare hvert tiende glukosemolekyl er ved et forgreningspunkt.
Når det gjelder mengde, har musklene den største mengden glykogen. Men det mangler enzymet glukose-6-fosfatase , som kan dele opp fosfatrester på det sjette karbonatomet av glukose. Dette skjer bare i leverceller , nyreceller og enterocytter . Dette betyr at leveren og nyrene kan bruke glykogenlagrene effektivt til å buffer lave blodsukkernivåer (f.eks. Om natten).
Hormonell regulering av opphopning og nedbrytning av glykogen
Det er to former for både glykogenfosforylase og glykogensyntase: en a- og en b-form . De to formene kan omdannes til hverandre ved fosforylering ved bruk av en kinase eller defosforylering ved bruk av en fosfatase. Siden a-formen har en mye høyere aktivitet enn b-formen, kan hastigheten til den respektive reaksjonen tilpasses kravene til stoffskiftet på denne måten.
Når det gjelder glykogenfosforylase, er den fosforylerte a-formen. Det er fosforyleres av en hormonelt kontrollert fosforylase-kinase og defosforyleres av en hormonalt kontrollert proteinfosfatase. Mens b-formen er tilpasset de lokale kravene i levercellen ved allosterisk kontroll, spesielt med adenosinmonofosfat (AMP), er a-formen alltid aktiv og gir store mengder glukose for perifert vev på kort tid. Omdannelsen av den inaktive til den aktive formen ved fosforylering er hormonstyrt. Aktivering av glykogenfosforylase av kinasen er en typisk stressreaksjon. Proteinfosfatasen aktiveres derimot når det er for mye glukose for å forhindre ytterligere frigjøring. Den viktigste aktiveringsmekanismen til glykogenfosforylase skjer via en fosforyleringskaskade som settes i gang av det andre messenger- sykliske adenosinmonofosfatet (cAMP). Binder seg til et hormon som får blodsukkeret til å stige, som f.eks B. glukagon eller adrenalin til de tilsvarende reseptorene i hepatocyttmembranen, stimulering av aktivering av et trimert G-protein stimulerer enzymet adenylylsyklase . Dette danner cAMP fra ATP . cAMP aktiverer allosterisk en spesifikk proteinkinase, proteinkinase A , som fosforylerer ovennevnte fosforylase-kinase, som deretter fosforylerer glykogenfosforylase og således omdanner den fra b til a-form.
Konsekvensen av denne kaskadeaktiveringen er en enorm forsterkning av det originale hormonsignalet (den nanomolære første messenger ) til en metabolsk reaksjon i millimolområdet. CAMP brytes ned igjen av en fosfodiesterase , slik at signalet forblir i en begrenset periode.
Prosessene i muskler er analoge, men det typiske sulthormonet glukagon fungerer ikke der. Insulin, på den annen side aktiverer protein fosfatase (PP1) og fosfodiesterase (PDE), og således har en antagonistisk virkning på stress og sult signaler. Glykogensyntese reguleres i motsatt retning, dvs. Det vil si at den inaktiveres av fosforylering og aktiveres av defosforylering, i hvilket tilfelle de samme kinaser og fosfataser er delvis involvert i denne reguleringen. A-formen er derfor defosforylerte, b-formen er fosforylerte. Sistnevnte er bare aktiv i nærvær av høye konsentrasjoner av glukose-6-fosfat , for eksempel når det er et stort overskudd av matglukose i leveren. Den hormonelle reguleringen skal forstås deretter, dvs. dvs. insulin stimulerer, adrenalin og glukagon hemmer glykogensyntase .
Se også
litteratur
- Berg, Tymoczko, Stryer: Biokjemi . 5. utgave. Spectrum Academic Publishing House, Heidelberg 2003, ISBN 3-8274-1303-6
- MM Adeva-Andany, M. González-Lucán, C. Donapetry-García, C. Fernández-Fernández, E. Ameneiros-Rodríguez: Glykogenmetabolisme hos mennesker. I: BBA klinisk. Volum 5, juni 2016, s. 85-100, doi: 10.1016 / j.bbacli.2016.02.001 , PMID 27051594 , PMC 4802397 (fri fulltekst).
weblenker
- Biochemistry Uni-Munich: Enzymatisk nedbrytning og oppbygging av glykogen ( Memento fra 16. juni 2010 i Internet Archive )
- Glykogenmetabolisme - lett forståelig sted om glykogenmetabolisme
Individuelle bevis
- ↑ Oppføring av GLYCOGEN i CosIng-databasen til EU-kommisjonen, åpnet 28. desember 2020.
- ↑ a b c d e datablad Glykogen, fra østers, Ultrapure, Thermo Scientific på AlfaAesar, åpnet 8. februar 2019 ( PDF )(JavaScript kreves) .
- ↑ a b David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data . CRC Press, 1995, ISBN 978-0-8493-0595-5 , pp. 296 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ WLF Armarego, Christina Chai, Christina Li Lin Chai: Rensing av laboratoriekjemikalier . Butterworth-Heinemann, 2003, ISBN 978-0-7506-7571-0 , pp. 604 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ a b Eckehard Buddecke: Grundriss der Biochemie , Walter de Gruyter Verlag, 6. utgave, 1980, s. 166, ISBN 3-11-008388-4 .
- ↑ a b A. Mitrakou: Nyre: dens innvirkning på glukosehomeostase og hormonell regulering. I: Diabetesforskning og klinisk praksis. Volum 93 Suppl 1, august 2011, s. S66-S72, doi: 10.1016 / S0168-8227 (11) 70016-X . PMID 21864754 . (Anmeldelse).
- ↑ Emil Lehnartz: Kjemien til muskelmaskinen. Fysiologisk forskning som en forutsetning for optimal utforming av menneskelig arbeid. Kosthold og ytelse. Springer-Verlag, 2013, ISBN 978-3-322-98646-7 , s. 14 ( begrenset forhåndsvisning i Google- boksøk ).
- ↑ HA kreft: Renal glukoneogenisis. I: Fremskritt innen enzymregulering. Volum 1, 1963, s. 385-400, PMID 14190368 .
- ↑ reaktom: glykogensyntese
- ↑ reaktom: glykogen nedbrytning (glykogenolyse)