Sitronsyresyklus
| Foreldre |
| Acetyl CoA katabolisme |
| Genontologi |
|---|
| QuickGO |
Den sitronsyresyklusen (også sitrat syklus , sitronsyresyklusen , trikarboksylsyre syklus , Krebs syklus eller Szent-Györgyi-Krebs syklus ) er en syklus av biokjemiske reaksjoner som spiller en viktig rolle i metabolismen (metabolisme) av aerobe celler i levende vesener og hovedsakelig for oksidativ nedbrytning av organiske stoffer Formålet med energiproduksjon og tilveiebringelse av mellomprodukter for biosyntese blir brukt. Den acetyl-CoA som er dannet som mellomprodukt når fett , sukker , alkohol og aminosyrer blir brutt ned brytes ned til karbondioksyd (CO 2 ) og vann (H 2 O). Mellomprodukter som kan brukes til å bygge opp organiske kroppskomponenter i det levende vesenet ( anabolisme ) dannes, så vel som direkte og indirekte energi i biokjemisk tilgjengelig form (som adenosintrifosfat ATP) blir gjort tilgjengelig.
Sitronsyresyklusen går i eukaryoter i matriksen til mitokondrier i prokaryoter i cytoplasmaet fra. Den omvendte reaksjonssekvensen finner sted i den såkalte reduktive sitronsyresyklusen , som noen bakterier bruker for å assimilere karbondioksid .
etymologi
Det er oppkalt etter det resulterende mellomproduktet citrat , anionen av sitronsyre . Reaksjonssekvensen er også kjent som Krebs-syklusen etter oppdageren Hans A. Krebs (1900–1981) . I tillegg til Fritz Albert Lipmann mottok Krebs Nobelprisen for medisin i 1953 for å avklare metabolske nedbrytingsveier.
oppdagelse
I 1937 var biokjemikeren Hans Adolf Krebs (i samarbeid med William Arthur Johnson) den første som postulerte sitratsyklusen som en vei for pyruvatoksidasjon . Krebs undersøkte påvirkningen av forskjellige organiske syrer på oksygenforbruk under pyruvatoksidasjon ved å bruke suspensjoner av knust duebrystmuskel. Denne flygemuskelen er spesielt godt egnet for undersøkelsen fordi den har høy oksidativ aktivitet på grunn av veldig høy pustehastighet. Krebs bekreftet observasjon av Albert Szent-Györgyi , blant andre , som C- 4 - dikarboksylsyrer fra dyrevev ( succinat , L - malat , fumarat og oksaloacetat ) stimulere oksygenforbruk på musklene. Krebs bekreftet denne observasjonen og fant at pyruvatoksidasjon også ga en slik effekt. Dette er eksemplifisert ved C, 6 trikarboksylsyrer citrat, cis - aconitat og isocitrat , så vel som C- 5 forbindelsen α-ketoglutarat stimulert. Andre organiske syrer viste ikke den nevnte effekten. Dette var imidlertid ekstremt viktig, fordi svært små mengder allerede førte til en oksidasjon av en mengde pyruvat.
Den andre viktige observasjonen av kreft var at malonat - nært beslektet med succinat og en konkurransedyktig hemmer av succinatdehydrogenase - hemmer den aerobe bruken av pyruvat i muskelsuspensjoner, uavhengig av hvilken av de aktive organiske syrene som tilsettes. Dette viser at succinat og succinatdehydrogenase må være essensielle komponenter i reaksjonen som er involvert i pyruvatoksidasjon.
Fra disse grunnleggende observasjonene og ytterligere bevis konkluderte Krebs med at de aktive tri- og dikarboksylsyrene som er oppført nedenfor, kan ordnes i en kjemisk logisk rekkefølge. Siden inkubasjonen av pyruvat og oksaloacetat med knust muskelvev forårsaket en akkumulering av sitrat i mediet, konkluderte Krebs med at denne sekvensen ikke fungerer lineært, men syklisk - slutten er knyttet til begynnelsen. Han tok bare feil med det siste manglende svaret. Følgende gjelder ikke: pyruvat + oksaloacetat → citrat + CO 2 . Dermed foreslo Krebs at banen han kalte "sitronsyresyklusen" var hovedveien for karbohydratoksidasjon i muskler.
Roll i stoffskiftet
Nedbrytningsproduktene av forskjellige næringsstoffer, som brytes ned i stoffskiftet, strømmer inn i sitronsyresyklusen. Acetyl-CoA, eddiksyre bundet til koenzym A , kan beskrives som det sentrale nedbrytningsproduktet i forskjellige næringsklasser. Acetyl-CoA-molekyler dannes direkte fra fettsyrer, for eksempel gjennom β-oksidasjon . I glykolyse brytes karbohydrater ned i pyruvat (pyruvinsyre), som deretter dekarboksyleres til acetat av pyruvatdehydrogenasekomplekset, og acetylresten er bundet til koenzym A. Til slutt hydrolyseres også proteiner til aminosyrer som etter deaminering kan omdannes til deres tilsvarende α- keto-syrer , for eksempel α-ketoglutarat fra L - glutaminsyre eller oksaloacetat fra L- aspartat. Disse ketosyrene er ofte mellomprodukter i sitronsyresyklusen og flyter direkte inn i den.
Når acetyl-CoA brytes ned via sitronsyresyklusen, oppnås energi i form av GTP , samt reduksjonsmidler ( NADH , FADH 2 ). Under disse prosessene brytes acetylresten av acetyl-CoA gradvis ned i karbondioksid og vann. Elektronene oppnådd i sitronsyresyklusen og bundet til koenzymer (NAD + og FAD) blir matet inn i luftveiskjeden og overført til den terminale elektronakseptor oksygen (O 2 ). Den frigjorte energien brukes til å danne ATP.
Sitronsyresyklusen fungerer også som leverandør av forskjellige forløpsmolekyler for anabolisme . For eksempel kan α-ketosyrer fjernes fra syklusen for å danne aminosyrer eller andre stoffer. Oksaloacetat kan også mates tilbake til glukoneogenese.
fremgangsmåte
I eukaryoter finner sitronsyresyklusen sted i mitokondriene , i prokaryoter i cytoplasmaet eller om nødvendig i mitokondrieekvivalenter. Det er en amfibolisk metabolsk prosess, dvs. det vil si at den kan tjene både anabole og katabolske veier. Sitronsyresyklusen er en del av oksidativ nedbrytingsprosess og går foran luftveiskjeden i aerobe organismer.
Sitronsyresyklusen kan sees på som det tredje av fire trinn i karbohydratkatabolisme. Det foregår etter glykolyse og oksidativ dekarboksylering av pyruvat til acetyl-CoA, men før sluttoksidasjon i luftveiskjeden .
Følgende nettobalanse kan utarbeides for sitronsyresyklusen:
Acetyl-CoA, eddiksyre bundet til koenzym A, også kjent som "aktivert" eddiksyre, brytes ned til karbondioksid (CO 2 ), hydrogen (dette er bundet til hydrogen / elektronbærerne NADH og FADH 2 ) og koenzym A ved sitronsyresyklusen . Her er guanosindifosfat (BNP) fosforylert til guanosintrifosfat (GTP).
I respirasjonskjeden overføres elektronene som er bundet til NADH og FADH 2 (8 reduksjonsekvivalenter per acetyl-CoA ) til oksygen som terminal elektronakseptor. Energien som frigjøres under migrering av elektroner gjennom respirasjonskjeden fra proteinkompleks til proteinkompleks og til slutt til oksygen, gjøres brukbar ved å transportere protoner fra det indre av mitokondrionen (matriksen) inn i intermembranrommet og dermed skape en potensiell forskjell, en kjemiosmotisk potensial ΔP, gjennom protongradienten dannes. Drevet av dette potensialet fosforylerer ATP-syntasen til slutt ADP til ATP. Anaerobe organismer kan ikke la sitronsyresyklusen løpe helt; den blir avbrutt i dem. Dette er fordi de mangler α-ketoglutarat dehydrogenase komplekset for å konvertere α-ketoglutarat til succinyl-CoA eller dette er undertrykt.
Når 2 pyruvat brytes ned via acetyl-CoA og sitronsyresyklusen samt oksydasjonen av hydrogen splittes (20 reduksjonsekvivalenter) i luftveiskjeden, gir 25 ATP betydelig mer energi enn i glykolyse av glukose opp til 2 pyruvat, der bare 2 ATP dannes.
Delvise reaksjoner

Reaksjonssekvensen er skissert i figuren ovenfor. Utgangspunktet for sitronsyresyklusen er en tilsetning av acetyl-CoA til oksaloacetat katalysert av sitratsyntase og påfølgende hydrolyse for å danne sitrat ( 1 ). Om nødvendig trekkes citrat ut av syklusen og mates inn i kolesterolbiosyntese eller fettsyresyntese . Disse prosessene som foregår i cytosolen krever acetyl-CoA, som - i motsetning til sitrat - ikke klarer å passere gjennom mitokondriell membran, men kan syntetiseres fra citrat ( citratskyttel ). Acetyl-CoA for sitronsyresyklusen kan komme fra forskjellige kilder, for eksempel fra β-oksidasjon av fettsyrer.
Den påfølgende isomerisering 2a-b av sitratet ved hjelp av aconitase gir isocitrat . Viktigheten av dette trinnet ligger i omdannelsen av en vanskelig å oksidere tertiær alkohol (citrat) til en lett å oksidere sekundær alkohol (isocitrat).
Isocitrat oksyderes og dekarboksyleres av isocitratdehydrogenase i trinn 3a-b . I tillegg til den første reduksjonsekvivalenten NADH, dannes α-ketoglutarat (annet navn: 2-oksoglutarat), et mellomprodukt som også er viktig for aminosyremetabolismen ( kataplerotisk metabolsk vei: reduktiv transaminering til L - glutamat ⇒ aminosyrebiosyntese; anaplerotisk metabolsk vei: deaminering av glutamat ⇒).
Den følgende reaksjon 4 , som avgir et andre molekyl av CO2 i tillegg til NADH via en oksidativ dekarboksylering , katalyseres av a-ketoglutarat-dehydrogenase-komplekset , som er funksjonelt og strukturelt lik pyruvatdehydrogenase-komplekset. Eksperimenter med isotop-merkede substrater viser at CO 2 som frigjøres i prosessen ikke kan tildeles karbonet i karbonylgruppen i acetyl-CoAs, men, som det fra trinn 3b, kommer fra oksaloacetatet.
Den resulterende succinyl-CoA er et annet nøkkelprodukt av sitronsyresyklusen ( kataplerotisk metabolsk vei: porfyrinbiosyntese ; anaplerotiske metabolske veier: nedbrytning av aminosyrene L - valin , L - isoleucin og L - metionin , oksidasjon av oddetalls fettsyrer , se også fettsyreoksidasjon ).
Midlene for suksinyl-CoA-syntetase- katalysert hydrolyse av 5 av høyenergi- tioestersuccinyl -CoA for å suksinere er den eneste tilførte energiekvivalenten av sitronsyresyklusen i form av GTP. En nukleosiddifosfatkinase kan konvertere GTP til ATP.
I trinn 6 er suksinat substratet til suksinatdehydrogenase , som ved oksidasjon gir en tredje reduksjonsekvivalent i form av FADH 2 så vel som fumarat , som også skjer gjennom en anaplerotisk metabolsk vei gjennom nedbrytningen av aminosyrene L - asparaginsyre , L - fenylalanin og L - tyrosin i sitronsyresyklusen mates inn.
Fumarase katalyserer stereospesifikk tilsetning av vann til dobbeltbindingen til fumaratet i trinn 7 , slik at L - malat dannes. I trinn 8 omdanner malatdehydrogenase L-malat til substratet til det første trinnet, oksaloacetat, med utvinning av NADH. Dette stenger syklusen. Ytterligere metabolske veier er knyttet til oksaloacetatet (kataplerotisk: reduktiv transaminering til aspartat ⇒ aminosyrebiosyntese; anaplerotisk: deaminering av aspartat ⇒ aminosyreoksidasjon).
| Underlag | Reaktanter / koenzymer |
enzym | Reaksjonstype | Inhibitorer | Aktivatorer | Produkter / koenzymer |
|
|---|---|---|---|---|---|---|---|
| 1 | Oksaloacetat | Acetyl-CoA, vann | Sitratsyntase | kondensasjon | Citrat, NADH, succinyl-CoA, ATP | Sitrat | |
| 2a | Sitrat | - | Aconitase | Dehydrering | cis aconitate, vann | ||
| 2 B | cis aconitate | vann | Hydrering | Isocitrate | |||
| 3a | Isocitrate | NAD + | Isocitrate dehydrogenase | oksidasjon | NADH, ATP | Ca 2+ , ADP | Oksalsuccinat, NADH |
| 3b | Oksalsuccinat | H + | Dekarboksylering | α-ketoglutarat, CO 2 | |||
| 4. plass | α-ketoglutarat | NAD + , CoA-SH | α-ketoglutarat dehydrogenase kompleks | Oksidativ dekarboksylering | NADH, succinyl-CoA | Ca 2+ | Succinyl-CoA, NADH, CO 2 |
| 5 | Succinyl-CoA | BNP, fosfat | Succinyl-CoA syntetase | Fosfatoverføring | Succinat, GTP, CoA-SH | ||
| Sjette | Succinat | FAD | Succinatdehydrogenase | oksidasjon | Malonate | Mg 2+ | Fumarate, FADH 2 |
| 7. | Fumarat | vann | Fumarase | Hydrering | L-malat | ||
| 8. plass | L- Malat | NAD + | Malatdehydrogenase | oksidasjon | Oxaloacetate, NADH | ||
| Ikke en del av sitronsyresyklusen: | |||||||
| EN. | Pyruvat | NAD + , CoA-SH | Pyruvat dehydrogenase kompleks | Oksidativ dekarboksylering | NADH, acetyl-CoA | Ca 2+ | Acetyl-CoA |
| B. | Pyruvat | ATP, H + , CO 2 | Pyruvat karboksylase | Karboksylering | Acetyl-CoA | Oksaloacetat, ADP, fosfat | |
regulering
Sitronsyresyklusen som den sentrale ledd i aerob metabolisme er underlagt sterk regulatorisk påvirkning. I tillegg til produktinhibering ("negativ tilbakemelding", konkurransedyktig inhibering ) og inhibering av andre mellomprodukter , spesielt NAD + / NADH, ADP / ATP og Ca 2+ spiller en viktig rolle som effektorer . Spesielt er deltrinnene av større eksergonier underlagt regulatorisk kontroll : sitratsyntese 1 (ΔG o = -38 kJ / mol), ketoglutaratdannelse 3 (ΔG o = -7 kJ / mol) og dannelsen av succinyl-CoA 4 (ΔG o = -37 kJ / mol).
Ovennevnte eksergoniske delvise trinn inhiberes av høye NADH nivåer. For eksempel, hvis respirasjonskjeden stopper på grunn av oksygenmangel, hvis mindre NADH forbrukes og konsentrasjonen øker, kan sitronsyresyklusen også komme til å stå stille.
Hvis det derimot er behov for lite energi (f.eks. Muskler i hvile), øker ATP-konsentrasjonen når ADP-konsentrasjonen synker. Mens ADP er en allosterisk aktivator av isocitratdehydrogenase, hemmer ATP effekten: syklusen reduseres.
Ytterligere effektorer av sitronsyresyklusen finner du i tabellen.
Inhibitorer
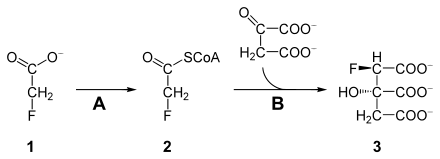
Fluoroacetat er giftig da det kan blokkere sitronsyresyklusen. Fluoracetat ( 1 ) metaboliseres først av en acetyl-CoA-syntetase ( A , EC 6.2.1.1 ) til fluoracetyl-CoA ( 2 ). Fluoroacetyl-CoA, som den analoge acetyl-CoA, katalyseres av sitratsyntase ( B ) og kondenseres med oksaloacetat. Produktet, ( 2R , 3S ) -fluorocitrate ( 3 ), kan ikke behandles av aconitase og blokkerer det, hvorved sitronsyresyklusen brytes av på dette punktet. Cellen er avskåret fra energiforsyningen og dør (dødelig syntese).
Sitronsyresyklus hos mennesker
Også hos mennesker brytes sukker ned i CO 2 og H 2 O via glykolyse , oksidativ dekarboksylering av pyruvat og sitronsyresyklusen med dannelsen av energibærerne NADH + H + , FADH 2 , GTP og ATP . Energien til dannede energibærere (unntatt ATP) overføres via luftveiskjeden til ADP , som deretter kan bygges opp til ytterligere ATP ved hjelp av en fosfatrest . Her frigjør NADH + H + omtrent energien som kan brukes til å danne 3 ATP, FADH 2 frigjør omtrent den energien som kreves for å danne 2 ATP, GTP gir energi til dannelsen av et ATP-molekyl ADP og fosfat.
Med økt etterspørsel etter ytelse på grunn av oksygenmangel uten hvilken luftveiskjeden ikke kan løpe, blir en økende prosentandel av pyruvat oppnådd i glykolysen ikke lenger aerobt omdannet til acetyl-CoA, men anaerobt med forbruk av en NADH + H + per pyruvatmolekyl til L - Laktat , anionen av melkesyre. Det virker uforståelig at NADH + H + forbrukes, siden kroppen faktisk trenger energi i denne situasjonen. Ved nærmere inspeksjon er dette trinnet imidlertid nødvendig og energigivende, fordi NADH + H + uansett ikke kan omdannes til ATP av luftveiskjeden (oksygenmangel). Imidlertid kan 2 ATP, som kan brukes direkte av musklene uten åndedrettskjede, dannes ved glykolyse ved å bryte ned 1 molekyl glukose i 2 molekyler pyruvat. Dette skaper også 2 molekyler av NADH + H + , slik at det til slutt er en energiforsterkning på 2 ATP. For at pyruvatdannelsen skal kunne gå jevnt, må det imidlertid sikres at pyruvat fjernes fra systemet igjen og igjen (slik at konsentrasjonen ikke blir for høy), noe som normalt vil skje via dekarboksylering og sitronsyresyklusen. Siden dette ikke er mulig på grunn av oksygenmangel, brytes pyruvat som nevnt ned til laktat. Så glykolysen kan fortsette og minst 2 ATP dannes:
| Metabolsk prosess | Energibalanse |
|---|---|
| Konvertering av 2 pyruvat til 2 laktater | −6 ATP (2 NADH + H + ) |
| Nedbrytning av 1 glukose til 2 pyruvat | +8 ATP (2 NADH + H + og 2 ATP) |
| Balanse per glukosemolekyl | +2 ATP |
Melkesyre må brytes ned over en viss konsentrasjon fordi den har en ytelsesreduserende effekt ved å senke pH-verdien . Musklene frigjør laktat til blodet, som deretter transporteres til leveren. Laktat blir deretter omdannet til glukose i leveren gjennom glukoneogenese . Her kreves mer energi enn det som ble absorbert av muskelen. Prosessen med å omdanne pyruvat til laktat er derfor bare gunstig på kort sikt når det gjelder energi sett regionalt på muskelen. For organismen som helhet betyr det imidlertid langsiktige energitap (se også Cori-syklus ). Dette viser at kroppen i ekstreme situasjoner - her høye ytelseskrav - kan være forberedt på å miste energi på lang sikt for å oppnå den nødvendige ytelsen på kort sikt.
Glukosen som dannes i leveren, kan deretter absorberes på nytt av muskelcellene gjennom blodet. Denne syklusen er også kjent som Cori-syklusen . Evnen til å opprettholde høy ytelse til tross for høye laktatnivåer blir i fysiologisk basert treningsteori referert til som laktattoleranse .
→ se også: glykolyse , gjæring av melkesyre
varianter
Modifiserte metabolske veier for sitronsyresyklus, der et delvis trinn mangler, er normen i bakterier (13 av 17 undersøkt). Det manglende trinnet kan eller ikke erstattes av andre reaksjonstrinn. Faktisk er det bare kjent at to typer bakterier har ketoglutarat dehydrogenase (KDH) aktivitet: Bacillus japonicum og Escherichia coli . Bakterien Escherichia coli kjører hele sitronsyresyklusen som beskrevet under aerobe forhold. Under anaerobe forhold er den i stand til å deaktivere KDH. De metabolske banene, som tidligere dannet en sirkel, er nå knyttet som et tre. M. tuberculosis kan derimot bytte mellom to forskjellige sitronsyresykluser, som begge er forskjellige fra den eukaryote banen.
Archaea , men også noen bakterier, for eksempel Helicobacter pylori , som vokser under mikroaerofile forhold, katalyserer omdannelsen av α-ketoglutarat til succinyl-CoA ved hjelp av et oksidasjonsfølsomt 2-ketoglutarat: ferredoksinoksidoreduktase (OGOR, EC 1.2.7.3 ) . I motsetning til OGDC inneholder denne jern- svovelklynger ; flavin og liponsyreamid mangler. I stedet for NADH brukes ferredoksin som en reduksjonsekvivalent. Også Mycobacterium tuberculosis inneholder en CoA-avhengig enzym som, imidlertid, er stabil selv under aerobe betingelser.
I forskjellige mykobakterier (inkludert Mycobacterium tuberculosis ), er E1-subenheten av ketoglutarat dehydrogenase erstattet med en ketoglutarat dekarboksylase, som uavhengig av koenzym A, frembringer til å begynne succinat semialdehyd, som omdannes fra en NADP + -avhengige succinat semialdehyd til suksinat-dehydrogenase bli dehydrert .
reversering
I noen bakterier opereres sitronsyresyklusen i omvendt rekkefølge for karbondioksidassimilering ( reduktiv sitronsyresyklus ). Her, med forbruket av ATP og bruken av reduksjonsmidler, blir tre energisk ugunstige trinn i den oksidative sitronsyresyklusen forbigått: Sitratsyntasen erstattes av en ATP-sitratlyase, a-ketoglutarat-dehydrogenase med en α-ketoglutarat-syntase og suksinat-Dehydrogenase av en fumaratreduktase.
I 2018 oppdaget forskergrupper i to termofile, svovelreduserende, anaerobe bakterier ( Desulfurella acetivorans og Thermosulfidibacter takaii ) at de bruker en omvendt rekkefølge av sitronsyresyklusen, men koder ikke et gen for den ATP-avhengige citratlyasen som kreves i den reduktive sitronsyresyklusen. Denne metabolske veien ble kalt revers eller revers oksidativ sitronsyresyklus (“roTCA”) for å skille den reduktive sitronsyresyklusen (“rTCA”). Bakteriene lykkes med å reversere dannelsen av sitrat ved effektivt å metabolisere etterfølgermetabolittene malat og acetyl-CoA; som et resultat er konsentrasjonen av oksaloacetat ekstremt lav, slik at likevekten av sitratspalting forskyves til siden av oksaloacetat. Ved å lagre ett ATP-molekyl kreves bare ett ATP-molekyl i roTCA for å fiksere to CO 2 -molekyler . Dette tilsvarer energibehovene til den reduktive acetyl-CoA-banen .
Se også
- Cellular respirasjon
- Glykoksylatsyklus
- Biokjemiske sykluser
- Glukosemetabolisme
- Reduktiv sitronsyresyklus
litteratur
- Reginald Garrett, Charles M. Grisham: Biokjemi . Internasjonal studentutgave. 4. utgave. Cengage Learning Service, Australia 2009, ISBN 0-495-11464-2 , s. 563ff.
- Geoffrey Zubay: biokjemi. 4. utgave. Mcgraw-Hill International, London 1999, ISBN 3-89028-701-8 .
- Donald Voet, Judith G. Voet: Biokjemi . Wiley-VCH, Weinheim 1994, ISBN 3-527-29249-7 .
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 6. utgave. Spectrum, Heidelberg 2007, ISBN 3-8274-1800-3 .
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (overs.): Biokjemi. 4. utgave. Pearson Studium, München 2008, ISBN 3-8273-7312-3 .
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (første): Lehninger Biochemie. 4. utgave. Springer, Berlin 2009, ISBN 3-540-68637-1 .
weblenker
- Hva er målet med sitratsyklusen? ( Memento fra 2. mai 2016 i Internet Archive )
Individuelle bevis
- ^ Nobelpris i medisin 1953 .
- ^ HA Krebs og WA Johnson: Sitronsyreens rolle i mellomliggende metabolisme i dyrevev. I: Enzymologia. Volum 4, 1937, s. 148-156 (Opptrykk: HA Krebs, WA Johnson: Rollen av sitronsyre i mellommetabolisme i dyrevev . I: FEBS brev . 117 Suppl, 25. august 1980, s. K1-10 , PMID 6998725 . )
- ^ Albert L. Lehninger, David L. Nelson, Michael M. Cox: Lehninger Biochemie. 3. Utgave. Springer, Berlin 2009, ISBN 3-540-41813-X , s. 626.
- ↑ Hans Günther Schlegel, Georg Fuchs (red.): Generell mikrobiologi. 8. utgave. Thieme, Stuttgart 2006, ISBN 3-13-444608-1 , s. 326.
- ^ Reginald Garrett, Charles M. Grisham: Biokjemi. Internasjonal studentutgave. 4. utgave. Cengage Learning Services, Australia 2009, ISBN 0-495-11464-2 , s. 573.
- ↑ Marc W. van der Kamp, John D. McGeagh, Adrian J. Mulholland: “Lethal Synthesis” av Fluorocitrate av citratsyntaseaktivitet forklart gjennom QM / MM modellering . I: Angewandte Chemie International Edition . teip 50 , nei. 44 , 24. oktober 2011, ISSN 1521-3773 , s. 10349-10351 , doi : 10.1002 / anie.201103260 .
- ↑ SJ Cordwell: Mikrobielle genomer og "manglende" enzymer: omdefinere biokjemiske veier . I: Archives of Microbiology . teip 172 , nr. 5 , 1. oktober 1999, s. 269-279 , doi : 10.1007 / s002030050780 , PMID 10550468 .
- ↑ Mai X, MW Adams: Karakterisering av en fjerde type 2-keto syre-oksiderende enzym fra en hypertermofil arkeon: 2-ketoglutarat ferredoksinoksidoreduktase fra Thermococcus litoralis . I: Journal of Bacteriology . teip 178 , nr. 20. oktober 1996, s. 5890-5896 , PMID 8830683 , PMC 178443 (fri fulltekst).
- ↑ SM Pitson, GL Mendz, S. Srinivasan, SL Hazell: trikarboksylsyre cyklusen av Helicobacter pylori . I: European Journal of Biochemistry / FEBS . teip 260 , nei 1 , februar 1999, s. 258-267 , PMID 10091606 .
- ↑ Anthony D. Baughn, Scott J. Garforth, Catherine Vilchèze, William R. Jacobs: En anaerob-type alfaketoglutarat ferredoksin oksidoreduktase fullfører den oksidative trikarboksylsyre syklus av Mycobacterium tuberculosis . I: PLoS patogener . teip 5 , nr. 11. november 2009, s. e1000662 , doi : 10.1371 / journal.ppat.1000662 , PMID 19936047 .
- ↑ Jing Tian, Ruslana Bryk, Manabu Itoh, Makoto Suematsu, Carl Nathan: Variant trikarboksylsyresyklus i Mycobacterium tuberculosis: identifikasjon av alfa-ketoglutarat dekarboksylase . I: Proceedings of the National Academy of Sciences . teip 102 , nr. 30 , 26. juli 2005, s. 10670-10675 , doi : 10.1073 / pnas.0501605102 , PMID 16027371 .
- ↑ Achim Mall et al. Reversibilitet av citratsyntaseaktivitet tillater autotrof vekst av en termofil bakterie . I: Science (New York, NY) . teip 359 , nr. 6375 , 2. februar 2018, s. 563-567 , doi : 10.1126 / science.aao2410 , PMID 29420287 .
- ↑ Takuro Nunoura et al.: En opprinnelige og reversibel TCA syklus i en fakultativt chemolithoautotrophic termofile . I: Science (New York, NY) . teip 359 , nr. 6375 , 2. februar 2018, s. 559-563 , doi : 10.1126 / science.aao3407 , PMID 29420286 .
- ↑ Stephen W. Ragsdale: Stealth reaksjoner som driver karbonfiksering . I: Science (New York, NY) . teip 359 , nr. 6375 , 2. februar 2018, s. 517-518 , doi : 10.1126 / science.aar6329 , PMID 29420277 .