Koenzym A
| Strukturell formel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Generell | ||||||||||||||||||||||
| Etternavn | Koenzym A | |||||||||||||||||||||
| andre navn | ||||||||||||||||||||||
| Molekylær formel | C 21 H 36 N 7 O 16 P 3 S | |||||||||||||||||||||
| Kort beskrivelse |
beige solid |
|||||||||||||||||||||
| Eksterne identifikatorer / databaser | ||||||||||||||||||||||
| ||||||||||||||||||||||
| eiendommer | ||||||||||||||||||||||
| Molarmasse | 767,53 g mol −1 | |||||||||||||||||||||
| Fysisk tilstand |
fast |
|||||||||||||||||||||
| sikkerhetsinstruksjoner | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er oppgitt, gjelder opplysningene standardbetingelser . | ||||||||||||||||||||||
Koenzym A (også koenzym A , CoA eller CoASH for kort ) er et koenzym som brukes for å “aktivere” alkansyrer og deres derivater og er direkte involvert i lipidmetabolisme og indirekte i sukker og proteinmetabolisme .
Det er acylgruppen i acyl- transferaser (EC 2.3.NN) og CoA-transferaser (EC 2.8.3.N).
Isolering ble først oppnådd i 1951 av den tyske biokjemikeren og senere Nobelprisvinneren Feodor Lynen i form av acetyl-koenzym A ("aktivert eddiksyre") fra gjærceller. Strukturen ble belyst to år senere av James Baddiley fra British Lister Institute of Preventive Medicine og Fritz Albert Lipmann fra Harvard University .
struktur
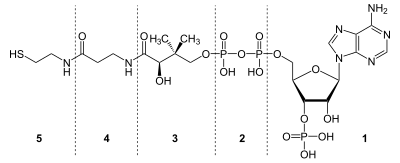
Koenzym A-molekylet består av flere komponenter: disse inkluderer et nukleotid ( adenosindifosfat , ADP), et vitamin ( pantotensyre , vitamin B5) og en aminosyre ( cystein ), som er bundet sammen under syntese i kroppen og deretter lett modifiseres.
I detalj består det ferdige koenzymet A av cysteamin (også tioetanolamin) ( 5 ), β-alanin ( 4 ), pantoinsyre (2,4-dihydroksy-3,3-dimetylsmørsyre) ( 3 ), difosfat ( 2 ) og 3'- fosforylerte adenosin ( 1 ).
β-alanin ( 4 ) og pantoinsyre ( 3 ) sammen er også kjent som pantotensyre. Hvis man vurderer dette sammen med cysteamin ( 5 ), snakker man om pantethein ( 5 + 4 + 3 ). 3'-fosfo-adenosin kan forstås sammen med difosfatet som 3'-fosfo-adenosindifosfat. Følgelig består koenzym A av pantethein og 3'-fosfo-ADP.
biosyntese
Syntesen i dyreorganismen starter fra den essensielle pantotensyren, som en fosforylgruppe først er bundet til ved hjelp av pantotenatkinase, og deretter blir en cystein bundet ved hjelp av fosfopantotenatcysteinligase . Etter at cystein er dekarboksylert til cysteamin av fosfopantotoylcystein- dekarboksylase, er et adenosinmonofosfat (AMP) festet til fosfatgruppen og til slutt fosforyleres adenosinet i 3'-OH-gruppen. De to siste trinnene er katalysert av forskjellige domener av koenzym A-syntase .
For detaljerte prosesser under syntesen, inkludert strukturformler, se avsnittet om nettlenker.
funksjon
Koenzym A er i stand til å inngå høyenergiforbindelser via SH-gruppen (tiolgruppen) i cysteamindelen. Det går inn i disse forbindelsene med karboksygruppene (-COOH) av alkansyre og fettsyrer med dannelsen av såkalte tioesterbindinger .
Koenzym A er direkte involvert - som acyl-CoA - i metabolismen av fett og indirekte - som acetyl-CoA - i metabolismen av karbohydrater og proteiner.
Det sies at koenzym A aktiverer bindingspartnerne gjennom dannelsen av høyenergi-tioesterbindingen, fordi først da er de i stand til å inngå visse kjemiske reaksjoner i kroppen med tilstrekkelig hastighet. Uten koenzym A ville bindingspartnerne være betydelig mindre reaktive.
Acetyl-CoA
Acetyl-koenzym A (acetyl-CoA for kort) er en "aktivert" eddiksyrerest (CH 3 CO-). Dette er bundet til SH-gruppen til cysteamindelen av koenzym A.
Acetyl-CoA produseres i organismen under flere metabolske prosesser:
- På den ene siden er den dannet av den såkalte oksidative dekarboksyleringen av pyruvat , som igjen er sluttproduktet av glykolyse , men også av nedbrytningen av aminosyrer (som L-alanin ). Den oksidative dekarboksyleringen av pyruvat finner sted i mitokondrionen . Der det pyruvat-dehydrogenase enzymkomplekset katalyserer avspaltning av karbondioksyd CO 2 (karboksygruppen avspaltes, derav "dekarboksylering") og samtidig kobling av den gjenværende acetylresten med SH-gruppe av koenzym A. opprinnelig er det sentrale karbonatomet i pyruvat oksidert (derav "oksidativt").
- I tillegg dannes acetyl-CoA når fettsyrer brytes ned som en del av β-oksidasjon . Her skilles to karbonatomer i form av acetyl-CoA fra fettsyren etter hverandre. Så oppstå z. B. i nedbrytningen av palmitinsyre med 16 karbonatomer i sammenheng med β-oksidasjon åtte molekyler acetyl-CoA. Denne prosessen finner også sted i mitokondriell matrise.
- I assimilerende metabolisme av mange anaerober forekommer det også som et produkt av den reduktive acetyl-CoA-banen og den reduktive sitronsyresyklusen .
Den dannede acetyl-CoA kan brytes fullstendig ned i mitokondrionen ved sitronsyresyklus og respirasjonskjede til CO 2 og H 2 O, eller den kan brukes igjen til syntese av høyenergiforbindelser som triglyserider , ketonlegemer eller kolesterol . Noen av disse anabole prosessene finner sted i cytosolen (f.eks. Fettsyresyntese ), men acetyl-CoA kan ikke lett forlate mitokondrionen og transportveiene for lengre kjedede karboksylsyrer (se nedenfor) er også blokkert. Det er derfor et spesielt transportsystem, den såkalte citrate shuttle, for transport av acetyl-CoA fra mitokondrionen inn i cytosolen .
Acyl-CoA
Acyl-Coenzyme A (kort Acyl-CoA) er navnet på en "aktivert" fettsyre . Analogt med acetyl-CoA, i stedet for en acetylrest, er resten av en fettsyre - en acylrest - bundet til SH-gruppen.
Acyl-CoA er involvert i nedbrytningen av fettsyrer ( β-oksidasjon ) ved å binde fettsyrene. I syntesen av fettsyrer i kroppen tar en strukturelt relatert protesegruppe av fettsyresyntase - kalt acylbærerprotein (forkortet ACP) - rollen som koenzym A.
Acyl-CoA dannes av enzymet acyl-CoA syntetase (også kjent som tiokinase), som finner sted i cytosolen . For det første reagerer den frie fettsyren på karboksygruppen (-COOH) med ATP , og splitter av difosfat . Det såkalte acyladenylatet dannes. Energien til denne bindingen blir deretter brukt til å forestre koenzym A med fettsyren, og derved splitte av AMP . Begge trinnene er katalysert av tiokinase.
For å bryte ned fettsyrer, må acyl-CoA transporteres inn i mitokondriene. Akkurat som acetyl-CoA, kan acyl-CoA ikke krysse den indre mitokondriale membranen på egenhånd og overføres til L- karnitin for transport . Fra denne transportformen kalt acylkarnitin, blir acylresten i mitokondriene overført tilbake til et koenzym A, slik at acyl CoA igjen er til stede.
Fettalkoholer dannes av acyl-CoA, som for eksempel brukes til syntese av bivoks av honningbier .
Propionyl-CoA
Propionyl-CoA produseres ved flere anledninger i metabolismen. Den mest kjente måten er nedbrytning ( β-oksidasjon ) av oddetalls fettsyrer . Etter gjentatt spaltning av en enhet med to karbonatomer i form av acetyl-CoA, forblir en enhet med tre karbonatomer i form av propionyl-CoA på slutten. Propionyl-CoA dannes også når fettsyrer med metylgrener brytes ned. Dette gjelder også nedbrytningen av den forgrenede sidekjeden av kolesterol , da den foregår under biosyntese av gallsyrer - propionyl-CoA blir også delt i prosessen. En veldig viktig kilde til propionyl-CoA er nedbrytningen av aminosyrene isoleucin , valin og metionin, så vel som den viktigste nedbrytningsveien til treonin .
Propionyl-CoA omdannes til succinyl-CoA , som deretter kan gå inn i sitronsyresyklusen og hjelpe til med å fylle på den . For dette formål blir propionyl-CoA først omdannet til D- metylmalonyl-CoA av biotin- avhengig propionyl-CoA-karboksylase . Den metylmalonyl-CoA-epimerase genererer så den L- isomeren. Dette blir igjen omdannet til succinyl-CoA ved metylmalonyl-CoA mutase , hvis funksjon avhenger av kobalamin .
Propionyl-CoA spiller også en rolle i fettsyresyntese . Dannelsen av oddetallsfettsyrer starter med propionyl-CoA. Metylgrener i en fettsyrekjede kan opprettes ved kjedeforlengelse med metylmalonyl-CoA, som produseres fra propionyl-CoA av propionyl-CoA-karboksylase.
Individuelle bevis
- ↑ Oppføring på COENZYME A i CosIng-databasen til EU-kommisjonen, åpnet 28. desember 2020.
- ↑ a b c d Dataark Koenzym A-hydrat, ≥85% (UV, HPLC) fra Sigma-Aldrich , åpnet 18. april 2017 ( PDF ).
- ↑ Janine Hellenbrand: Karakterisering av acyl-CoA-reduktaser . Avhandling, RWTH Aachen, 2012.
- ^ D. Doenecke, J. Koolman, G. Fuchs, W. Gerok: Karlsons Biochemie und Pathobiochemie. 15. utgave. Georg Thieme Verlag, Stuttgart 2005; Pp. 214f, 219ff, 281, 328f ISBN 978-3-13-357815-8 .
- ↑ Entry EC 5.1.99.1 i Brenda enzymet databasen
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biochemistry. 6. utgave. Spectrum Academic Publishing House, Elsevier GmbH, München 2007; Pp. 697f, 741f, 744f; ISBN 978-3-8274-1800-5 .
- Ur K. Urich: Comparative Animal Biochemistry. Springer Verlag, Berlin 1994; S. 564f; ISBN 3-540-57420-4 .
hovne opp
- Human biochemistry, Florian Horn ea, 3. utgave, Thieme Verlag 2005, ISBN 3-13-130883-4