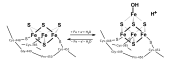Klynger av jern-svovel
Jern-svovel klynger ( Fe-S-sentre ) er flere komplekser av jern og svovel størrelsen av klynger som er involvert som kofaktorer i enzymreaksjoner. De vanligste og stabile er (4Fe-4S) og (2Fe-2S). Generelt ødelegges klynger når de er tilgjengelige for gratis oksygen. Tilgjengelighet avhenger av beskyttelsen av det bindende enzymet.
Disse Fe-S-sentrene fungerer som elektronoverføringsreaktanter, Lewis-syrer og radikale generatorer i enzymer . For eksempel kan nitrogen omdannes til ammoniakk , hydrogen til protoner og karbonmonoksid til karbondioksid :
Jernatomene i sentrene er koordinert av uorganisk sulfid og sidekjedene til aminosyrer . For eksempel kan cysteiner koordinere via deres tiolgruppe (se fig.).
biosyntese
Selv under reduserende, vandige betingelser, rombiske (2Fe-2S) komplekser dannes spontant . Andre metallioner, f.eks. B. nikkel eller molybden kan inkluderes i komplekset på rad. Dette skjer spesielt effektivt i organismen med deltagelse av et proteinkompleks som inneholder jern-svovel- klyngerammeproteinet (ISCU).
ISCU påtar seg rollen som å binde jernatomene, som transporteres av ISCA, mens enzymet cysteinavsvovlase gir svovelatomer med cysteinforbruk . Først settes (2Fe-2S) sammen, som til slutt blir (4Fe-4S) gjennom dimerisering. Denne prosessen kan finne sted i mitokondriene så vel som i cytosolen, hvoretter den ferdige (4Fe-4S) blir transportert inn i plasmaet eller umiddelbart innlemmet i tilgjengelige enzymer.
Hendelse
Anaerobe levende bakterier og arkea inneholder delvis også oksygensensitive enzymer med et nikkel-, jern- og svovelholdig senter som klyngen C er referert til.
Enzymet nitrogenase inneholder en Fe-Mo-S-klynge som en kofaktor.
Jern-svovelklynger finnes i mitokondrier, mitosomer og hydrogenosomer.
Liste over humane proteiner med (2Fe-2S)
- NADH-dehydrogenase , succinatdehydrogenase og cytokrom c-reduktase (kompleks I, II og III i luftveiskjeden , sitronsyresyklus )
- Adrenodoksin (syntese av skjoldbruskhormoner )
- Xanthine oxidase ( nukleotidmetabolisme )
- Aldehydoksydase ( biotransformasjon , nedbrytning av nikotin )
- Ferrogelatase ( porfyrinmetabolisme )
- Miner1 og Miner2
Liste over humane proteiner med (4Fe-4S)
- NADH dehydrogenase og succinatdehydrogenase (kompleks I og II i luftveiskjeden, sitronsyresyklus)
- Aconitase (sitronsyresyklus)
- Amidofosforibosyltransferase ( purinmetabolisme , inosinmonofosfat - de novo- syntese )
- Dihydropyrimidindehydrogenase (aminosyresyntese, syntese av β- alanin )
- IREBP2 (jernmetabolisme)
- Lipoylsyntase (proteinmodifisering)
- kjerneenzymer DNA primase og endonuklease III-lignende
Se også
litteratur
- H. Dobbek: Hvordan biologiske Fe-S-sentre aktiverer CO2 . I: Nyheter fra kjemi . teip 56 , nr. 7–8 , 2008, s. 734-737 , doi : 10.1002 / nadc.200857949 .
Individuelle bevis
- ↑ Beinert H: Jern-svovelproteiner: gamle strukturer, fremdeles fulle av overraskelser . I: J. Biol. Inorg. Chem . 5, nr. 1, februar 2000, s. 2-15. doi : 10.1007 / s007750050002 . PMID 10766431 .
- Ault Rouault TA, Tong WH: Jern-svovel-klyngebiogenese og menneskelig sykdom . I: Trends Genet. . 24, nr. 8, august 2008, s. 398-407. doi : 10.1016 / j.tig.2008.05.008 . PMID 18606475 . PMC 2574672 (gratis fulltekst).
- ↑ Chandramouli K, Unciuleac MC, Naik S, Dean DR, Huynh BH, Johnson MK: Dannelse og egenskaper av [4Fe-4S] klynger på IscU stillasproteinet . I: Biokjemi . 46, nr. 23, juni 2007, s. 6804-11. doi : 10.1021 / bi6026659 . PMID 17506525 .
- ↑ Yang J, Bitoun JP, Ding H: samspill av Isca og IscU i biogenese av jern-svovel-klynger . I: J. Biol. Chem . 281, nr. 38, september 2006, s. 27956-63. doi : 10.1074 / jbc.M601356200 . PMID 16877383 .