Vinsyre
| Strukturell formel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| D - (-) - form (øverst til venstre) og L - (+) - form (øverst til høyre) og mesoform (nederst) | |||||||||||||||||||
| Generell | |||||||||||||||||||
| Etternavn | Vinsyre | ||||||||||||||||||
| andre navn |
|
||||||||||||||||||
| Molekylær formel | C 4 H 6 O 6 | ||||||||||||||||||
| Kort beskrivelse |
fargeløst og luktfritt fast stoff med en sur smak |
||||||||||||||||||
| Eksterne identifikatorer / databaser | |||||||||||||||||||
| |||||||||||||||||||
| eiendommer | |||||||||||||||||||
| Molarmasse | 150,09 g mol −1 | ||||||||||||||||||
| Fysisk tilstand |
fast |
||||||||||||||||||
| tetthet |
|
||||||||||||||||||
| Smeltepunkt |
|
||||||||||||||||||
| p K S- verdi |
|
||||||||||||||||||
| løselighet |
|
||||||||||||||||||
| sikkerhetsinstruksjoner | |||||||||||||||||||
| |||||||||||||||||||
| Toksikologiske data | |||||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er oppgitt, gjelder opplysningene standardbetingelser . | |||||||||||||||||||
Vinsyre , også kjent som 2,3-dihydroksysuccinic eller 2,3-dihydroxybutandioic eller vinsyre , på latin som Acidum tartaricum og engelsk med vinsyre refererer til det greske tartaros helvetet på grunn av den etsende, brennende effekten.
Det er en dikarboksylsyre i α- hydroksykarboksylsyregruppen . Det hører til sukker dikarboksylsyrer ( aldaric syrer ), deres salter og estere er kalt tartrater . L - (+) - vinsyre forekommer for eksempel i druer og er godkjent i EU som et tilsetningsstoff E 334 . I Tyskland er den totale surheten av viner - beregnet som vinsyre - også gitt, selv om det finnes en rekke andre syrer, spesielt eplesyre , i vin .
Druesyre er navnet på racemat av vinsyre. Den intermolekylære eliminasjonen av vann produserer polymeren metatarinsyre , som også brukes som et tilsetningsstoff under betegnelsen E 353 .
historie
Før oppdagelsen av vinsyre, dens salt, kaliumhydrogentartrat , eller tannstein , ble antatt å være en syre, fordi dets dårlige vannløselighet i vin gjør det lettere for kjemikere å gjenkjenne enn det lett oppløselige vinsyre. På den tiden var begrepet vinbrennevin , som fortsatt brukes ofte i dag, vanlig for ren alkohol . I 1732 ble Weinstein oppført som en fast syre av Boerhaave . I 1764 oppdaget Marggraf et alkalimetall i tannstein, hvorpå han spaltet det med kalsium til kalsiumtartrat , som han ikke undersøkte nærmere. Det var ikke før i 1769 at Scheele , som ofte blir sett på som oppdageren av vinsyre, spaltet kalsiumtartrat med svovelsyre og refererte til den separerte krystallinske syren som "vinsyre". Tartaren ble gjenkjent like etterpå som det sure kaliumsaltet av denne syren.
I 1819, druesyre (Vosic ble syre) oppdaget av produsenten Karl Kestner som et biprodukt av vinsyre produksjon. Den isomeri av vinsyre ble etablert av Gay-Lussac i 1826 og omgås i nærmere detalj ved Pasteur , men på den tiden bare den optisk aktive "høyredreiende vinsyre", dvs. L -vinsyre og druesyre, kalt "racemisk syre" , var kjent. Pasteur laget natriumammoniumsaltet av disse syrene og oppdaget chiralitet i prosessen . Med et forstørrelsesglass og en pinsett, separerte Pasteur krystallene i venstre- og høyrehendte eksemplarer.
Pasteur satte de enantiomere natriumammoniumtartratene separert fra racemat tilbake i oppløsning og undersøkte rotasjonsverdien i polarimeteret . Han fant at begge løsningene av saltene oppnådd fra den optisk inaktive druesyren var optisk aktive og viste samme spesifikke rotasjon som natriumammoniumsaltet oppnådd fra L- vinsyre, men med motsatte tegn. Fra dette konkluderte Pasteur med at druesyre ikke er en ren substans , men en like blanding av medurs og moturs vinsyre, dvs. et racemat. Uttrykket racemat for en blanding av to enantiomerer i like deler er avledet fra det latinske navnet på druesyre (Acidum racemicum).
Tolkningene av Pasteurs eksperiment er ikke begrenset til det faktum at druesyre er et racemat av L - og D - vinsyre. Pasteur erkjente at den optiske aktiviteten måtte være et resultat av en egenskap til selve vinsyremolekylet. Men det var først i 1874 at Le Bel og van 't Hoff , som senere ble den første nobelprisvinneren i kjemi , var i stand til å forklare dette uavhengig på grunnlag av den molekylære strukturen. Å vite "at fire forskjellige gjenstander kan ordnes på to forskjellige måter i hjørnene av en tetraeder og at disse ordningene er relatert til hverandre som bilde og speilbilde som ikke kan bringes i kongruens" antydet at de fire radikalene bundet til et karbonatom er ordnet på en tetraederisk måte. Basert på dette antok de at optisk aktive molekyler inneholder minst ett karbonatom med fire forskjellige radikaler, dvs. et asymmetrisk karbonatom. "Optisk inaktive organiske stoffer inneholder derfor enten ikke et asymmetrisk karbonatom, eller de er blandinger av like deler av to enantiomerer."
Van 't Hoff og Le Bel anerkjente den tetraedriske geometrien til karbonatomet på den ene siden og ga en avgjørende forklaring på den optiske aktiviteten til organiske stoffer på den andre. Bare meso- forbindelsene kunne ikke dekkes av definisjonen deres; strukturen til meso- vinsyre ble først oppdaget mye senere . I lang tid var det også ukjent hvilken enantiomer av vinsyre som nå dreier lysets polarisasjonsplan mot høyre og hvilken som dreier det mot venstre. Det var først i 1951 at Bijvoet var i stand til å bruke en spesiell røntgenmetode basert på natriumrubidiumtartrat for å klargjøre at L- vinsyre er dekstroterende (+) enantiomer og D- vinsyre er den levorotatoriske (-) enantiomeren. Ved å konvertere vinsyre til andre kjemiske forbindelser, kan dette også avklares for mange andre par enantiomerer.
Hendelse
L - (+) - vinsyre og dens kalsium-, kalium- og magnesiumsalter er spesielt rikelig i vinstokkene, druene og bladene på vintreet, i løvetann, sukkerroer, tamarind , umodne rognebær , i frøene til spindelen tre , i bladene av agaves , i sort pepper , i ananas og i mange andre frukter. Under vinfremstilling avsettes lite løselige salter av vinsyre som tannstein på bunnen av vinfat eller vinflasker. The D - (-) - vinsyre kalt, ikke helt riktig unaturlig vinsyre, finnes bare i bladene av vestafrikanske orkide tre Bauhinia reticulata . Den meso eksisterer ikke form i naturen.
Produksjon
Vinsyre kan produseres fra vinsyre etter at den er omdannet til kalsiumtartrat. Vinsyre kan frigjøres fra dette med svovelsyre , gips dannes som et biprodukt . Den meso- formen kan fremstilles ved oksydering av fumarsyre eller maleinsyreanhydrid med hydrogenperoxyd , kaliumpermanganat eller andre persyrer .
Ren D - (-) - vinsyre kan oppnås fra racematet ved å bryte det ned med børste mugg Penicillium glaucum , ettersom Penicillium glaucum bare bryter ned L - (+) - vinsyre.
eiendommer
De to karbonatomer som bærer de to hydroksylgruppene i molekylet av vinsyre er stereosentrere . Avhengig av konfigurasjonen til disse sentrene, D - (-) - vinsyre [synonym: ( 2S , 3S ) -vinsyre], L - (+) - vinsyre [synonym: ( 2R , 3R ) -vinsyre] eller den optisk inaktive mesoen - vinsyre. I mesoformen er en av stereosentrene ( R ) - den andre ( S ) -konfigurert . Høyrehendt L - (+) - form forekommer vanligvis i naturen . De to enantiomerene av vinsyre [ L - (+) - vinsyre og D - (-) - vinsyre] skiller seg ikke ut i fysiske og kjemiske egenskaper bare når det gjelder rotasjonsverdien mot lineært polarisert lys. Rotasjonsverdien α for L - (+) - vinsyre + 12,7 °, med D - (-) - vinsyre −12,7 ° under de samme måleforholdene. Som med alle meso- forbindelser er rotasjonsverdien for meso- vinsyre ± 0 °. De fysiologiske egenskapene til alle tre stereoisomerer av vinsyre er forskjellige.
| Isomerer av vinsyre | ||||
| Etternavn | D - (-) - vinsyre | L - (+) - vinsyre | meso- vinsyre | |
| andre navn | ( 2S , 3S ) -vinsyre | ( 2R , 3R ) -vinsyre | ||
| Strukturell formel |

|
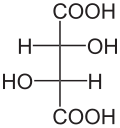
|
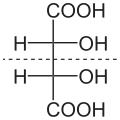 Stiplet linje: speilplan |
|
| CAS-nummer | 147-71-7 | 87-69-4 | 147-73-9 | |
| 133-37-9 [ DL - (±) blanding] | ||||
| 526-83-0 (uspes.) | ||||
| EF-nummer | 205-695-6 | 201-766-0 | 205-696-1 | |
| 205-105-7 [ DL - (±) blanding] | ||||
| 610-885-0 (uspes.) | ||||
| ECHA- infokort | 100.005.178 | 100,001.606 | 100.005.179 | |
| 100.004.642 [ DL - (±) blanding] | ||||
| 100.121.903 (uspes.) | ||||
| PubChem | 439655 | 444305 | 440015 | |
| 875 (uspes.) | ||||
| Wikidata | Q23034947 | Q18226455 | Q12447642 | |
| Q4111665 [ DL - (±) blanding] | ||||
| Q411237 (uspes.) | ||||
Alkalisaltene av vinsyre er i stand til å kompleksbinde ( binde ) kobber (II) ioner i en alkalisk løsning og dermed holde dem i oppløsning ( Fehlings løsning ). Hydrogentartrater kan også dannes som en dibasisk, relativt sterk syre. En blanding av like store mengder L - (+) - og D - (-) - vinsyre ( racemat ) kalles druesyre, smeltepunkt 205-206 ° C. Denne blandingen kalles noen ganger racemisk vinsyre. En blanding av de tre stereoisomerer av vinsyre med varierende proporsjoner L - (+) -, D - (-) - og meso- vinsyre blir handlet som en blanding av isomerer av vinsyre.
bruk
Bare L- vinsyre brukes i større skala , da det er et produkt av de fleste synteseprosesser for vinsyre. 50% av den produserte L (+) - vinsyre brukes i næringsmiddelindustrien og legemidler, den andre halvdelen innen tekniske bruksområder.
Vinsyre brukes som ingrediens i desinfeksjonsmidler. Som regel er det ikke indikert om det er L - eller D - vinsyre, den racemisk blandede vinsyre eller et annet blandingsforhold.
Brukes som tilsetningsstoff
Den mest åpenbare anvendelsen av vinsyre er i bruken som tilsetningsstoff. L- vinsyre, referert til som E 334 i dette området , finnes ikke bare naturlig i mange matvarer, men tilsettes også til mange blandede matvarer på grunn av sin smak og konserverende egenskaper. Vinsyre brukes til tilberedning av iskrem, kunstig honning , frukt, limonader og brus, gelé , vingummier og konfekt, f.eks. B. for å stabilisere kremer og skum, og brukes til forsuring av syrer med lav syre. Begrepet vinsyre er også feil brukt i bake bøker. Den orale toksisiteten til L- vinsyre var ekstremt lav i dyreforsøk med rotter; den orale LD Lo for rotter var 7500 mg / kg kroppsvekt.
Metatartaric acid (E 353), en polymer som lakton , brukes hovedsakelig for å stabilisere vinsyre; som en kolloid beskyttelse, forhindrer den krystallisering av tannstein i vinen.
Tekniske bruksområder
Vinsyre brukes også i mange tekniske områder, inkludert å gjøre silke føles bedre og glatt . Vinsyreens evne til å danne komplekser med metaller er betydelig : I disse kompleksene er metallkationen bundet tettere av vinsyre enn i de fleste andre organiske syrer . Dette resulterer i mange mulige bruksområder. Kaliumnatriumtartrat brukes for eksempel som et kompleksdannende middel i Fehlings løsning , og vinsyre for overflatebehandling av kobber og messing. Sistnevnte kan også brukes til å rense gulv som er forurenset med tungmetaller, da det binder giftige tungmetaller her , men i seg selv er biologisk nedbrytbart. Hvis det tilsettes sement og gips av Paris , forsinker det innstillingen ved å kompleksbinde kalsiumionene og utvider dermed arbeids- og deformerbarhetstiden. Det fungerer også som et reduksjonsmiddel og for oppløsning av organiske baser. I moderne organisk syntese, LiAlH 4 -vinsyre derivater slik som TADDOL er viktige chirale reagenser eller katalysatorer for enantio-selektiv reduksjon av ketoner og andre stereoselektive synteseprosesser.
weblenker
Individuelle bevis
- ^ Alfred Henry Allen: Kommersiell organisk analyse. Vol. I, 2. utgave, J. & A. Churchill, 1885, s. 435, online på babel.hathitrust.org, åpnet 13. november 2017.
- ↑ a b c d Rudolf Wagner : Die Chemie. 6. utgave, Wiegand, 1873, s. 515.
- Me Hans Meyer: Lærebok for organisk kjemisk metodikk. Andre bind, Springer, 1933, ISBN 978-3-662-37141-1 (opptrykk), s. 161.
- ↑ Oppføring på E 334: Vinsyre (L (+) -) i den europeiske databasen om tilsetningsstoffer i mat, tilgjengelig 27. juni 2020.
- ↑ a b Dataark D - (-) - vinsyre (PDF) fra Carl Roth , åpnet 7. august 2010.
- ↑ a b c K. Peter C. Vollhardt: Organisk kjemi. 1. korrigert opptrykk av 1. utgave, VCH, Weinheim 1990, ISBN 3-527-26912-6 , s. 166.
- ↑ en b c The Merck Index . En leksikon om kjemikalier, medisiner og biologiske stoffer. 14. utgave, 2006, ISBN 978-0-911910-00-1 , s. 1557-1558.
- ↑ a b c d e Oppføring på vinsyre. I: Römpp Online . Georg Thieme Verlag, åpnet 12. november 2014.
- ↑ a b Oppføring av vinsyre i GESTIS stoffdatabase til IFA , åpnet 10. januar 2017. (JavaScript kreves)
- ↑ a b Oppføring av vinsyre i ChemIDplus- databasen til United States National Library of Medicine (NLM), åpnet 25. mars 2021.
- ^ Johann Christian Poggendorff : Biografisk-litterær kortfattet ordbok. 1. Volum: A - L , Barth, 1863, s. 1251.
- ↑ a b H. Hart, LE Crane, DJ Hart: Organisk kjemi. 2. utgave, WILEY-VCH Verlag, Weinheim 2002, ISBN 978-3-527-30379-3 , s. 193.
- ↑ E. Breitmaier, G. Jung: Organisk kjemi. 4. utgave, Thieme Verlag, 2001, ISBN 978-3-13-541504-8 .
- ↑ S. Görtges: Metatartaric acid for vinsyre stabilisering ( Memento fra 15. august 2016 i Internet Archive ) (PDF). I: Sveits. Z. fruktdyrking. Nr. 1, 2002, s. 8-9.
- ↑ D. Seebach , AK Beck og A. Heckel: TADDOLs, deres derivater, og TADDOL Analogues: Versatile Chirale hjelpestoffer. I: Angewandte Chemie International Edition . 40, 2001, s. 92-138, PMID 11169693 .
- ↑ M. Aoki og D. Seebach : Fremstilling av TADOOH, et hydroperoksyd fra TADDOL, og bruk i spesielt Enantioface- og Enantiomer-differensierende Oxidations. I: Helvetica Chimica Acta . 84, 2001, s. 187-207, doi : 10.1002 / 1522-2675 (20010131) 84: 1 <187 :: AID-HLCA187> 3.0.CO; 2-O .


