1,2,3-trihydroksybenzen
| Strukturell formel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Generell | |||||||||||||||||||
| Etternavn | 1,2,3-trihydroksybenzen | ||||||||||||||||||
| andre navn |
|
||||||||||||||||||
| Molekylær formel | C 6 H 6 O 3 | ||||||||||||||||||
| Kort beskrivelse |
fargeløse, blanke blader eller nåler |
||||||||||||||||||
| Eksterne identifikatorer / databaser | |||||||||||||||||||
| |||||||||||||||||||
| eiendommer | |||||||||||||||||||
| Molarmasse | 126,11 g mol −1 | ||||||||||||||||||
| Fysisk tilstand |
fast |
||||||||||||||||||
| tetthet |
1,45 g cm −3 (20 ° C) |
||||||||||||||||||
| Smeltepunkt |
131-135 ° C |
||||||||||||||||||
| kokepunkt |
309 ° C |
||||||||||||||||||
| Damptrykk |
2-4 hPa (140 ° C) |
||||||||||||||||||
| pK s verdi |
9.01 |
||||||||||||||||||
| løselighet |
|
||||||||||||||||||
| Brytningsindeks |
1,561 (134 ° C) |
||||||||||||||||||
| sikkerhetsinstruksjoner | |||||||||||||||||||
| |||||||||||||||||||
| Toksikologiske data | |||||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . Brytningsindeks: Na-D-linje , 20 ° C | |||||||||||||||||||
1,2,3-trihydroksybenzen (vanlig navn pyrogallol) er et derivat av benzen , en treverdig fenol med tre vicinale hydroksylgrupper. De to andre isomerer er 1,3,5-trihydroxybenzen (phloroglucinol) og 1,2,4-trihydroxybenzen (hydroxyhydroquinone).
historie
1,2,3-trihydroxybenzenen ble produsert av Johann Heinrich Pott i 1746 ved sublimering av galleepler og først produsert, karakterisert og navngitt i 1786 av Carl Wilhelm Scheele ved oppvarming av gallinsyre . Det vanlige navnet pyrogallol er avledet fra gresk pyr = ild og gallol fra gallinsyre ; -ol refererer til hydroksy (OH) gruppene og indikerer fremstillingsmetoden.
Ekstraksjon / representasjon
1,2,3-trihydroksybenzen kan lett fremstilles ved pyrolyse av gallinsyre med dekarboksylering .
Også mulig er fremstilling ved hydrolyse av 2,2,6,6-tetraklorsykloheksanon og oksidasjon av resorcinol med hydrogenperoksid . Det oppstår også fra nedbrytningen av tanniner .
eiendommer
I ren tilstand består 1,2,3-trihydroksybenzen av hvite krystallnåler som imidlertid raskt blir gråbrune når de utsettes for luft. Det er et kraftig reduksjonsmiddel og absorberer ivrig oksygen fra luften i alkalisk løsning . det kompleksmetallioner (f.eks Fe 3+ med en blå farge). Når du står i luften i lang tid (spesielt i en alkalisk løsning), oksyderes 1,2,3-trihydroxybenzen til karbondioksid , eddiksyre , purpurogallin (trihydroxybenztropolon) og andre nedbrytningsprodukter; løsningen blir da mørkebrun. På grunn av denne nedbrytningen reagerer de vandige løsningene gradvis surere, det er her navnet pyrogallinsyre kommer fra , men dette er ikke et passende navn for den rene substansen.
bruk
1,2,3-trihydroksybenzen ble tidligere brukt eksternt for psoriasis og lupus erythematosus . I analytisk kjemi brukes 1,2,3-trihydroksybenzen til å absorbere oksygen i gassanalyse , som et reagens for antimon , vismut , niob , osmium og tantal , for å redusere sølv, gull og kvikksølvsalter og for å bestemme aktiviteten til peroksidaser .
I mikrobiologi brukes 1,2,3-trihydroxybenzen som en komponent i pyrogallolforseglingen ("Wright-Burri seal") i dyrking av anaerobe bakterier . Absorpsjonen av oksygen fra en alkalisk 1,2,3-trihydroxybenzen-løsning i en lufttett beholder brukes (vanligvis ved hjelp av en mettet kalsiumkarbonatoppløsning ). For dette formål påføres 1,2,3-trihydroksybenzen-kalsiumkarbonatblandingen pipettert på et passende bærermateriale (f.eks. Bomullsull ) over næringsmediet .
Den brukes også i hårfarger og er en av de eldste fotografiske utviklerne og brukes fortsatt i holografi i dag. 1,2,3-trihydroksybenzen brukes også i litografi, i fotoresister, i belegningsmaterialer og i lim. Det fungerer også som tverrbindingsmiddel og herder for epoksyharpikser , spesielt for fremstilling av elektroniske komponenter. Forbindelsen brukes også som et mellomprodukt ved fremstilling av forskjellige organiske forbindelser så som legemidler. I tillegg til BHT brukes 1,2,3-trihydroxybenzen noen ganger som en stabilisator for stoffer som dietyleter eller karotenoider , som er gjenstand for autoksidering av atmosfærisk oksygen.
bevis
For kvalitativt analytisk bevis produserer bromering med kaliumbromid og brom dibromderivatet, som har et smeltepunkt på 158 ° C.
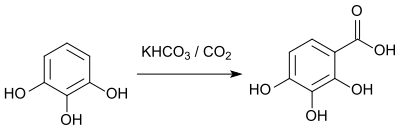
Reaksjoner
Den karboksylering av 1,2,3-trihydroksybenzen ved en Kolbe-Schmitt-reaksjonen fører til 2,3,4-trihydroxybenzoic syre.
sikkerhetsinstruksjoner
1,2,3-trihydroxybenzen er helseskadelig. Det absorberes også gradvis gjennom huden. I dyreforsøk , så vel som forsøket på endringer i humane celler, var DNA som skulle oppdages.
Individuelle bevis
- ↑ a b c d e f g h i j k l m oppføring på pyrogallol. I: Römpp Online . Georg Thieme Verlag, åpnet 2. august 2018.
- ↑ a b c d e f Oppføring av 1,2,3-trihydroksybenzen i GESTIS stoffdatabase til IFA , åpnet 23. januar 2020. (JavaScript kreves)
- ↑ CRC Handbook of Tables for Organic Compound Identification . 3. Utgave. 1984, ISBN 0-8493-0303-6 .
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-36.
- ↑ Entry på pyrogallol i klassifisering og merking Inventory of det europeiske kjemikaliebyrået (ECHA), åpnes den 1. februar, 2016. Produsenter eller distributører kan utvide den harmonisert klassifisering og merking .
- ↑ Dataark 1,2,3-trihydroxybenzen (PDF) fra Merck , tilgjengelig 18. januar 2011.
- ^ Pötsch et al: Lexikon av viktige kjemikere. 1989, s. 349, artikkel Pott.
- ↑ Pamflett om biologi: Kofoid-samling . 1862, s. 61 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ Nicole Borth, Brigitte Gasser, Regina Grillari, Renate Kunert, Ksenija Lopandic, Brigitte Lang, Diethard Mattanovich, Jutta Mattanovich, Christine Prenner, Beatrix Mayer-Reinprecht, Michael Sauer, Karola Vorauer-Uhl: arbeidsprotokoller 2018/19, 791.128 generell mikrobiologi øvelser . Red.: University of Natural Resources and Life Sciences, Wien. Wien 2018, s. 36 f .
- ^ Graham Saxby: Practical Holography, Third Edition . CRC Press, 2010, ISBN 1-4200-3366-2 , pp. 63 ( begrenset forhåndsvisning i Google Book-søk).
- ^ Felles FAO / WHO ekspertkomité for tilsetningsstoffer i mat. Møte: Compendium of Food Additive Specifications: Addendum 8 . Food & Agriculture Org., 2000, ISBN 92-5104508-9 , pp. 53 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ Mark S. Meskin, Wayne R. Bidlack, R. Keith Randolph: Phytochemicals: Aldring og helse . CRC Press, 2008, ISBN 978-1-4200-6138-3 , pp. 68 ( begrenset forhåndsvisning i Google Book-søk).
- ^ Forening av forfattere: Organikum . 19. utgave. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8 , s. 331.
- ^ Forening av forfattere: Organikum . 19. utgave. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8 , s. 653.
- ^ VK Ahluwalia: Intermediates For Organic Synthesis . IK International Pvt Ltd, 2005, ISBN 81-88237-33-7 , pp. 86 ( begrenset forhåndsvisning i Google Book-søk).