Ethene
| Strukturell formel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Generell | ||||||||||||||||
| Etternavn | Ethene ( IUPAC ) | |||||||||||||||
| andre navn |
|
|||||||||||||||
| Molekylær formel | C 2 H 4 | |||||||||||||||
| Kort beskrivelse |
ekstremt brannfarlig, fargeløs gass med en litt søt lukt |
|||||||||||||||
| Eksterne identifikatorer / databaser | ||||||||||||||||
| ||||||||||||||||
| eiendommer | ||||||||||||||||
| Molarmasse | 28,05 g mol −1 | |||||||||||||||
| Fysisk tilstand |
gassformig |
|||||||||||||||
| tetthet |
1.178 kg m −3 (15 ° C) |
|||||||||||||||
| Smeltepunkt |
−169,18 ° C |
|||||||||||||||
| kokepunkt |
−103,8 ° C |
|||||||||||||||
| Damptrykk |
4,1 M Pa (20 ° C) |
|||||||||||||||
| løselighet |
veldig dårlig i vann (130 mg l −1 ) |
|||||||||||||||
| Dipole øyeblikk |
0 |
|||||||||||||||
| sikkerhetsinstruksjoner | ||||||||||||||||
| ||||||||||||||||
| MAK |
Sveits: 10.000 ml m −3 eller 11.500 mg m −3 |
|||||||||||||||
| Termodynamiske egenskaper | ||||||||||||||||
| ΔH f 0 |
52,4 kJ / mol |
|||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er oppgitt, gjelder opplysningene standardbetingelser . | ||||||||||||||||
Eten (også eten , etylen eller etylen ) er en gassformig, fargeløs, brannfarlig, luktende, organisk forbindelse med den empiriske formelen C 2 H 4 . Det er den enkleste alkenen , et umettet hydrokarbon med en karbon -Kohlenstoff- dobbeltbinding .
Eten produseres kommersielt ved dampsprekking av en rekke hydrokarboner . I Europa og Asia produseres eten hovedsakelig fra nafta eller gassolje , i USA , Canada og Midtøsten er det også produsert av etan , propan og flytende gass .
Eten er det mest produserte organiske basiske kjemikaliet og brukes til fremstilling av primære sekundære produkter som polyetylen , etylenoksid , styren og α-olefiner .
Planter som modne epler og bananer og den japanske røde furuen avgir eten, og det er viktig som modningsgass og fytohormon .
historie
I det gamle Egypt ble eten ubevisst brukt til å modne morbærfiken . For dette formålet ble de umodne fruktene ripet opp. Disse produserte deretter eten og akselererte modningsprosessen. Ethene ble først nevnt som en gass i 1669 i verket Actorum Laboratorii Chymici Monacensis, seu Physicae subterraneae av den tyske alkymisten Johann Joachim Becher . Bæger oppnådde gassen ved å varme etanol med svovelsyre .
Den nederlandske legen Jan Ingenhousz sies å ha lært om syntesen av eten utført i Amsterdam av Henricus Aeneae (Enée) og hans kollega John Cuthbertson allerede i 1777 . I 1795 oppdaget de fire nederlandske kjemikerne Johan Rudolph Deiman , Adriaan Paets van Troostwijk , Anthonie Lauwerenburgh og Nicolaas Bondt syntesen av 1,2-dikloretan fra eten og klor . Siden produktet ble kalt oljen til de nederlandske kjemikerne , ble eten kalt på fransk gaz oléfiant ("oljeformende gass"), på engelsk olefiant gas . I 1807 prøvde John Dalton å lage en strukturformel. I andre halvdel av 1800 -tallet lyktes den syntetiske fremstillingen av vegetabilske syrer som ravsyre fra eten.
Teknisk var eten først gjenvunnet ved dehydrering av etanol eller ved isolering fra koksovnsgass . Den første store produksjonen av eten fra etanol fant sted i 1913 i de elektrokjemiske verkene i Bitterfeld. Eten oppnådd på denne måten ble brukt til kjøling. Først i 1981 gjenopptok Salgema Industrias Quimicas prosessen i Brasil. Salgema produserte rundt 100.000 tonn per år basert på et Petrobras- patent . Utgangsmaterialet for "Green Ethylene" er etanol fra sukkerrør . I 2010 bygde Braskem et anlegg for dehydrering av etanol i Triunfo i Rio Grande do Sul med en årlig kapasitet på 200 000 tonn.
Den teknisk relevante prosessen i dag er den dampkrakking av nafta eller høyere hydrokarbonblandinger , slik som hydrowax . Tyskland er den største produsenten av eten i Europa med et produksjonsvolum på 2,9 millioner tonn (1989), etterfulgt av Frankrike med 2,5 og England med 1,9 millioner tonn.
Eten kan oppnås under egnede prosessbetingelser med aluminiumoksyd-titandioksydkatalysatorer med dehydrering fra metanol eller dets sekundære produkt dimetyleter . I laboratoriet er det dehalogenering av 1,2-dikloretan med oppnådd sink .
Utvinning og presentasjon
Eten er delvis oppnådd som et av- produkt , men mesteparten av eten som kreves oppnås ved termisk eller katalytisk krakking av hydrokarboner. Naturgass , nafta eller høyere kokende destillatkutt brukes for det meste som råvarer . I tillegg til sprekker er dehydrering av etan , som finnes i store mengder i skifergasser , en teknisk rute. Dehydrering av etanol spiller en viktig rolle i land med stor bioetanolproduksjon .
I 2010 ble det produsert rundt 123 millioner tonn eten over hele verden per år . Produksjonen i Tyskland var 5,1 millioner tonn per år.
Etenfordeling
I Tyskland og deler av Nederland er det et etensystem for transport mellom de kjemiske nettstedene fra Rotterdam via Antwerpen til Köln-området og Emscher-Lippe-området samt Rhinen-hovedområdet og Ludwigshafen am Rhein.
I Bayern er det en rørledning mellom den kjemiske trekanten i sør-øst og det kjemiske stedet nær Ingolstadt ( etylenrørledning Münchsmünster-Gendorf ). Ved igangkjøring av den 370 km lange etylenrørledningen sør fra Münchsmünster til Ludwigshafen am Rhein i juli 2013, ble det nordvesttyske nettverket koblet til de bayerske kjemiske nettstedene.
eiendommer
Molekylære egenskaper
Mellom de to karbon - atomer er en dobbeltbinding . En rotasjon rundt denne bindingen krever betydelig mer energi enn en rotasjon rundt en enkeltbinding mellom to karbonatomer. På grunn av sp 2 - er hybridisering av karbonatomene molekylet plant , dvs. at alle atomene ligger i et plan. H - C - H bindingsvinklene er hver 117 ° og avviker således bare litt fra den teoretisk ideelle verdien av den trigonale plane formen på 120 °. C = C dobbeltbindingen, med en bindingslengde på 133 pm, er betydelig kortere enn C - C enkeltbindingen i etan (154 pm). Imidlertid er de to bindingene mellom karbonatomene i eten ikke like sterke: bindingsenergien til σ-bindingen er rundt 450 kJ / mol, den for π-bindingen rundt 270 kJ / mol (se også σ-π-modellen ). Følgelig kan π -bindingen lettere deles, for eksempel i en kjemisk reaksjon. Generelt, på grunn av den høye elektrontettheten mellom de to karbonatomer , er eten mye mer reaktiv enn for eksempel den enkelt bundne etanen.
Fysiske egenskaper
På grunn av den reaktive C = C dobbeltbindingen, er tillegg til denne bindingen en typisk reaksjon av eten. Bare 130 mg / l eten er løselig i vann, men eten er lett løselig i organiske (ikke-polære) løsemidler. Ethene har en litt søt, ubehagelig lukt. Luktterskelen er 260 ml / m 3 . Den brennverdi av eten er 47,2 MJ / kg.
Andre funksjoner:
- Smeltevarme : 3,35 kJ / mol
- Fordampningsvarme : 13,9 kJ / mol
- C p : 42,9 J / (mol K)
- A f H 0 g : 52,47 kJ / mol
- S 0 : 219,32 J / (mol K)
Eten krystalliserer ved -175 ° C i en rombenhetcelle med to molekyler per celle og gitterparametrene a = 6,46, b = 4,87, c = 4,14. Tettheten er 0,717 g / cm 3 .
Den flammepunkt er -136 ° C, den tennpunkt er 425 ° C.
Kjemiske egenskaper
Reaksjoner med dannelsen av en karbon-karbonbinding
Etenmolekyler polymeriserer , radikalt under høyt trykk eller ved hjelp av Ziegler-katalysatorer for å danne polyetylen .
Eten reagerer med andre olefiner som propylen for å danne etylen-propylenkopolymerer , med tilsetning av diener for å danne etylen-propylen-dien-gummi .
Eten reagerer med tetrafluoretylen for å danne etylen-tetrafluoretylen , og med andre umettede forbindelser for å danne kopolymerer.
Ved nikkelkatalyse kan eten oligomeriseres til a-olefiner. Interne olefiner kan omdannes til α-olefiner med eten med metese . Begge reaksjonene brukes i industriell skala i SHOP-prosessen .
Den hydroformylering av eten med karbonmonoksyd og hydrogen er en teknisk måte å fremstille propanal .
Hydrocyanering av eten med hydrogencyanid til propionitril katalyseres av nikkelkatalysatorer . Hydrogenering eller hydrolyse gir propylamin eller propionsyre .
Eten reagerer i en en -reaksjon , en perisyklisk reaksjon med en forbindelse som inneholder hydrogen i den allyliske stillingen, og danner en binding mellom et karbonatom i dobbeltbindingen og enofilen, og overfører det allyliske hydrogenet til enofilen.
Reagerer med dannelsen av en oksygen-karbonbinding
Hvis det er tilstrekkelig oksygentilførsel, brenner eten for å danne vann og karbondioksid.
Med luft eller oksygen og sølv som katalysator , finner epoksydering til etylenoksyd sted ved en temperatur på 220 til 280 ° C og under økt trykk . Videre reaksjon med vann gir etylenglykol .
Ved å reagere med svovelsyre dannes en svovelsyrehalvester som kan omdannes til etanol ved hydrolyse . Denne synteseveien til industriell alkohol ble erstattet av den fosforsyre- katalyserte reaksjonen med vann.
I Wacker-Hoechst-prosessen oksyderes eten til acetaldehyd ved hjelp av palladiumkatalyse . Reaksjonen er representert ved følgende ligninger:
Organometalliske forbindelser
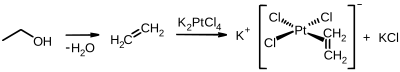
Den første metallorganiske forbindelse med et eten-ligand, det Zeise salt med den empiriske formel K [PtCl 3 (C- 2 H- 4 )] H 2 O, ble syntetisert i 1830 av den danske kjemiker William Christopher Zeise . Eten danner π-komplekser med overgangsmetaller.
Andre reaksjoner
Når den utsettes for varme og i fravær av luft, brytes eten ned i metan og karbon.
Eten reagerer med klor og danner 1,2-dikloretan ( tilsetningsreaksjon ).
Eten reagerer med hydrogen under høyt trykk og tilstedeværelsen av metalliske katalysatorer som platina og nikkel for å danne etan ( hydrogenering ).
bruk

De viktigste biproduktene av eten er polyetylen (56%), dvs. H. plasttypene HDPE, LDPE og LLDPE, etylendiklorid for produksjon av PVC (14%), etylenoksid (11%) for produksjon av polyesterforløperetylenglykol eller for eksempel ikke-ioniske overflateaktive stoffer (vaskemidler) og etylbenzen (7 %) for produksjon av polystyren . Dette betyr at mer enn 75% av etenet brukes til å lage plast.
Eten er også utgangsmaterialet for produksjon av mange organiske forbindelser som antracen , 2-kloretanol , kloretan , propanal , isopren , vinylacetat , propansyre , buten , styren , etandiol og andre stoffer. I Wacker-Hoechst-prosessen blir eten omdannet til acetaldehyd (etanol) i industriell skala ved bruk av molekylært oksygen (rundt 1,3% av etenforbruket).
Eten ble brukt som et bedøvelsesmiddel i tillegg til lystgass , spesielt for svak bedøvelse. Det har en narkotisk og muskelavslappende effekt. Den ble brukt offentlig for første gang i Chicago i 1923; den narkotiske effekten av eten er noe sterkere enn den av lystgass og har en lignende virkningsmekanisme. Imidlertid brukes den ikke lenger i dag fordi den er brannfarlig og har en ubehagelig lukt. I tillegg er den bedøvende effekten av eten ikke veldig god sammenlignet med andre vanlige narkotika; For å oppnå en god effekt må bedøvelsesblandingen inneholde minst 80% eten.
Det brukes også til å modne umodne frukter som epler , bananer og tomater , samt å indusere blomsterdannelse, enten ved røyking i lukkede drivhus eller utendørs via aktive ingredienser som frigjør eten i plantecellen, for eksempel. B. ethephon eller Etacelasil. Eten er også en drivstoffgass og brukes til høyhastighets flammespraying . Eten i kjemisk industri råvare for syntese av mer enn 30% av petrokjemikalier , det har etynet fordrevet etter andre verdenskrig, hovedsakelig fordi acetylen er dyrere å produsere, mens eten oppnådd masse i industrielle prosesser, er siden olje i store mengder tilgjengelig.
Det brukes også til fremstilling av plantevernmidler og kjemiske våpen som sennepsgass (2,2-diklordietylsulfid).
Under andre verdenskrig ble etengass eksperimentelt brukt av Taifun -troppen for å angripe festninger .
Biologisk effekt
Eten er et fytohormon (plantehormon). Det syntetiseres av planter fra aminosyren metionin , delvis stimulert av fytohormon auxin . Som et hormon påvirker det kimvekst og aldring i planter . Det får frukten til å modnes , utviklingen av blomstene , bladene faller om høsten og døden av deler av planten. Som et gassformig stoff finnes eten hovedsakelig i mellomrommene mellom cellene, de intercellulære områdene .
Allerede i 1901 viste Dimitri Neljubow at eten utløser den såkalte "triple response" i planter. Dette skjer med spirende røtter som er fumigated med etene. Effekten var merkbar på planter på defekte bygassledninger, som viste uvanlig vekst. Det handler om en hemming av den langsgående veksten i samarbeid med fortykning av stammen og en deaktivering av gravitropismen , dvs. veksten i retning av gravitasjonskraften . Denne effekten oppstår gjennom en omorientering av mikrotubuli , som, som skjelettstrukturer, bestemmer retningen for bakteriens vekst (akkumulering av cellulosefibre ). De bringes fra en vertikal til en horisontal orientering. Å overvinne hindringer antas å være den biologiske betydningen: Eten dannes under hele vekstprosessen og akkumuleres foran hindringer der det er en vekst i tykkelse og dermed en større utvikling av kraft gjennom rotspissen.
Den andre funksjonen til eten er knyttet til ulike aldringsprosesser i anlegget. Dette inkluderer modning av frukt og utvikling av blomster så vel som utgytelse av blader ( abscission ) eller død av plantedeler ( senescence ). Viktig for disse funksjonene er den skredlignende økningen i tilgjengelig mengde eten, som oppstår fordi syntesen av eten aktiveres av dets tilstedeværelse. På denne måten modnes en frukt alle steder samtidig. Effekten av modning av frukt brukes i landbruket for senere å få umodne høstede frukter til metabolske prosesser som gjør at fruktene kan modnes.
Siden midten av 1990-tallet har spesifikke genetiske modifikasjoner blitt brukt til å produsere tomater som er spesielt holdbare ( Flavr-Savr-tomater ). Genet som er ansvarlig for produksjon av eten er slått av. Disse tomatene kan deretter gasses med eten etter behov og derved gjøres modne. Ofte blir ikke frukt med vilje brakt til modning, deretter transportert, og bare modnet på destinasjonen ved hjelp av eten. Umodne tomater kan gjøres modne ved å tilsette noen få modne tomater. Disse skiller ut eten og modner dermed de umodne tomatene.
Eten er også viktig som et "alarmstoff" ved skadedyrangrep på planten og ved sår. Sammen med andre stoffer så som salicylsyre og jasmonate , avgrenser eten det berørte området og gir plantegiftstoff . Som en gass virker eten på nabodelen av planter eller planter og setter alarmkaskaden i bevegelse der. Akasier kommuniserer fare gjennom utskillelse av eten til nærliggende akasier når de beites av antiloper eller sjiraffer, som en undersøkelse av Sylvia Hughes viser.
Som med andre fytohormoner har det blitt gjort svært lite forskning om etens virkningsmekanisme. Det antas at eten virker på spesifikke reseptormolekyler (etenreseptor ETR) på cellemembranene , som initierer en kaskade av effekter i cellen . Spesielt er dette inaktivering av serin / treoninkinase CTR1. Signalet sendes videre til forskjellige cellekjerner - proteiner (IN3 / EIL -proteiner) som transkripsjonsfaktorer i genuttrykkseffekt og dermed aktiveres visse gener . Det første kjente målgenet for disse proteinene er beskrevet som etenresponsfaktor 1 (ERF1). Denne faktoren styrer igjen flere gener, slik at når eten virker på dette systemet, utløses alltid en hel rekke genetiske aktiviteter. Under modning av frukt må for eksempel forskjellige enzymer dannes for å myke opp celleveggen, mens aldring involverer dannelse av kitin og cellulose-nedbrytende enzymer ( kitinaser , cellulaser ). Repertoaret for plantestress , dvs. reaksjonen på skadedyr og sår utløst av eten, er veldig omfattende . I denne situasjonen produseres blant annet kitinaser (som et forsvar mot insekter ), glukanaser , proteinasehemmere (hemmere for proteinnedbrytende enzymer, mot sopp) og mange andre antistoffer.
Syntesen av eten i planten er basert på aminosyren metionin . Dette frembringer i et første skritt ved kobling til adenosin av S-adenosylmethionin (SAM). ACC- oksidasen frigjør eten fra sekundærproduktet 1-aminocyklopropankarboksylsyre (ACC) . Dannelsen av oksidasen stimuleres av eten selv, som i likhet med en kjedereaksjon i naboceller fremmer etendannelse.
farer
Ethene brenner i luften med en lett sotet, glødende flamme. Ethene er ekstremt brannfarlig. Etenbeholdere må oppbevares på et godt ventilert sted. Den må holdes borte fra antennelseskilder, og det må treffes tiltak for å forhindre elektrostatisk lading. I luftfraksjoner på 3 til 36 volumprosent danner det eksplosive blandinger. Eten har en narkotisk effekt i høye konsentrasjoner.
bevis
Dobbeltbindingen av eten kan påvises ved hjelp av bromvann , siden reaksjonen av de to stoffene forbruker brom til dannelse av 1,2-dibrometan og det brune bromvannet blir misfarget som et resultat.
litteratur
- Klaus Lürssen: Plantehormonet etylen. Biosyntese, effekter på planter og mulige bruksområder. I: Kjemi i vår tid . 15. år, nr. 4, 1981, s. 122-129, doi: 10.1002 / ciuz.19810150405 .
- Claus-Jürgen Estler: Farmakologi og toksikologi . Schattauer, Stuttgart 1992, 2000, ISBN 3-7945-1898-5 .
- Gerhard Luft: Høytrykkspolymerisering av etylen. I: Kjemi i vår tid . 34. Jg., Nr. 3, 2000, s. 190-199, doi : 10.1002 / 1521-3781 (200006) 34: 3 <190 :: AID-CIUZ190> 3.0.CO; 2-V .
weblenker
- Oppføring på eten . I: P. J. Linstrom, W. G. Mallard (red.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69 . National Institute of Standards and Technology , Gaithersburg MD
Individuelle bevis
- ↑ en b c d e f g h Entry på eten i GESTIS substans databasen av den IFA , åpnes 1. februar 2016. (JavaScript kreves)
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, s. 6-188.
- ↑ Entry på etylen i den klassifisering og merking Opptelling av den europeiske kjemikaliebyrået (ECHA), åpnes den 1. februar, 2016. produsenter eller distributører kan utvide den harmoniserte klassifisering og merking .
- ^ Swiss Accident Insurance Fund (Suva): Grenseverdier-nåværende MAK- og BAT-verdier (søk etter 74-85-1 eller eten ), åpnet 2. november 2015.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Standard termodynamiske egenskaper for kjemiske stoffer, s. 5-22.
- ^ Sycomore Fig (Html -versjon) ( Memento fra 8. januar 2012 i Internettarkivet ) , PDF -versjon (593 kB) fra 30. mai 2009.
- ^ Winfried R. Pötsch, Annelore Fischer og Wolfgang Müller i samarbeid med Heinz Cassebaum : Lexikon av viktige kjemikere . Bibliographisches Institut, Leipzig 1988, ISBN 3-323-00185-0 , s. 33-34.
- ↑ Vedlegg, §VIII, s. 474 ff., Eksperimenter og observasjoner knyttet til de forskjellige grenene av naturfilosofien: med en fortsettelse av observasjonene om luften , Joseph Priestley, London: trykt for J. Johnson, 1779, bind 1.
- ^ Seth C. Rasmussen: Acetylen og dets polymerer. 150+ års historie. Springer, ISBN 978-3-319-95488-2 , s. 9 f. ( Begrenset forhåndsvisning i Google- boksøk ).
- ^ Oppføring på dikloretan. I: Römpp Online . Georg Thieme Verlag, åpnet 12. juni 2014.
- ^ A b Pieter Imhof (red.), Jan Cornelis van der Waal (red.): Katalytisk prosessutvikling for fornybare materialer. Wiley-VCH Verlag, 2013, ISBN 978-3-527-33169-7 , s. 25-27.
- ↑ Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie . 2. utgave. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Tyskland 2013, ISBN 978-3-527-33072-0 , s. 551 .
- ↑ Oliver Konze: Pipeline fylt i to uker. Melding i Donaukurier fra 13. september 2012.
- ↑ https://bauforumstahl.de/upload/documents/brandschutz/kennwerte/Heizwertstoffe.pdf
- ↑ WH Keesom, KW Taconis: Et røntgenbilde goniometer for undersøkelse av krystallstrukturen av størknet gass. I: Physica. 2, 1935, s. 463, doi: 10.1016 / S0031-8914 (35) 90116-1 .
- ^ Karl Ziegler - Konsekvenser og utvikling av en oppfinnelse. (PDF; 633 kB) Hentet 29. mai 2013 .
- ↑ Heike Kloppenburg, Thomas Gross, Martin Mezger, Claus Wrana: Det elastiske århundret. Syntetisk gummi. I: Kjemi i vår tid. 43, 2009, s. 392-406, doi: 10.1002 / ciuz.200600515 .
- ^ Richard A. Love, Thomas F. Koetzle, Graheme JB Williams, Lawrence C. Andrews, Robert. Konstruksjon: Nøytrondiffraksjonsstudie av strukturen til Zeises salt, KPtCl3 (C2H4). H2O. I: Uorganisk kjemi. 14, 1975, s. 2653, doi: 10.1021 / ic50153a012 .
- ↑ Etylen markedet studie av Ceresana Forskning, desember 2010
- ^ Sylvia Hughes: Antilope aktiverer akasiens alarmsystem. Hentet 9. juni 2015 .
- ↑ a b Schopfer, Peter. Brennicke, Axel. Mohr, Hans.: Plantefysiologi . Spectrum Academic Publishing House, 2010, ISBN 978-3-8274-2351-1 .







![{\ displaystyle n \ \ mathrm {CH_ {2} {=} CH_ {2} \ longrightarrow [-CH_ {2} {-} CH_ {2}-]} _ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c5b6af3a6389e162b9365b78de1f79c8eb6735)





![\ mathrm {[PdCl_ {4}] ^ {2 -} + C_ {2} H_ {4} + H_ {2} O \ høyre pil CH_ {3} CHO + Pd + 2 \ HCl + 2 \ Cl ^ { -} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/84f36753ba6922fdba1d1d36fe0f86d94c664f66)
![\ mathrm {Pd + 2 \ CuCl_ {2} +2 \ Cl ^ { -} \ høyre pil [PdCl_ {4}] ^ {2 -} + 2 \ CuCl}](https://wikimedia.org/api/rest_v1/media/math/render/svg/572ed0fdcaf257aec043465677973e1a9651b67c)




