Biopterin
| Strukturell formel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
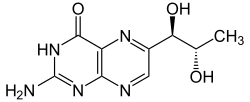
| ||||||||||||||||
| Strukturformel av L - erytro- biopterin | ||||||||||||||||
| Generell | ||||||||||||||||
| Etternavn | Biopterin | |||||||||||||||
| andre navn |
|
|||||||||||||||
| Molekylær formel | C 9 H 11 N 5 O 3 | |||||||||||||||
| Kort beskrivelse |
blekgule krystaller |
|||||||||||||||
| Eksterne identifikatorer / databaser | ||||||||||||||||
| ||||||||||||||||
| eiendommer | ||||||||||||||||
| Molarmasse | 237,22 g mol −1 | |||||||||||||||
| Smeltepunkt |
|
|||||||||||||||
| sikkerhetsinstruksjoner | ||||||||||||||||
| ||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . | ||||||||||||||||
Biopterin er en heterosyklisk forbindelse nyttig som redoks - kofaktor i metabolismen er viktig. Den viktigste strukturelle funksjonen er et heterosyklisk pteridinringsystem , noe som gjør det til et derivat av pterin .
Biokjemisk dannes biopterin ved oksidasjon av tetrahydrobiopterin med GTP .
historie
Forbindelsen ble oppdaget i forskjellige kilder av fire forskergrupper på 1950-tallet. I USA isolerte en arbeidsgruppe fra Lederle Laboratories, en avdeling av American Cyanamid Company, omtrent 20 milligram av et stoff fra 4000 liter human urin ved adsorpsjon på aktivt karbon , motstrømsfordeling og kromatografi , som i en biologisk test fremmet vekst av protozoal Crithidia fasciculata . E. L. Patterson kalte henne biopterin og hentet strukturformelen fra nedbrytningseksperimenter.
Uavhengig av dette rapporterte HS Forrest og HK Mitchell fra California Institute of Technology (Pasadena) samme år at de hadde isolert stoffet, sammen med andre pteridiner, fra fruktflua Drosophila melanogaster (vill type). De kom med det samme strukturelle forslaget.
Ved Chemical Institute ved Universitetet i Zürich oppdaget Max Viscontini og kollegaer stoffet ( kalt BH 2 der) også i Drosophila melanogaster .
Til slutt, ved Max Planck-instituttet i München, fant Adolf Butenandt og Heinz Rembold biopterin i dronningens cellefor ( kongelig gelé ) av honningbien ( Apis mellifica ).
I perioden som fulgte ble biopterin funnet i mange organismer; forekomsten er allestedsnærværende, noe som er forståelig fra dens biokjemiske funksjon (se nedenfor).
eiendommer
Biopterin danner små, gule krystaller med en sfærisk vane som forkulles ved oppvarming til 250 til 280 ° C uten smelting. De er lite oppløselige i vann, men bedre både i fortynnet saltsyre og i fortynnet natriumhydroksydoppløsning. Løsningene fluorescerer i UV-lys. I polarimeteret får de planet til polarisert lys til å dreie mot venstre, og viser dermed optisk aktivitet .
Isomerisme
Molekylet er kiralt; de to karbonatomer i sidekjeden med HO-restene er sentre for chiralitet. I dette tilfellet er fire stereoisomerer mulig: RR , SS , RS , SR i henhold til Cahn-Ingold-Prelog-konvensjonen . Disse kan også defineres som to par diastereomerer som har erytro- eller treo- konfigurasjon, analogt med karbohydratene erytrose og treose . Naturlig forekommende biopterin ( L - erytro- biopterin) har (1 R , 2 S ) konfigurasjon. Ytterligere isomerer er:
- (1 S , 2 S ) - eller L - treo- biopterin eller orinapterin
- (1 R , 2 R ) - eller D - treo- biopterin eller dictyopterin
- (1 S , 2 R ) - eller D - erytro- biopterin
Synteser
Den lille mengden biopterin av naturlig opprinnelse tillot ikke oppdagerne på det tidspunktet å bestemme konfigurasjonen av den isolerte forbindelsen. For å avklare måtte biopterin derfor syntetiseres fra en byggestein i det chirale bassenget , hvis konfigurasjon var bestemt. Dette ble funnet i klassen karbohydrater (monosakkarider). Patterson et al. pterinet fra L - rhamnose eller det kjemisk modifiserte L - arabinosederivatet 5- deoksy - L- arabinofuranosid og 2,4,5-triamino-3,4-dihydropyrimidin-4-on (ofte etter dets tautomer 2,4,5 - Triamino-4-hydroksypyrimidin eller bedre kjent som 2,4,5-triaminopyrimidin-4-ol). L- arabinose har erytro- konfigurasjon ved karbonatomer C-3 og C-4 , som følgelig også måtte være til stede i derivatet og til slutt i sidekjeden til biopterin (C-1 ', C-2'). Konfigurasjonen er 1′S, 2′R ( erythro ).

reaksjon av 2,4,5-triamino-3,4-dihydropyrimidin-4-on med 5- deoksy - L- arabinofuranosid. Det første trinnet i reaksjonen er utvilsomt dannelsen av et N - glykosid og azometin (Schiffs base, imin ). Siden disse kan dannes både med aminogruppene ved C-4 og ved C-5, blir posisjonsisomerer dannet; bare en er vist på bildet. De neste trinnene som innebærer dehydrering er uklare; en Amadori-omlegging har blitt diskutert.
Imidlertid, siden denne kondensasjonsreaksjonen ikke var selektiv og ga et dårlig utbytte, ble ytterligere synteser utviklet. Fra D - xylose og det var D threo diastereomer oppnådd som ingen vekstfremmende effekt på Crithidia fasciculata viste. Viscontini og kolleger optimaliserte syntesen fra 5- deoksy - L- arabinofuranosid i flere verk. En ny vei fra L - vinsyre ble senere funnet for dette viktige mellomproduktet . Også D - ribose kan brukes som utgangsmateriale. Ytterligere synteser siteres på.
Biologisk betydning
Biopterin - nærmere bestemt de redoks-par 7,8-dihydrobiopterin / 5,6,7,8-tetrahydrobiopterin (den sistnevnte også forkortet til BH 4 ) - spiller en viktig rolle som en kofaktor i metabolismen. I motsetning til pteridinderivatene folsyre og riboflavin , kan det imidlertid syntetiseres av menneskekroppen selv og er derfor ikke viktig . Bare tetrahydroformen til biopterin er biologisk aktiv.
Biopteridin- redoks-systemet er av særlig betydning i oksidasjonen av aromatiske ringer . Slik oksidasjon finner sted f.eks. B. i biosyntese av aminosyren tyrosin fra fenylalanin med fenylalaninhydroksylase , i syntesen av katekolaminer i trinnet med oksidasjon av tyrosin til L- DOPA av tyrosinhydroksylase eller i serotoninbiosyntese i trinnet med oksidasjon av den tryptofan til 5-hydroxytryptophan av tryptofanhydroksylase stedet. Et spesielt trekk ved disse oksidasjonene er at de krever tilstedeværelse av molekylært oksygen (se også figuren nederst).
Forstyrrelser i biopterinmetabolismen fører blant annet til viktigheten for metabolismen av aromatiske aminosyrer. til såkalte "atypiske" fenylketonuri .
Den nitrogenoksid syntase (NOS), som gjennom flere stadier arginin til nitrogenoksid (NO) og citrullin oksydert og alkylglycerol monooksygenase (AGMO), den eterlipider deler, også tetrahydrobiopterinabhängig.
Dihydrobiopterin / tetrahydrobiopterin redoks-systemet er relativt komplekst - vurder for eksempel redoks-systemene til kofaktorene NAD eller FAD . Et dedikert enzymsystem sørger for regenerering av oksidert form fra redusert form: pterin-4a-karbinolamin dehydratase ( EC 4.2.1.96 ) og dihydropteridin reduktase ( EC 1.5.1.34 ). Følgende figur symboliserer tilhørende syklus:

weblenker
Individuelle bevis
- ↑ a b c Oppføring på Biopterin. I: Römpp Online . Georg Thieme Verlag, åpnet 5. desember 2011.
- ↑ a b Dataark 6-Biopterin fra Sigma-Aldrich , åpnet 8. november 2016 ( PDF ).
- ^ Oppføring på pteridiner. I: Römpp Online . Georg Thieme Verlag, åpnet 24. mai 2014.
- ↑ EL Patterson, HP Broquist, Alberta M. Albrecht, MH av Saltza, ELR Stokstad: En ny pteridines i urin er nødvendige for veksten av den protozo Crithidia fasciculata . I: J. Amer. Chem. Soc. , 77, 1955, s. 3167-3168, doi: 10.1021 / ja01616a096 .
- ↑ a b E. L. Patterson, MH von Saltza, ELR Stokstad: The Isolation and Characterization of a Pteridine Required for the Growth of Crithidia fasciculata . I: J. Amer. Chem. Soc. , 78, 1956, s. 5871-5873, doi: 10.1021 / ja01603a044 .
- ↑ HS Forrest, HK Mitchell. I: J. Amer. Chem. Soc. , 77, 1955, s. 4865.
- ↑ M. Viscontini, E. Loeser, P. Karrer, E. Hadorn: Fluorescerende stoffer fra Drosophila melanogaster . I: Helv. Chim. Acta , 38, 1955, s. 2034-2035, doi: 10.1002 / hlca.19550380744 .
- ↑ M. Viscontini, E. Loeser, P. Karrer: Fluorescerende stoffer fra Drosophila melanogaster. Isolering og egenskaper av pteridin HB 2 . I: Helv. Chim. Acta , 41, 1958, s. 440-446, doi: 10.1002 / hlca.660410215 .
- ↑ A. Butenandt, H. Rembold: [The royal gelé av honningbie. II Isolering av 2-amino-4-hydroksy-6- (1,2-dihydroksypropyl) pteridin]. I: Hoppe-Seylers journal for fysiologisk kjemi. Volum 311, nummer 1-3, 1958, s. 79-83, ISSN 0018-4888 . PMID 13548912 , doi: 10.1515 / bchm2.1958.311.1.79 .
- ↑ Eksterne identifikatorer eller databasekoblinger for L-threo-biopterin : CAS-nummer: 13039-82-2 , PubChem : 135738580 , ChemSpider : 13628150 , Wikidata : Q27144825 .
- ↑ Eksterne identifikatorer eller databasekoblinger til D-threo-Biopterin : CAS-nummer: 13019-52-8 , PubChem : 135909519 , Wikidata : Q57742483 .
- ↑ Eksterne identifikatorer eller databasekoblinger til D-erythro-Biopterin : CAS-nummer: 13039-62-8 , PubChem : 135449517 , DrugBank : DB03886 , Wikidata : Q41793745 .
- ↑ M. Viscontini, H. Raschig. I: Helv. Chim. Acta , 41, 1958, s. 108.
- Vis M. Viscontini, R. Provenzale. I: Helv. Chim. Acta , 52, 1969, s. 1225.
- ↑ B. Schircks, JH Bieri, M. Viscontini. I: Helv. Chim. Acta , 68, 1985, s. 1639. Der er ytterligere synteser av Zürich-gruppen gitt.
- ^ A b Anne-Marie Fernandez, Lucette Duhamel: Total syntese av L- Biopterin fra L- vinsyre via 5- deoksy- L- arabinose . I: J. Org. Chem. , 61, 1996, s. 8698-8700, doi: 10.1021 / jo961426s .
- ↑ K. Mori, H. Kikuchi. I: Liebigs Ann. Chem. , 1989, s. 1267.
- ^ ER Werner, N. Blau, B. Thöny: Tetrahydrobiopterin: biokjemi og patofysiologi. I: The Biochemical journal. Volum 438, nummer 3, september 2011, s. 397-414, ISSN 1470-8728 . doi: 10.1042 / BJ20110293 . PMID 21867484 . (Anmeldelse).

