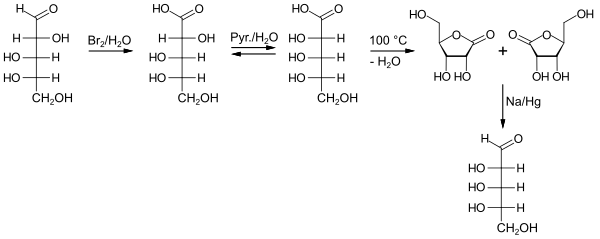
Ribose
| Strukturell formel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Fischer projeksjon , åpen kjede representasjon | ||||||||||
| Generell | ||||||||||
| Etternavn | Ribose | |||||||||
| andre navn |
|
|||||||||
| Molekylær formel | C 5 H 10 O 5 | |||||||||
| Kort beskrivelse |
fargeløst fast stoff |
|||||||||
| Eksterne identifikatorer / databaser | ||||||||||
| ||||||||||
| eiendommer | ||||||||||
| Molarmasse | 150,13 g mol −1 | |||||||||
| Fysisk tilstand |
fast |
|||||||||
| tetthet |
0,80 g cm −3 (20 ° C) |
|||||||||
| Smeltepunkt |
90-95 ° C |
|||||||||
| løselighet |
løselig i vann |
|||||||||
| sikkerhetsinstruksjoner | ||||||||||
| ||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . | ||||||||||
Ribose er et sukker med fem karbonatomer, en pentose , og forekommer ofte i naturen som D- ribose, mens den enantiomere L- ribose er av liten betydning.
D- ribose er en del av byggesteinene til ribonukleinsyre (RNA). I nukleosidene er ribosen koblet til en nukleobase via C1-atomet , for eksempel i adenosin , cytidin , guanosin , uridin og ribotymidin . De tilsvarende nukleotider er dannet av ytterligere fosforylering av den hydroksylgruppe (-OH) på C5-atomet . Ryggraden ( ryggraden ) i et RNA- makromolekyl som danner de sammenorganiserte riboseenhetene via organofosfat .
"Ribose" betyr vanligvis D- ribose. D - deoksyribose i deoksyribonukleinsyre (DNA) skiller seg bare fra dette ved C2-atomet på grunn av et manglende oksygenatom . Ribose kan også syntetiseres fra andre monosakkarider i den menneskelige organismen via pentosefosfat-syklusen .
Etymologi og isolasjon
Den fremtredende kjemikeren Emil Fischer anerkjente at i tillegg til karbohydratene xylose og arabinose , som består av fem karbonatomer, må det være en annen isomer ( epimer ), som han kalte ribose. Dette er et kunstig navn, kombinert fra omvendte bokstaver med navnet Arabinose. Forskeren Phoebus Levene , som kom fra USA til Fischers Berlin-institutt, satte kursen mot en vei inn i fremtiden, som han ikke kunne forutse på den tiden: han hydrolyserte "gjærnukleinsyre" fra bakergjær og fikk en ribose med en D- , D- , D- konfigurasjon. Resultatet ble beskrevet i rapportene fra German Chemical Society i 1909 .
Ytterligere studier av Levene og WA Jacobs viste at sukkerribosen er bundet til heterosykliske baser, f.eks. B. adenin, var bundet, d. H. var til stede som et nukleosid. Som beskrevet ovenfor er fosfatgrupper (nukleotider) bundet til nukleosidene.
Imidlertid var Levenes prosess for dyr til å produsere store mengder ribose. Hellmut Bredereck utviklet forbedrede metoder ved å bruke et enzym fra søte mandler til hydrolyse. På denne måten kan reaksjonstemperaturen senkes.
Synteser
Midlertidig før D- ribosen var av Oskar Piloty ved delvis syntese , med utgangspunkt i gruppen bestående av arabisk gummi, oppnåelig ved hydrolyse av L- arabinose først (1891), L oppnådd -ribose. For dette formål ble aldehydgruppen av aldosen oksyderes til karboksylsyren ( L -arabonic syre, L -arabic syre) med bromvann . Etter oppvarming med den svake basen pyridin i vandig løsning skjedde epimerisering ved C2-atomet, dvs. H. i likevekt med L- arboksylsyre, ble L- ribonsyre dannet. Dette ble skilt av og syklet til lakton , som i det siste trinnet ble redusert til L- ribose ved bruk av natriumamalgam . Willem Alberda van Ekenstein og Jan Johannes Blanksma forbedret rensingen av L- ribose etter reduksjon med natriumamalgam. Etter at D- arabinose også hadde blitt tilgjengelig gjennom nedbrytning av billig D- glukose, produserte van Ekenstein og Blanksma også D- ribose ved hjelp av Fischer-Piloty-metoden.
Fischer-projeksjonsformlene som ble brukt på tidspunktet for oppklaring av disse karbohydratene, gir ikke noe inntrykk av den romlige strukturen. Derfor er perspektiv skjelettformler av laktonene inkludert.
I 1898 publiserte Otto Ruff en andre metode for å konvertere D - glukonsyre til D - arabinose ( Ruff-nedbrytning ). Kalsiumsaltet av karboksylsyren (kalsium D- glukonat) ble oksidativt dekarboksylert med hydrogenperoksyd i nærvær av jernsalter.
En viktig forbedring i syntesen av D- epimeren var den elektrokjemiske oksidasjonen av D- arabinosen ved anoden, hvor kalsiumkarbonat ble tilsatt. Den D -arboxylic syren kan bli isolert som kalsiumsaltet og bearbeides ytterligere.
Paul Karrer og medarbeidere brukte disse reaksjonstrinnene for en syntese av laktoflavin .
Mer nylig har den "unaturlige" L- ribosen også kommet tilbake i fokus; Derivater med denne pentosen kan være av interesse for utvikling av aktive farmasøytiske ingredienser. For eksempel kan L- ribose produseres fra L- arabinose gjennom bioteknologi (sammenlign med Pilotys syntese, se ovenfor).
eiendommer
Ribose er et fargeløst fast stoff med et smeltepunkt på 90–95 ° C og er løselig i vann.
Konstitusjonen og strukturene til D- ribose hadde blitt arbeidet hardt ut. En krystallstrukturanalyse av forbindelsen ble først rapportert i 2010. Røntgendiffraksjon og NMR-spektroskopiske eksperimenter kom til at molekylene i krystallinsk D-ribose danner en hemiacetal og er til stede som en seksleddet ring i en pyranoseform . Det er to isomere former, α- D- ribopyranose og β- D- ribopyranose, som er inneholdt i krystallen i forskjellige proporsjoner.
Ved oppløsning i vann beholder ribose delvis pyranosestrukturen; i tillegg, som det lenge har vært kjent, dannes fem ringer i en kjemisk likevekt, dvs. H. Furanoser dannet. I begge tilfeller er α- og β- anomere former mulig.
Ved 31 ° C, 58,5% av den D- ribose-molekylet er i p- D -pyranoids, 21,5% i den α- D -pyranoids, og 13,5% i β- D -furanoids, 6,5% i α- D furanoide og 0,05% i åpen kjedeform. Β-pyranose-formen er derfor mest vanlig i vandig løsning, siden tre av de fire hydroksylgruppene er lokalisert i ekvatorialplanet.
| D -Ribose stavemåter | ||
|---|---|---|
| Kileformel | Haworth notasjon | |

|
 α- D- ribofuranose |
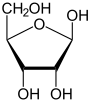 β- D- ribofuranose |
 α- D- ribopyranose |
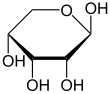 β- D- ribopyranose |
|
Biologisk betydning og biosyntese

D- ribose, forestret med fosforsyre ved C5-OH, er et medlem av karbohydratmetabolismen som ribose-5-fosfat . Dens biosyntese forekommer på flere måter. En forløper som er ribulose-5-fosfat , en annen er glyceraldehyd-3-fosfat , som er utvidet med en C- 2- fragmentet i en transketolase reaksjon for å danne C- 5 sukker-fosfat.
Ribose er en byggestein av nukleosider og nukleotider . Ribosylnukleosidfosfater spiller en viktig rolle i metabolismen av celler, for eksempel som biologiske energibærere som adenosindifosfat (ADP) og adenosintrifosfat (ATP). Effekten av hormonelle og nervøse signaler i cellen kan forbedres med syklisk adenosinmonofosfat (cAMP), som fungerer som en sekundær messenger-substans .
Interstellar forekomst
Ribose ble oppdaget i meteoritter i 2019. Siden dette karbohydratet er viktig for livet på jorden, reiser dette funnet igjen spørsmålet om kjemisk evolusjon , dvs. H. hvordan det prebiotiske "livet" utviklet seg på planeten vår.
bevis
Ribose kan påvises med Bial-reagenset (en løsning av orcin og jern (III) klorid i konsentrert saltsyre ). Testen er positiv hvis en grønnblå farge endres etter tilsetning av Bial-reagens til karbohydratet og etter oppvarming.
weblenker
Individuelle bevis
- ↑ a b c d e f Oppføring for CAS-nr. 50-69-1 i GESTIS stoffdatabase til IFA , åpnet 11. september 2014. (JavaScript kreves)
- ^ PA Levene, WA Jacobs. Rapporter fra German Chemical Society, vol. 1909, vol. 42, 1201.
- ↑ Hellmut Bredereck: Representasjon av nukleosider ved enzymatisk hydrolyse av gjær-nukleinsyre; samtidig et bidrag til representasjonen av d-ribose. I: Rapporter fra German Chemical Society. Født 1938, bind 71, 408. https://doi.org/10.1002/cber.19380710237
- ↑ Hellmut Bredereck, Martin Köthnig, Eva Berger: About d-Ribose (representation of a crystallized anhydroribose) , In: Reports of the German Chemical Society. 1940, bind 73, 956. https://doi.org/10.1002/cber.19400730906
- ^ W. Alberda van Ekenstein, J. Blanksma: Om krystallisert l-ribose. I: Chemisch Weekblad Vol. 6, s. 373-375. Basert på presentasjonen av Henle i Chemisches Zentralblatt Jg. 1908, Vol. 2, s. 1584. https://delibra.bg.polsl.pl/dlibra/publication/38191/edition/34381/content?ref=struct , tilgjengelig 19. oktober 2020.
- ^ W. Alberda van Ekenstein, J. Blanksma: Om d-Ribose. I: Chemisch Weekblad Vol. 10, s. 664. Basert på rapporten fra Schönfeld i Chemisches Zentralblatt Jg. 1913, Vol. 2, s. 1562. https://delibra.bg.polsl.pl/dlibra/publication/18297 / utgave / 17223 / content? ref = struct , åpnet 19. oktober 2020.
- ↑ Otto Ruff: Om transformasjonen av d-glukonsyre til d-arabinose , I: Reports of the German Chemical Society, Jg. 1898, Vol. 31, s. 1573. https://doi.org/10.1002/cber. 18980310250
- ^ Marguerite Steiger, Helvetica chimica Acta. Vol. 19, s. 189. I hennes digitaliserte avhandling som er tilgjengelig på Internett, er eksperimentelle detaljer beskrevet i detalj. https://www.research-collection.ethz.ch/bitstream/handle/20.500.11850/133644/1/eth-20781-01.pdf
- ↑ Paul Karrer, B. Becker, F. Benz, P. Frei, H. Salomon, K. Schopp, om syntesen av laktoflaviner . I: Helvetica Chimica Acta. Født 1935, bind 18, s. 1435-1448. DOI: 10.1002 / hlca.193501801196
- ↑ M. Helanto, K. Kiviharju, T. Granström, M. Leisola, A. Nyyssölä: Bioteknologisk produksjon av l-ribose fra l-arabinose . I: Applied Microbiology and Biotechnology Vol. 2009, Vol. 83, s. 77-83.
- ↑ Dubravka Sisak, LB McCusker, G. Zandomeneghi, BH Meier, D. blåser, R. Boese, WB Schweizer, R. Gylmour, JD Dunitz. Bedre sent enn aldri! Furanoseformen av D- ribose, som dukker opp i utallige biomolekyler, forekommer ikke i den krystallinske forbindelsen . I: Angewandte Chemie, bind 2010, bind 122, 4605; Angewandte Chemie International Edition, Vol. 2010, Vol. 49, 4503. https://doi.org/10.1002/anie.201001266
- ↑ Stephen J. Angyal: Sammensetningen av å redusere sukker i løsning. I: Fremskritt innen karbohydratkjemi og biokjemi . 1984, bind 42, s. 15-68, doi : 10.1016 / S0065-2318 (08) 60122-5 .
- ↑ Peter Karlson et al., Kort lærebok om biokjemi for medisinske og naturvitenskapelige forskere, 13. utgave, 1988, s. 218-230, Thieme, Stuttgart, New York.
- ↑ Yoshihiro Furukawa, Yoshito Chikaraishi, Naohiko Ohkouchi, O. Ogawa, Daniel P. Glavin, Jason P. Dworkin, Chiaki Abe, Tomoki Nakamura: Extraterrestrial ribose and other sugars in primitive meteorites, In: PNAS Vol. 2019, Vol. 116, Pp. 24440-24445; https://www.pnas.org/content/116/49/24440