Ribonukleotidreduktase
| Ribonukleotiddifosfatreduktase, stor underenhet | ||
|---|---|---|
|
Eksisterende strukturelle data : 2WGH , 3HNC , 3HND , 3HNE , 3HNF | ||
| Egenskaper av humant protein | ||
| Masse / lengde primærstruktur | 792 aminosyrer | |
| Sekundær til kvartær struktur | Heterodimer | |
| Identifikator | ||
| Gennavn | RRM1 R1; RIR1; RR1 | |
| Eksterne ID-er | ||
| Enzymklassifisering | ||
| EC, kategori | 1.17.4.1 , oksidoreduktase | |
| Svarstype | Reduksjon av en hydroksylgruppe | |
| Underlag | Ribonukleotid difosfat + tioredoksin | |
| Produkter | Deoksyribonukleotid difosfat + tioredoksin Disulfide + H 2 O | |
| Hendelse | ||
| Parent taxon | skapning | |
| Unntak | Archaea | |
| Ortolog | ||
| menneskelig | Husmus | |
| Entrez | 6240 | 20133 |
| Ensemble | ENSG00000167325 | ENSMUSG00000030978 |
| UniProt | P23921 | P07742 |
| Refseq (mRNA) | NM_001033 | NM_009103 |
| Refseq (protein) | NP_001024 | NP_033129 |
| Gen locus | Chr 11: 4,09 - 4,14 Mb | Chr 7: 102,44 - 102,47 Mb |
| PubMed- søk | 6240 |
20133
|
| Ribonukleotiddifosfatreduktase, liten underenhet | ||
|---|---|---|

| ||
| Båndmodell av dimeren til R2-underenheten til klasse I RNR av Escherichia coli , i henhold til FBB 1AV8 | ||
|
Eksisterende strukturelle data : 2UW2 , 3OLJ , 3VPM , 3VPN , 3VPO | ||
| Egenskaper av humant protein | ||
| Masse / lengde primærstruktur | 389 aminosyrer | |
| Sekundær til kvartær struktur | Heterodimer | |
| Kofaktor | 2 Fe 2+ | |
| Identifikator | ||
| Gennavn | RRM2 R2; RR2; RR2M | |
| Eksterne ID-er | ||
| Enzymklassifisering | ||
| EC, kategori | 1.17.4.1 , oksidoreduktase | |
| Svarstype | Reduksjon av en hydroksylgruppe | |
| Underlag | Ribonukleotid difosfat + tioredoksin | |
| Produkter | Deoksyribonukleotid difosfat + tioredoksin Disulfide + H 2 O | |
| Hendelse | ||
| Homologi familie | RNR-underenhet M2 | |
| Parent taxon | Euteleostomi | |
| Ortolog | ||
| menneskelig | Husmus | |
| Entrez | 6241 | 20135 |
| Ensemble | ENSG00000171848 | ENSMUSG00000020649 |
| UniProt | P31350 | P11157 |
| Refseq (mRNA) | NM_001034 | NM_009104 |
| Refseq (protein) | NP_001025 | NP_033130 |
| Gen locus | Chr 2: 10.12-10.13 Mb | Chr 12: 24,71 - 24,71 Mb |
| PubMed- søk | 6241 |
20135
|
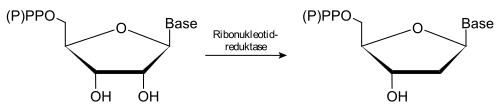
Den ribonukleotidreduktase (ofte kalt RNR er forkortet) et enzym som er det siste ledd i kjeden av syntesen av de DNA- byggestenene ( deoksynukleotider former). Det reduserer , dvs. H. fjerner hydroksylgruppen på karbonatom C-2 'av ribosedelen av nukleotidene. Substrater av enzymet er ribonukleotidfosfater, f.eks. B. adenosindifosfat og cytidindifosfat , i forbindelse med kofaktoren tioredoksin .
Betydning og forekomst
Ribonukleotidreduktase er et uunnværlig enzym i organismen for å produsere DNA-byggesteiner. Det har blitt funnet i nesten alle eukaryote organismer, fra gjær og alger til planter, pattedyr og mennesker. Noen procarionts og virus inneholder også RNA-enzymer.
Siden enzymet reduserer 2'-hydroksygruppen i nukleotidene, kan det også sees på som en kobling mellom DNA- og RNA- verdenen. I denne sammenheng spekuleres det også i om RNR var enzymet som banet vei fra en primitiv RNA-verden til dagens DNA. (Se også: kjemisk evolusjon og ribozym )
Som mange enzymer katalyserer ribonukleotidreduktase også den tilsvarende omvendte reaksjonen ( oksidasjon av deoksynukleotid til nukleotid). Imidlertid spiller denne reaksjonen ingen rolle i biologiske prosesser.
Biologisk funksjon
Ribonukleotidreduktasen forvandler nukleotidene til deres respektive deoksynukleotider. Enzymet skiller ikke ut hvilket nukleotid det er ( adenosin , guanosin , cytidin eller tymidinfosfater ), både di- og de respektive trifosfater er redusert. Monofosfater og (fosfatfrie) nukleosider omdannes ikke.
Reduksjonen skjer antagelig gjennom en elektronoverføringsmekanisme der - som forklart nedenfor - dannes frie radikaler .
Det er flere klasser av ribonukleotidreduktase (klasse I til klasse III). Selv om alle klasser katalyserer den samme reaksjonen , er enzymene strukturelt veldig forskjellige. Klassene er delt inn etter måten systemet genererer det radikale. Hver klasse er delt inn i ytterligere underklasser; men for enkelhets skyld bør dette ikke gjennomføres.
Klasse I.
Klasse I ( EC 1.17.4.1 ) er typen enzym som forekommer hos mennesker og har blitt best studert. Enzymer er aerobe .
Klasse I-RNR består av to forskjellige underenheter: R1 og R2. R1 og R2 har en veldig lav affinitet , slik at enzymet sjelden er til stede som et samlet kompleks. Dette ser også ut til å være grunnen til at det aldri har vært mulig å krystallisere ribonukleotidreduktasen som en helhet .
R1 inneholder flere bindingssteder for effektorer , så vel som bindingslommen ( aktivt sted ) der nukleotidet er redusert. I R2 overføres en radikal til en tyrosinsidekjede , så å si 'lagret' der. Denne radikalen har en forbløffende lang halveringstid på rundt fire dager.
For det katalytiske trinnet må elektronet transporteres fra tyrosylradikalen i R2 til et cystein i R1. Avstanden anslås å være 35 Ångstrøm . Antagelig hopper elektronet over flere aminosyreenheter for å dekke den enorme avstanden (etter molekylære standarder).
Klasse II
Klasse II-RNR ( EC 1.17.4.2 ) forekommer blant andre i organismen Lactobacillus leichmannii . Her radikalet er generert in situ ved å bryte den kobolt - karbon -binding i koenzym B12 . Enzymer i denne klassen er fakultativt aerobe . Du kan jobbe både i nærvær og i fravær av oksygen.
Klasse III
Her overføres radikalen til en glykylsidekjede . Bakteriofag T4 fungerer for eksempel med denne enzymklassen. Klasse III RNR er anaerob , noe som betyr at de bare fungerer i et oksygenfritt miljø.
RNA-enzymene kunne ha utviklet seg fra en felles forfader. Av de anaerobt virkende klasse III-enzymene er Escherichia coli reduktase trolig det nærmeste det hypotetiske "primale enzymet".
Reduksjonsmekanisme
Den nøyaktige prosessen med nukleotidreduksjon er ennå ikke fullstendig belyst. Det er tydelig bevis på en radikal mekanisme, det sentrale trinnet er dannelsen av en tiylradikal, en svovelsentrert radikal. For å gjøre dette lagrer enzymet en stabil radikal som må transporteres inn i bindelommen ved hver omsetning . Etter den kjemiske reaksjonen gjenvinnes radikalen og transporteres tilbake til 'lagringsstedet'. Det antas at elektronen “hopper” over flere aminosyreenheter, som alle er forbundet med hydrogenbindinger .
Følgende diagram viser sekvensen med antatte mellomtrinn som den - fra og med 1998 - diskuteres i vitenskapen.
- Først en radikal overføres til 3 'posisjon på ribose (trinn fra første til andre bildet).
- Etter å ha delt vann i 2'-posisjonen (fig. 2 → 3), overføres radikalen til to cysteinkjeder av enzymet (fig. 3 → 4).
- Radikalen overføres deretter tilbake til det opprinnelige cystein via ribose (fig. 4 → 6).
Samlet sett, med oksidasjon av to cystein-sidekjeder, reduseres ribosen til deoksyribose. En DNA-byggestein ble produsert fra en RNA-komponent. Denne byggesteinen er nå klar til å bygges inn i DNA- dobbeltspiralen av DNA-polymerasen .
regulering
Siden RNA bare trenger å være aktiv i spesifikke faser av celledeling, er det mekanismer, som med de fleste enzymer, for å slå RNA av og på. I tillegg reguleres det i et komplisert system nøyaktig hvilken av de fire nukleotidene som skal reduseres. Aktivatorene og effektorene er bare kort oppført her, uten å gå i detalj:
Aktivatorer:
- ATP aktiverer enzymet
- dATP deaktiverer den
Effektorer:
- ATP og dATP → CDP / CTP og UDP / UTP reduseres
- dGTP → ADP / ATP
- dTTP → BNP / GTP
Oppdagelse av ribonukleotidreduktase
Siden DNA-strukturen ble belyst av James Watson og Francis Crick i 1953, oppstod spørsmålet om hvordan cellen produserer de enkelte byggesteinene for DNA-polymeren. Åtte år senere ble en enzymblanding isolert fra forskjellige celler for første gang, med høyt aktivitetsnivå for å redusere nukleotider til deres tilsvarende deoksynukleotider.
På 1990-tallet ble de tredimensjonale strukturene til de to underenhetene bestemt separat ved hjelp av krystallstrukturstudier . Spørsmål om mekanismen for forankring av de to underenhetene R1 og R2 til hverandre, transport av radikaler av enzymet over en relativt stor avstand og generering av radikalen under produksjonen av enzymet blir undersøkt.
RNR i kreftforskning og kreftterapi
Ribonukleotidreduktase er også fokus for kreftforskning . Fordi enzymet alltid er nødvendig når cellen deler seg eller trenger å reparere DNA-skade, er cellen avhengig av RNA for vekst. Enzymet er relativt sakte med en omsetningshastighet på ca. 10 s −1 . Dette er ikke et problem på grunn av langsom delingshastighet for normale celler, men kreftceller er hemmet fra rask vekst. Imidlertid er det kreftceller som øker omsetningshastigheten til RNA gjennom endringer. En aktiv ingrediens som blokkerer nøyaktig disse modifiserte enzymene, vil redusere eller til og med stoppe kreftveksten.
I mellomtiden har det blitt utviklet mange hemmere av RNR. For behandling av myeloid leukemi (spesielt når det er tegn på leukostase ) og andre myeloproliferative sykdommer som essensiell trombocytemi og polycytemia vera (rubra), brukes hydroksykarbamid (f.eks. Syrea®, Litalir®) som et kjemoterapeutisk middel.
litteratur
- BM Sjöberg: Ribonukleotidreduktaser - en gruppe enzymer med forskjellige metallositter og lignende reaksjonsmekanisme , I: PJ Sadler: Metal Sites in Proteins and Models - Iron Centers , In: Structure and Bonding Vol. 88, pp. 139-173, Springer Utgiver, ISBN 3-540-62870-3 .
- JoAnne Stubbe, Wilfred A. van der Donk: Protein Radicals in Enzyme Catalysis , In: Chemical Reviews Vol. 1998, Vol. 98, s. 705-762.
weblenker
- Ribonukleotidreduktasedatabase (RNRdb, engelsk)
- Krystallstruktur av R1 fra Protein Data Bank
- Krystallstruktur av R2 fra Protein Data Bank
- reaktom: Reduksjon av cytosolisk ribonukleosid 5'-difosfat til deoksyribonukleosid 5'-difosfat (tioredoksin)
Individuelle bevis
- ↑ Homologer på OMA
- ↑ a b Ulla Uhlin, Hans Eklund: Struktur av ribonukleotidreduktaseprotein R1. I: Nature , bind 370, 1994, s. 533-539.
- ↑ Britt-Marie Sjöberg et al.: To konserverte tyrosinrester i R1 deltar i en intermolekylær elektronoverføring i ribonukleotidreduktase. I: J. Biol. Chem. , Bind 271, nr. 34, 1996, s. 20655-20659.
- ↑ Peter Reichard: Fra RNA til DNA, hvorfor så mange ribonukleotid reduktase? , I: Science, bind 260, utgave 5115, 18. juni 1993, s. 1773-1777. DOI: 10.1126 / science.8511586
- T E. Torrents, P. Aloy, I. Gibert et al.: Ribonucleotide Reductases: Divergent Evolution of an Ancient Enzyme , I: Journal of Molecular Evolution, Vol. 2002, Vol. 55, s. 138-152. https://doi.org/10.1007/s00239-002-2311-7
- ↑ JoAnne Stubbe , Wilfred A. van der Donk: Protein Radicals in Enzyme Catalysis . I: Chemical Reviews . teip 98 , nr. 2 , 1. april 1998, s. 705-762 , doi : 10.1021 / cr9400875 .
- A JoAnne Stubbe, Daniel G. Nocera , Cyril S. Yee, Michelle CY Chang: Radikal initiering i klasse I ribonukleotidreduktase: Protonekoblet elektronoverføring fra lang rekkevidde? I: Chemical Reviews . teip 103 , nr. 6 , 1. juni 2003, s. 2167-2202 , doi : 10.1021 / cr020421u .
- A JoAnne Stubbe, Wilfred A. van der Donk: Protein Radicals in Enzyme Catalysis , In: Chemical Reviews Vol. 1998, Vol. 98, s. 705-762.
- ↑ Peter Reichard, Astor Baldesten, Lars Rutberg: Dannelse av deoksycytidin fosfater fra cytidin fosfater i ekstrakter fra Escherichia coli. I: J Biol Chem . , Bind 236, nr. 4, 1961, s. 1150-1157.
- ↑ P. Nordlund, B.-M. Sjöberg, H. Eklund: Tredimensjonal struktur av det frie radikale proteinet fra ribonukleotidreduktase. I: Nature , bind 345, 1990, s. 593-598.
- ↑ Yun Yen: Ribonukleotidreduktase-underenhet en som genterapimål. I: Clinical Cancer Research , Volum 9, 2003, s. 4304-4308.
- ↑ J. Shao, B. Zhou, Bernard Chu, Y. Yen: Ribonucleotide Reductase Inhibitors and Future Drug Design, In: Current Cancer Drug Targets, Vol. 2006, Vol. 6, s. 409-431.