α-helix
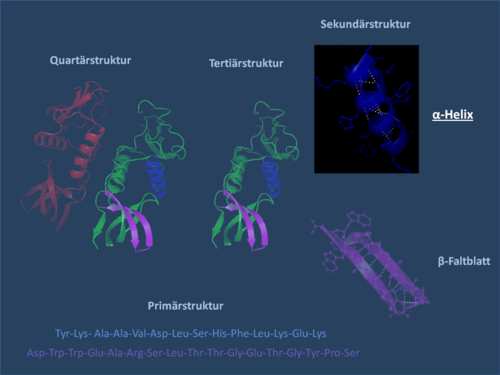
I biokjemi er α- helix et vanlig uttrykk for den sekundære strukturen til et protein . Det er en av de mest stabile naturlige konformasjonene til en aminosyresekvens og er nesten allestedsnærværende i den sekundære strukturen.
Med den sekundære strukturen i et protein menes den romlige strukturen til aminosyrekjeden uten å ta hensyn til sidegruppene. Den sekundære strukturen til et protein er avledet fra dets primære struktur (aminosyresekvens). Overordnede strukturelle nivåer er den tertiære strukturen og den kvartære strukturen . Den tredimensjonale strukturen til et protein er avgjørende for dets selektive funksjon (se proteinstruktur ).
historie
På slutten av 1930-tallet begynte William Astbury å utføre krystallstrukturanalyser på krystallinske peptider . Det ble funnet at visse romlige trekk gjentas regelmessig hvor det ble mistanke om hydrogenbindinger i molekylet. Men han var ikke ennå klar over den planhet av den peptidbinding . De vanligste romlige strukturene ble senere kalt α-helix og β-ark . Linus Pauling , Robert Brainard Corey og Herman Branson foreslo en modell av α-helixen i 1951. Α i "α-helix" inneholder ikke noe vitenskapelig utsagn, men uttrykker bare det faktum at α-helix ble funnet foran β-arket. Den Ramachandran plottet utviklet av G. N. Ramachandran gjorde det mulig å identifisere dem ved hjelp av de to-plans vinkler av de på hverandre følgende aminosyrer i proteinet , i likhet med den Janin plottet utviklet senere .
struktur
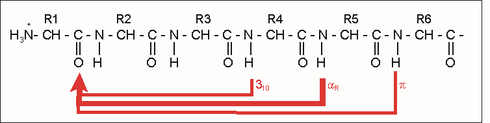
Α-helixen er en høyrehåndet spiral (fortrinnsvis av L-aminosyrer) med et gjennomsnitt på 3,6 aminosyresidekjeder per omdreining. En lengde på p = 0,54 nm (5,4 Å) oppnås per omdreining. Dette fremskrittet er kjent som tonehøyde. Det er produktet av skiftet (også kalt oversettelse) (0,15 nm) og resten per tur (3.6). Denne avstanden mellom restene er grunnen til at aminosyrer som er tre eller fire steder fra hverandre i den primære strukturen, er i nærheten av helixstrukturen. Α-helixen stabiliseres av en hydrogenbinding mellom karbonyloksygenet til den nte og amidprotonen i (n + 3) aminosyren i det samme molekylet.
CO- og NH-gruppene må være nær hverandre for å danne hydrogenbindingen. Den smaleste konfigurasjonen tilveiebringes av en kveilstreng der de to gruppene ligger oppå hverandre. Sidekjedene peker utover. Aminosyren prolin (”strukturbryter”) kan ikke enkelt settes inn i spiralen (dette er bare mulig ved posisjon 1–4, sett fra aminosiden). Som et resultat er det avvik fra den vanlige strukturen på punkter der prolin forekommer. α-Helices er veldig stabile og kan som stive sylindere danne et slags skjelett av proteinet. Derfor blir de ofte ikke avbildet som helixer, men som sylindere i proteinstrukturer. Et protein med en overveiende spiralformet struktur er myoglobin , et muskelprotein relatert til hemoglobin .
En α-helix er ofte bare stabil i sammenheng med et protein, og det er derfor ekstra stabiliserende bindinger ofte blir introdusert i isolerte α-helices, f.eks. B. ved å erstatte hydrogenbindingen med en CC-binding, ved tverrbinding av aminosyresidekjedene eller ved å danne disulfidbroer .
Geometri av helix og helix-helix interaksjoner


Del A viser en “spiralformet spiral” som består av to, del B en består av tre α-spiraler (projeksjon). I tillegg ble ”tetrahelix-bunt” -strukturer beskrevet.

α-Helices er grunnlaget for typiske fiberproteiner (α-keratin, den grunnleggende substansen i hår, myosin, en komponent av muskelfibre, etc.), men også, som introdusert i eksemplet med myoglobin, strukturgivende komponenter av løselig, kuleproteiner. Generelt sett kan ikke individuelle helikser påta seg denne oppgaven, men ordnede aggregater som består av to, tre, fire eller flere individuelle helikser kan.
Enheten for å danne en slik "superhelix" er basert på hydrofobe interaksjoner i amfipatiske helixer. Dette er helixer, hvorav den ene siden er hydrofil (vendt mot vannet) og den andre siden er hydrofob og derfor i stand til interaksjoner. Strukturen til helixen betyr at det “hydrofobe båndet” ikke løper parallelt med spiralaksen, men omgir spiralen i form av en strukket, venstrehendt spiral. Når de hydrofobe båndene med to eller flere helikser nærmer seg hverandre, dannes superhelixen kjent som en " spiralformet spiral ".
Helix-spådom
Første innsats for å forutsi sekundære proteinstrukturer går tilbake til 1960-tallet og har blitt kontinuerlig forbedret med fremkomsten av moderne røntgenstrukturanalyse . En ekstremt nyttig, rasjonell tilnærming til å forutsi α-helix er assosiert med navnet Marianne Schiffer og følger videre av ovenstående betraktninger. I følge n +/- 3.4-kriteriet kan en rest n parre seg med rester som er tre eller fire posisjoner unna. Er z. Hvis for eksempel rest 1, 4 og 5 er hydrofobe, kan de samhandle og dermed stabilisere en helixstruktur. Det samme gjelder restene 6, 3 og 2 osv. Dette prediksjonsskjemaet viste opprinnelig verdien for insulin og myoglobin.
Med publiseringen av ytterligere røntgenstrukturanalyser ga "helical wheel" -tilnærmingen i økende grad vei for statistiske metoder. En tidlig tilnærming av denne typen går tilbake til Chou og Fasman (1974, 1978).
Tabellen nedenfor viser spiralpotensialene (Pα) til aminosyrerester. Pα tilsvarer den relative frekvensen som aminosyren er representert i spiralen. Med en Pα-brønn over 1 blir en aminosyre referert til som en "helix-former", med en Pα-brønn under 1 som en "helix breaker".
| aminosyre | Pα |
|---|---|
| Glu | 1,59 |
| Ala | 1.41 |
| Leu | 1.34 |
| Mead | 1.30 |
| Gln | 1.27 |
| Lys | 1.23 |
| Arg | 1.21 |
| Phe | 1.16 |
| Ile | 1.09 |
| Hans | 1.05 |
| Trp | 1.02 |
| Asp | 0,99 |
| Val | 0,90 |
| Thr | 0,76 |
| Asn | 0,76 |
| Cys | 0,66 |
| Tyr | 0,61 |
| Ser | 0,57 |
| Gly | 0,43 |
| Per | 0,34 |
Sammendrag av spiralparametrene
| A - Forholdet mellom restene til hverandre | |||
| n + 4 | Rest 1 og 5 | H-bro | -C = O ··· HN- |
| n +/- 3, 4 | Rest 1 og 4 eller 5 | samme side | "Hydrofob bue", α-potensial |
| n + 18 | Rest 1 og 19 | ekliptikk | 5 x 3,6 = 18; "Gjenta enhet" |
| n + 7 | Rest 1 og 8 | "Nesten ekliptikk" | 2 x 3,6; "Heptad gjenta" |
| B - fysiske parametere | |||
| n = 3,6 | Rester per tur | ||
| d = 1,5 A. | aksial skifte per rest | ||
| p = 5,4 Å = nxd | "Pitch" (avstand mellom spolene) | ||
| a = 100 ° = 360 ° / n | Vinkel (sektor) per aminosyre | ||
Andre former for sekundær struktur

I tillegg til α-helix og β-arket, er det andre typer sekundærstruktur (sekundære strukturmotiver). Andre vanlige motiver er:
Delene av den primære strukturen til et protein som ikke tilhører et motiv , kalles tilfeldige spiralstrukturer . Disse strukturene er også betydelig involvert i dannelsen av hele proteinstrukturen .
litteratur
- M. Schiffer, AB Edmundson: Bruk av spiralformede hjul for å representere strukturene til proteiner og for å identifisere segmenter med spiralformet potensial. I: Biophysical Journal. 7, 1967, s. 121-135.
- PY Chou, GD Fasman: Empiriske spådommer om proteinkonformasjon. I: Årlig gjennomgang av biokjemi . 47, 1978, s. 251-276.
- C. Cohen, DAD Parry: α-Helical coiled-coils - et utbredt motiv i proteiner. I: Trender innen biokjemiske vitenskaper . 11, 1986, s. 245-248.
- S. Kamtekar, JM Schiffer, H. Xiong, JM Babik, MH Hechtr: Proteindesign ved binær mønster av polære og ikke-polære aminosyrer. I: Vitenskap . 262, 1993, s. 1680-1685.
weblenker
Individuelle bevis
- ^ William T. Astbury, S. Dickinson, K. Bailey: Røntgenfortolkningen av denaturering og strukturen til frøglobuliner. I: The Biochemical journal. Volum 29, nummer 10, oktober 1935, s. 2351-2360.1, PMID 16745914 . PMC 1266766 (gratis fulltekst).
- ^ William T. Astbury: De strukturelle proteinene i cellen. I: The Biochemical journal. Volum 39, nummer 5, 1945, s. Lvi, PMID 21020817 .
- ^ WT Astbury, R. Reed, LC Spark: En røntgen- og elektronmikroskopstudie av tropomyosin. I: The Biochemical journal. Volum 43, nummer 2, 1948, s. 282-287, PMID 16748402 . PMC 1274681 (fri fulltekst).
- ^ Linus Pauling, Robert Brainard Corey, Herman R. Branson: Strukturen til proteiner; to hydrogenbundet spiralformede konfigurasjoner av polypeptidkjeden. I: Proceedings of the National Academy of Sciences . Volum 37, nummer 4, april 1951, s. 205-211, PMID 14816373 . PMC 1063337 (fri fulltekst).
- ↑ JM Scholtz, RL Baldwin: Mekanismen av alfa-heliks dannelse av peptider. I: Årlig gjennomgang av biofysikk og biomolekylær struktur. Volum 21, 1992, s. 95-118, doi: 10.1146 / annurev.bb.21.060192.000523 . PMID 1525475 . rbaldwin.stanford.edu (PDF)
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemistry . 7. utgave. Springer Spectrum, Heidelberg 2014, ISBN 978-3-8274-2988-9 , s. 40 .
- ↑ A. Winter, AP Higueruelo, M. Marsh, A. Sigurdardottir, WR Pitt, TL Blundell: Biophysical og beregningsfragmentbaserte tilnærminger til målretting protein-protein-interaksjoner: applikasjoner i struktur-styrt medikamentoppdagelse. I: Kvartalsvise gjennomgang av biofysikk. Volum 45, nummer 4, november 2012, s. 383-426, doi: 10.1017 / S0033583512000108 . PMID 22971516 .
- ↑ LK Henchey, AL Jochim, PS Arora: Samtidsstrategier for stabilisering av peptider i alfa-helisk konformasjon. I: Nåværende mening i kjemisk biologi. Volum 12, nummer 6, desember 2008, s. 692-697, doi: 10.1016 / j.cbpa.2008.08.019 . PMID 18793750 . PMC 2650020 (fulltekst).
- ↑ RJ Platt, TS Han, BR Green, MD Smith, J. Skalicky, P. Gruszczyński, HS hvitt, B. Olivera, G. Bulaj, J. Gajewiak: Stifteetterligner kovalente interaksjoner av y-carboxyglutamates i conantokins, peptid-antagonistene ifølge N-metyl-D-asparaginsyre reseptorer. I: The Journal of biologisk kjemi. Volum 287, nummer 24, juni 2012, s. 20727-20736, doi: 10.1074 / jbc.M112.350462 . PMID 22518838 . PMC 3370255 (fri fulltekst).
- ↑ P. Barthe, S. Rochette, C. Vita, C. Roumestand: Syntese og NMR-løsningsstruktur av en alfa-helisk hårnål stiftet med to disulfidbroer. I: Protein science: en publikasjon av Protein Society. Volum 9, nummer 5, mai 2000, s. 942-955, doi: 10.1110 / ps.9.5.942 . PMID 10850804 . PMC 2144636 (gratis fulltekst).
- ↑ Jeremy M. Berg: Stryer Biochemistry. 6. utgave. Spectrum Academic Publishing House, Heidelberg 2007, s. 56.
- ^ PDB Community Focus: Julian Voss-Andreae, Protein Sculptor. I: Protein Data Bank Newsletter. 32, vinter, 2007, wwpdb.org (PDF)
- Mor L. Moran, RA Horton, G. Scrimgeour, M. Perry: Principles of Biochemistry . Pearson, Boston MA 2011, ISBN 978-0-321-70733-8 , pp. 127 .