Kollagener
| Kollagen | ||
|---|---|---|

| ||
| Kollagen trippel helix | ||
| Masse / lengde primærstruktur | 3 x 200-1000 aminosyrer | |
| Sekundær til kvartær struktur | Trippel helix | |
| Forløper | Procollagen polypeptidkjeder og procollagen | |
| Isoformer | 28 hos mennesker | |
| Legemiddelinformasjon | ||
| ATC-kode | B02 BC07 , G04 BX11 , D11 AX57 | |
| Narkotikaklasse | Fiberprotein | |
| Hendelse | ||
| Parent taxon | Vevsdyr | |
Kollagener (forløper tropokollagener ; internasjonalisert stavekollagener , stress på nest siste stavelse) er en gruppe strukturelle proteiner (et “ protein ” som danner en fiberbunt ) hovedsakelig av bindevevet (nærmere bestemt: den ekstracellulære matrisen ) som bare forekommer hos flercellede dyr (inkludert mennesker ). Kollagener finnes blant annet i de hvite, uelastiske fibrene i sener, leddbånd, bein og brusk. Lag av huden (subkutant vev) består også av kollagener.
bakgrunn
I menneskekroppen er kollagen det vanligste proteinet med over 30% av den totale massen av alle proteiner . Det er en viktig organisk komponent i bindevev ( bein , tenner , brusk , sener , leddbånd ) og huden . Kollagen (fra gresk for limproduksjon ) fikk navnet sitt fra sin tidligere bruk som benlim i trebearbeiding. Det er det viktigste råmaterialet for å lage gelatin .
Kollagen består av individuelle lange kollagenmolekyler ( proteinkjeder ) som danner en venstrehendt spiral (ligner på polyproline II- spiralen ). Tre av disse helixene er ordnet i et høyre superhelix. Denne tredobbelte helixen er stabilisert av hydrogenbindinger mellom de enkelte strengene.
Det som er påfallende med den primære strukturen (aminosyresekvensen) av kollagen er at hver tredje aminosyre er glysin . En sekvensmotiv som ofte gjentatt i kollagen proteinfamilie er glycine- prolin - hydroksyprolin .
Kollagenfibre har enorm strekkfasthet og er knapt strekkbare. Den tette viklingen er avgjørende for den høye strekkfastheten til kollagenfibre.
Kollagener spiller en avgjørende rolle i biomineraliseringen av virveldyr .
I vanlig språkbruk blir type I-kollagen likestilt med "kollagen". Når det gjelder mengde, er kollagen type I det viktigste kollagenet hos pattedyr, og på grunn av dets bruk som gelatin er det også det mest kjente. Det er andre typer kollagen som skiller seg strukturelt fra kollagen type I og utfører andre viktige biologiske funksjoner . Gelatin er denaturert form av fibrillært kollagen type I, II og / eller III og er hovedsakelig hentet fra slakteriavfall . Det skal bemerkes at kollagen type II forekommer primært i brusk , mens blandinger av kollagen type I og III kommer fra sener , leddbånd og huden .
Hendelse
Funksjonelle gener av kollagen strukturelle proteiner finnes i alle phyla fra flercellede dyr, i svamper , cnidarians og pattedyr, hovedsakelig i deres ekstracellulære matrise og i bindevevet. Kollagener forekommer ikke i andre organismer som sopp, planter eller protozoer.
konstruksjon
Kollagenmolekyl
De polypeptidkjeder av kollagen er individuelt syntetisert ved ribosomer av den grove endoplasmatiske retikulum . Bare trippel spiralformede molekyler i den ekstracellulære matrisen (ECM) blir referert til som kollagenmolekyler eller tropokollagen . De har det til felles at de består av tre polypeptidkjeder. Disse er hver i venstrehåndede kollagenhelixer (α-kjeder, for ikke å forveksle med høyrehendte α-helikser ) og er viklet sammen i form av den karakteristiske høyrehåndede trippelhelixen. Hver enkelt kollagenhelix kan være sammensatt av 600 til 3000 aminosyrer, avhengig av typen kollagen, og er utstyrt med store domener som består av repeterende GXY-sekvenser.
Dermed er det en glycin ( G ) rest ved hver tredje posisjon . Glycin som den minste aminosyren passer perfekt inn i den tredobbelte helixen med sine veldig tette svinger. Aminosyren prolin finnes ofte i posisjon X. På grunn av den stive ringstrukturen fungerer prolin her som et "hjørne" i polypeptidkjeden og støtter dannelsen av tette svinger i den tredobbelte spiralen. 4- hydroksyprolin er hovedsakelig plassert i posisjon Y og stabiliserer den tredobbelte spiralen via hydrogenbindinger mellom nærliggende polypeptidkjeder. Ved å bruke glysin, prolin og hydroksyprolin er rotasjonen av polypeptidkjeden begrenset, og de smale romforholdene i den tredobbelte helixen tas i betraktning.
| Strukturelt nivå | molekylært domene |
|---|---|
| Primær struktur (= sekvens) | Polypeptidkjeder med repeterende GXY-sekvenser |
| Sekundær struktur | venstrehåndede kollagenhelixer (α-kjeder) |
| Tertiær struktur | høyrehendt trippel helix laget av 3 polypeptidkjeder (tropokollagen Ø1,5 nm) |
| Kvartær struktur | Mikrofibriller Ø20–40 nm, fibriller Ø300–500 nm, fibre Ø4–12 μm |
Tilstedeværelsen av hydroksylysin sammen med hydroksyprolin er også karakteristisk for kollagen. Hydroksylysin danner forutsetningen for dannelse av kovalente tverrbindinger, som de individuelle tredobbelte helixene kan festes i rom i kollagenfibrillene.
Kollagenfibriller
I fibrillene er ikke nabokollagenmolekyler ordnet flush, men rundt 67 nm, dvs. H. motregnet med omtrent en femtedel av lengden. Konsekvensen av dette arrangementet er at tverrgående striper kan sees på elektronmikroskopbilder av metallkontrasterte kollagenfibriller. Et karakteristisk båndmønster opprettes, som gjentas hver 67 nm (234 aminosyrer) og blir referert til som D-perioden. Dette deler α-kjedene i fire homologe regioner D1-D4. Bandene som vises i en D-enhet er betegnet med a - e. Kollagenfibrillene er ordnet polymerer som kan være mange mikrometer lange i modent vev. De er ofte gruppert i større, kabellignende bunter kalt kollagenfibre. I sener er kollagen type I fibrildiameter 50-500 nm, i huden 40-100 nm og i hornhinnen (hornhinnen i øyet) 25 nm. Fibrillogenesen av kollagen blir ofte regulert av små leucinrike proteoglykaner. , slik at i tilsvarende vev kan det oppstå fibrer med en definert diameter og et definert arrangement.
Strukturoppklaring
Dagens bilde av kollagen trippel helix og den romlige oppstillingen av aminosyrerester og deres hydrogenbindinger mellom hverandre er i stor grad basert på røntgenkrystallografisk arbeid fra de indiske forskerne G. N. Ramachandran og Gopinath Kartha (1954).
Det tidligere Max Planck Institute for Protein and Leather Research i München (grunnlagt i 1956 for å avklare bindevevet gjennom sponsing av lærindustrien ) ga viktig informasjon (hele den primære strukturen av kollagen type I samt makrostrukturene av type IV og VI ) fra 1966 under leder av Klaus Kühn (etter flytting av instituttet til Max Planck Institute for Biochemistry i Martinsried).
biosyntese
Kollagen er hovedsakelig i fibroblaster , kondroblaster , osteoblaster og odontoblaster laget, men kollagen brukes også i mange andre celletyper syntetisert . Biosyntesen av kollagen i fibroblaster er best studert. Fibroblaster har et omfattende, grovt endoplasmatisk retikulum og et velutviklet Golgi-apparat for å kunne delta i utskillelsen av kollagener i den ekstracellulære matrisen. Fibroblaster produserer kollagen de novo og skiller det ut i den ekstracellulære matrisen. Fibroblaster er også i stand til å bryte ned kollagen ved hjelp av enzymer som kalles kollagenaser .
1. Transkripsjon : Så langt er 42 gener kjent som deltar i biosyntese av kollagen og koder for 28 forskjellige typer kollagen. Hvert gen koder for en bestemt mRNA-sekvens, og gennavnet inneholder vanligvis COL som et prefiks. Syntesen startes med aktivering av visse gener som er ansvarlige for dannelsen av visse α-peptider. Dette er hovedsakelig α-peptidene α1, α2 eller α3.
2. Oversettelse : Så snart mRNA når cytoplasmaet fra cellekjernen, kombineres mRNA for translasjon med de ribosomale underenhetene for å danne prepro-α-kjeder (også kalt prepropeptid). Disse prepro-a-kjedene inneholder en signalsekvens ved N- terminalen. Denne signalsekvensen gjenkjennes av en signalgjenkjenningspartikkel på det grove endoplasmatiske retikulumet (ER) slik at kjeden kan komme inn i lumenet til den grove ER.
3. Prepro-α-kjede til procollagen : Tre modifikasjoner av prepro-α-kjeden er nødvendige for å danne en α-kjede. Dette følges av tredobbelt helixdannelse av tre α-kjeder for å danne procollagen.
- Spalting av signalsekvensen : Signalsekvensen ved N -terminalen til prepro-α-kjeden ved signal peptidaser skilt ut, og det er et pro-α kjede, med den N - og C- terminale propeptider er gitt.
- Hydroksylering : I det endoplasmatiske retikulum er OH-grupper knyttet til individuelle prolin- og lysinrester av polypeptidkjeder som allerede har dannet seg eller som allerede har dannet seg ( hydroksylering ). Askorbinsyre (vitamin C) er en viktig kofaktor i hydroksylering av aminosyrene prolin til hydroksyprolin av enzymet prolyl-4-hydroksylase ( EC 1.14.11.2 ) og lysin til hydroksylysin av enzymet lysyl-hydroksylase ( EC 1.14.11.4 ). Hydroksyprolin har den funksjonen å styrke den tredobbelte spiralen i et kollagenmolekyl via hydrogenbindinger mellom nærliggende kollagenpolypeptidkjeder. Hydroxylysine brukes til å forankre kovalente tverrbindinger mellom kollagenmolekyler. Hvis det ikke er hydroksylering, dannes bare skadede kollagenmolekyler som ikke kan oppfylle deres funksjon som strukturelle proteiner. Det skal bemerkes her at nesten alle symptomer på askorbinsyre mangelsykdom skjørbuk kan spores tilbake til feil biosyntese av kollagen.
- Glykosylering : Til slutt blir noen lysinrester vanligvis glykosylert av procollagen galactosyl transferase ( EC 2.4.1.50 ) eller procollagen glukosyl transferase ( EC 2.4.1.66 ) eller andre glykosyleringsenzymer. En kollagen α-kjede ble syntetisert.
- Trippel heliksdannelse : Den tredobbelte helixdannelsen initieres av dannelsen av disulfidbindinger mellom C- terminale propeptider ved hjelp av en proteindisulfidisomerase ( EC 5.3.4.1 ). Tre α-kjeder danner et trestrenget helixmolekyl, procollagen , via hydrogenbroer .
4. Prokollagen sekresjon og transport til Golgi-apparatet : På grunn av størrelsen på procollagenmolekyler (ca. 300 nm) passer de ikke inn i de normale COPII-vesiklene (50–90 nm) i det endoplasmatiske retikulumet. For å muliggjøre transport er en kopi av ubiquitinproteinet bundet av enzymet CUL3 - KLHL12 til SEC31 av proteinkomplekset SEC13 - SEC31, slik at størrelsen på transportvesikelen kan modifiseres. I tillegg deltar transmembranproteinet TANGO1 i koordineringen av prokollagen sekresjon. Etter at prolollagen har blitt pakket i de modifiserte transportblærene, kan den transporteres til Golgi-apparatet .
5. Modifikasjon i Golgi-apparatet : Den siste posttranslasjonelle modifiseringen av prokollagenet finner sted i Golgi-apparatet ved tilsetning og modifisering av oligosakkarider. Hvilke enzymer som er ansvarlige for modifiseringen av N- terminusbundne oligosakkarider, avhenger av plasseringen av den posttranslasjonelle modifiseringen i Golgi-apparatet. Enzymer for de respektive områdene av Golgi-apparatet er tabellert nedenfor:
| Område av Golgi-apparatet | enzym |
|---|---|
| cis | α-mannosidase I. |
| medial | N- acetylglukosaminyltransferase I. |
| medial | α-mannosidase II |
| medial | N- acetylglukosaminyltransferase II |
| medial | Fukosyltransferase |
| trans | Galaktosyltransferase |
| trans | Sialyl transferase |
6. Transport fra Golgi-apparatet til plasmamembranen og påfølgende eksocytose inn i den ekstracellulære matrisen : De sekretoriske vesiklene som samler seg på transsiden av trans Golgi-nettverket kalles Golgi til plasmamembranbærere (GPC). I GPC transporteres prokollagen til plasmamembranen, nærmere bestemt til fremspringene i plasmamembranen, såkalte fibripositorer . De trippelheliske kollagenmolekylene frigjøres fra cellen. Frigjøringen av molekylene i det ekstracellulære rommet skjer ved eksocytose på grunnlag av fibripositorene, der glykosylkomponentene ser ut til å være involvert.
7. Dannelse av tropokollagen : Umiddelbart etter frigjøring fra cellen, blir propeptidene avspaltes ved hjelp av prokollagen peptidaser . Enzymet procollagen- N- endopeptidase ( EC 3.4.24.14 ) kreves for spaltning av aminoterminale sekvenser, mens enzymet procollagen- C- endopeptidase ( EC 3.4.24.19 ) spalter karboksin -terminal procollagensekvenser. Den tropokollagen er dannet .
8. Fibrillogenese : Etter splitting av prokollagenpeptidene, samles individuelle tropokollagenmolekyler for å danne kollagenfibriller (fibrillogenese). Andre molekyler kan feste seg til fibriller og dermed tilpasse fibrildiameteren. Disse inkluderer de såkalte små leucinrike repetitive proteoglykanene (SLRP), inkludert for eksempel dekorin , fibromodulin og lumican .
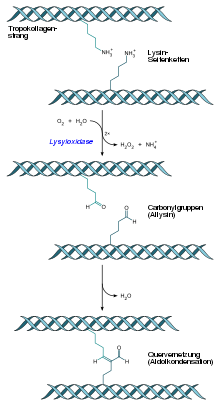
9. Tverrbinding : Etter at individuelle trippelheliske tropokollagenmolekyler er motvirket av en femtedel av lengden, foregår kovalent tverrbinding via nærliggende hydroksylysinrester som må omdannes , hvorved det romlige arrangementet er permanent fikset. Hydroksylysinrestene (skapt intracellulært av lysylhydroksylasen ) oksyderes til allysin av lysyloksidasen ( EC 1.4.3.13 ). De to nærliggende allysinrester inngår i en aldolkondensasjon , hvorved dette nabolaget fikses ved permanent tverrbinding. Tverrbundne kollagenfibriller dannes.
10. Dannelse av kollagenfibre : Mange slike kovalent stabiliserte kollagenfibriller danner til slutt kollagenfibre, som representerer den grunnleggende strukturen til den ekstracellulære matrisen til alle vevsdyr .
Kollagen typer
Kollagenene er delt inn i flere undergrupper. Det er kjent 28 forskjellige typer kollagen (type I til XXVIII) samt minst ti andre proteiner med kollagenlignende domener. Følgende liste viser medlemmene av kollagenfamilien som hittil er kjent.
| Type | beskrivelse | Gen (er) | Sykdommer |
| JEG. | Hos pattedyr er type I kollagen, et fibrillært kollagen, den vanligste typen kollagen og forekommer i hud, sener, fascia, bein, kar, indre organer og dentin. | COL1A1 , COL1A2 | Osteogenesis imperfecta type I - IV, Ehlers-Danlos syndrom (klassisk, artrokalasi), infantil kortikal hyperostose |
| II | fibrillar; Strukturelt protein av hyalin og elastisk brusk ; 50% av alle proteiner i brusk består av type II kollagen; En del av glasslegemet | COL2A1 | Hypokondrogenese , achondrogenesis type II , Stickler syndrom , medfødt spondyloepiphyseal dysplasi , spondyloepimetaphyseal dysplasi Strudwick type , Kniest dysplasi |
| III | fibrillar; En del av granulasjonsvevet og retikulære fibre ; også en del av karveggene, indre organer, hud, livmor og hornhinne | COL3A1 | Akrogeri , Ehlers-Danlos syndrom (vaskulær) |
| IV | En del av basalamina og linsen i øyet ; Også tjener som en del av filtreringssystemet i kapillærene og glomeruli av den nevronet | COL4A1 , COL4A2 , COL4A3 , COL4A4 , COL4A5 , COL4A6 | Alport syndrom , Goodpasture syndrom , tynn basalmembran type nefropati |
| V | fibrillar; En del av interstitium , placentavev og dermoepidermal kryssson; hovedsakelig assosiert med interstitiell vev som inneholder kollagen type I | COL5A1 , COL5A2 , COL5A3 | Ehlers-Danlos syndrom (klassisk, hypermobile) |
| VI | Organisering av ulike komponenter i den ekstracellulære matrisen ; Opprettholde integriteten til de forskjellige vevene; hovedsakelig forbundet med vev som inneholder kollagen type I | COL6A1 , COL6A2 , COL6A3 , COL6A5 | Ullrich type medfødt muskeldystrofi , betlem myopati , atopisk eksem |
| VII | danner ankerfibriller i den dermoepidermale krysssonen | COL7A1 | Dystrofisk epidermolyse bullosa , skjeggsyndrom |
| VIII | kort kjede; integrert del av det subendoteliale laget av bindevevsceller i blodkar og Descemet-membranen i hornhinnen; Migrasjon og spredning av glatte muskelceller i tunica media i blodkarene | COL8A1 , COL8A2 | Bakre hornhinnepolymorf dystrofi , Fuchs endotel dystrofi 1 |
| IX | FASIT 1 ; En del av hyalinbrusk og glasslegemet; hovedsakelig forbundet med vev som inneholder kollagen av type II og XI | COL9A1 , COL9A2 , COL9A3 | Flere epifysealdysplasi (type 2,3 og 6) |
| X | kort kjede; En del av kondrocytter i den hypertrofiske sonen | COL10A1 | Metaphyseal chondrodysplasia type Schmid , spondylometaphyseal dysplasia type Sutcliffe |
| XI | fibrillar; En del av brusk | COL11A1 , COL11A2 | Stickler syndrom type 2, Marshall syndrom , Weissenbacher-Zweymüller fenotype , oto-spondylo-megaepiphyseal dysplasi |
| XII | FACIT, interaksjon med type I kollagenfibriller, dekorin og glykosaminoglykaner | COL12A1 | Betlem myopati 2, medfødt muskeldystrofi type Ullrich 2 |
| XIII | MACIT 2 ; samhandler med integrin α 1 β 1 , fibronektin og andre komponenter i kjellermembranen slik som Nidogen-2 og Perlecan ; er involvert i celle-matriseforbindelsen og i celleadhesjon; Kobling av muskelfiber med kjellermembranen | COL13A1 | Medfødt myasthenisk syndrom type 19 |
| XIV | FACIT; også kjent som undulin; spiller en rolle i klebeintegrasjonen av kollagenfasikler ; er tilstede i kjellermembranen under embryonal utvikling | COL14A1 | - |
| XV | Multiplexin; er i stand til å koble kjellermembranen med det løse bindevevet ; stabiliserer mikrokar og muskelceller i hjertet og skjelettmuskelen ; kan hemme angiogenese | COL15A1 | - |
| XVI | FACIT; involvert i celleadhesjon og indusere integrin- medierte cellulære responser slik som spredning ; fremmer livet av intestinal under epiteliale myofibroblasts (engl. intestinale subepitele myofibroblasts , ISEMF) i tarmveggen | COL16A1 | - |
| XVII | MACIT; spiller en viktig rolle i integriteten til hemidesmosomer og i feste av keratinocytter til den underliggende kjellermembranen; fremmer invasjonen av ekstravilløse trofoblaster under utvikling av morkaken | COL17A1 | Bulløs pemfigoid , epidermolyse bullosa junctionalis |
| XVIII | Multiplexin; Vedlikehold av retinal struktur og lukking av nevralrøret ; et spaltingsprodukt av kollagen XVIII er endostatin med en molekylvekt på 20 kDa | COL18A1 | Knobloch syndrom type 1 |
| XIX | FACIT; ligger hovedsakelig i vaskulær , neuronal , mesenkymal og epitelial kjellermembran; Kryssbro mellom fibriller og andre ekstracellulære matriksmolekyler | COL19A1 | - |
| XX | FACIT; er hovedsakelig plassert i epitelaget av hornhinnen, den embryonale huden, sverdprosessen og i senen | COL20A1 | - |
| XXI | FACIT; er en ekstracellulær matrikskomponent i blodkarveggen som utskilles av glatte muskelceller | COL21A1 | - |
| XXII | FACIT; deltar i celleadhesjon av ligander i flerlagsepitel og i fibroblaster | COL22A1 | - |
| XXIII | MACIT; lokalisert i overhuden og annen epitel som tunge, tarm, lunger, hjerne, nyre og hornhinne; samhandler med integrin α 2 β 1 | COL23A1 | - |
| XXIV | hovedsakelig uttrykt i beinvev | COL24A1 | - |
| XXV | MACIT; forbinder amyloidfibriller med protease- resistente aggregater og kan binde heparin | COL25A1 | - |
| XXVI | er ofte dannelsen av nesepolypper i nesehulen assosiert | COL26A1 | - |
| XXVII | ligger i basalmembranen av keratinocytter i hemidesmosomes type I, som er i det vesentlige som adhesjon og overflatereseptoren i stratifisert epitel handlinger | COL27A1 | - |
| XXVIII | lokalisert hovedsakelig i isjiasnerven og på kjellermembranen til noen Schwann-celler ; integrert del av Ranvier-ringen og omgir ikke- myeliniserte gliaceller | COL28A1 | - |
Struktur av kollagen type I
I tilfellet av type I kollagen, kollagen de tre polypeptidkjedene er de a-kjeder, [α1 (I) 2 α2 (I)], som vikle seg rundt hverandre for å danne en trippelheliks. Type I kollagen α1-kjedenet består av 50 eksoner , hvorav over halvparten er 54 basepar (bp) eller to til tre ganger lengden. De koder for sekvensen (GXY) 6 eller et multiplum derav.
bruk
Kollagen brukes hovedsakelig i form av gelatin , som oppnås ved splittelse av storfekjøtt , svinekjøtt og bein fra storfe og gris.
Ernæring og fôrmaterialer
I Tyskland produseres årlig rundt 32 000 t spiselig kvalitetsgelatin, den totale europeiske produksjonen er 120 000 t (70% svinekjøtt, 18% bein, 10% storfekjøtt, 2% annet). Rundt 90 000 tonn brukes i Tyskland, hvorav to tredjedeler er i næringsmiddelindustrien, og omtrent halvparten av resten er i dyrefôrsektoren.
I tillegg brukes kollagen til produksjon av kunstige hylster som fungerer som pølseskinn .
Pharma
Rundt 15 000 t blir behandlet i den kjemiske og farmasøytiske industrien. De viktigste bruksområdene i farmasøytisk industri er tabletter og vitaminpreparater (harde og myke kapsler) samt gelatinstikkpiller. Gelatin brukes også til hemostatiske svamper og som en blodplasmaerstatning.
Kollagen brukes også i regenerativ medisin som et næringsmedium i vevsteknikk . Dette kan for eksempel brukes til å produsere huderstatningsmaterialer for alvorlige forbrenninger.
Kosmetikk
Kollagen har også blitt brukt i kosmetikk i mange år, hvor det primært er ment å redusere aldring av huden, eller for å fremme anti-aldring . I dag brukes kollagenprodukter i kosmetikk i form av kremer. Kollagenet som brukes til dette ekstraheres vanligvis fra griseskinn. Kollagen er det viktigste strukturelle proteinet i huden og oppfyller en rekke funksjoner for å opprettholde elastisitet og fleksibilitet.
For å behandle rynker eller rynker injiseres kollagen noen ganger i huden som en rynkeinjeksjon .
teknologi
I analog fotografering danner gelatin grunnlaget for de lysfølsomme lagene på film og fotopapir. Selv moderne skriverpapir for utskrift av fargebilder er belagt med gelatin.
lær
Tverrbundne kollagenfibre danner lærstrukturen og gir den sin strekkfasthet. Ved hjelp av garvemidler oppnås visse egenskaper som fleksibilitet og motstand mot dekomponering av mikroorganismer.
Se også

litteratur
- Shirley Ayad, Ray P. Boot-Hanford, Martin J. Humphries, Karl E. Kadler, C. Adrian Shuttleworth: The Extracellular Matrix FactsBook. 2. utgave. Academic Press (Harcourt Brace & Company), San Diego CA et al. 1998, ISBN 0-12-068911-1 , s. 43 ff.
- Jürgen Brinckmann, Holger Notbohm, Peter K. Müller (red.): Collager. Primer i struktur, prosessering og montering (= Topics in Current Chemistry . Vol. 247). Springer, Berlin et al. 2005, ISBN 3-540-23272-9 .
weblenker
- De to ansiktene til kollagen VII - proteinvarianten strammer ikke bare huden, men gjør også hudkreft farlig . Wissenschaft.de
Individuelle bevis
- ^ Hermann Ehrlich: Kitin og kollagen som universelle og alternative maler i biomineralisering . I: International Geology Review . teip 52 , nr. 7-8 , 30. april 2010, s. 661-699 , doi : 10.1080 / 00206811003679521 (engelsk).
- ↑ Aaron L. Fidler et al: En unik kovalent binding i kjellermembranen er en urinnovasjon for vevsutvikling. I: Proceedings of the National Academy of Sciences. Volum 111, nr. 1, 2014, s. 331-336. doi: 10.1073 / pnas.1318499111 .
- ^ Jason W. Holland et al.: Et nytt minikollagengen forbinder cnidarians og myxozoans. I: Proceedings of the Royal Society B: Biological Sciences. Volum 278, nr. 1705, 2011, s. 546-553. doi: 10.1098 / rspb.2010.1301 .
- ^ Richard P. Tucker, Josephine C. Adams: Adhesion network of cnidarians: A postgenomic view. I: Kwang W. Jeon (red.): International Review of Cell and Molecular Biology . Akademisk presse. Volum 308, kapittel 8, 7. januar 2014, s. 323-377. doi: 10.1016 / B978-0-12-800097-7.00008-7 .
- ↑ Klaus Kühn : Struktur og biokjemi av kollagen. I: Kjemi i vår tid . Volum 8, 1974, s. 97-103. doi: 10.1002 / ciuz.19740080402 .
- Ory Gregory D. Cramer, Susan A. Darby: Grunnleggende og klinisk anatomi i ryggraden, ryggmargen . Elsevier Health Sciences, 2005, ISBN 978-0-323-07142-0 , pp. 580 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ Kollagener. I: ScienceDirect. Hentet 13. oktober 2019 .
- ↑ Hao Wang, Branko Stefanovic: Rollen til LARP6 og nonmuscle Myosin i partisjonering av kollagen-mRNA til ER-membranen. I: PLoS One . 9 (10) 2014, PMID 25271881 , doi : 10.1371 / journal.pone.0108870 .
- ↑ U. Lindert, M. Gnoli, M. Maioli, MF Bedeschi, L. Sangiorgi, M. Rohrbach, C. Giunta: Insight into the Pathology of a COL1A1 Signal Peptide Heterozygous Mutation Leading to Severe Osteogenesis Imperfecta. I: Calcified Tissue International . 102 (3) mars 2018, s. 373–379, doi : 10.1007 / s00223-017-0359-z .
- ↑ J. Myllyharju: Prolyl 4-hydroksylaser, de viktigste enzymene i kollagenbiosyntese. I: Matrix Biology. Volum 22, nummer 1, mars 2003, s. 15-24, PMID 12714038 (gjennomgang).
- ↑ Sakari Kellokumpu, Raija Sormunen, Jari Heikkinen, Raili Myllylä: Lysylhydroksylase, et kollagenbehandlingsenzym, eksemplifiserer en ny klasse med luminallylorienterte perifere membranproteiner i endoplasmatisk retikulum . I: Journal of Biological Chemistry . 269 (148) 2. desember 1994, s. 30524-30529, (PDF).
- ↑ Richard Harwood, Michael E. Grant, David S. Jackson: Studier på glykosylering av hydroksylysin rester under kollagenbiosyntesen og subcellulære lokalisering av kollagen galactosyltransferase og kollagen glukosyltransferase i sene og bruskceller. I: Biochemical Journal. 152, 1975, s. 291, doi : 10.1042 / bj1520291 .
- ^ David J. Stephens: Kollagen sekresjon forklart. I: Natur. 482, 2012, s. 474, doi : 10.1038 / 482474a .
- ^ R. Kornfeld, S. Kornfeld: Montering av asparaginkoblede oligosakkarider. I: Årlig gjennomgang av biokjemi. 54, 1985, s. 631, doi : 10.1146 / annurev.bi.54.070185.003215 .
- ↑ EG Canty: Prokollagen-handel, prosessering og fibrillogenese. I: Journal of Cell Science. 118, 2005, s. 1341, doi : 10.1242 / jcs.01731 .
- ^ Charles M. Lapière, Albert Lenaers, Leonard D. Kohn: Procollagen peptidase: Et enzym som utskiller koordineringspeptidene til procollagen . I: Proc Natl Acad Sci US A. Volum 68 , nr. 12. desember 1971, s. 3054-3058 , PMC 389589 (fri fulltekst).
- ↑ A. Oldberg, P. Antonsson, K. Lindblom, D. Heinegård: A kollagenbindende 59 kd-protein (fibromodulin) er strukturelt beslektet med de små interstitielle proteoglykaner PG-S1 og PG-S2 (decorin). I: EMBO Journal . Volum 8, nummer 9, september 1989, s. 2601-2604, PMID 2531085 , PMC 401265 (fri fulltekst).
- A JA Rada, PK Cornuet, JR Hassell: Regulering av hornhinnekollagenfibrillogenese in vitro av kornproteoglykan (lumikan og dekorin) kjerneproteiner. I: Eksperimentell øyeforskning. Volum 56, nummer 6, juni 1993, s. 635-648, doi : 10.1006 / exer.1993.1081 , PMID 8595806 .
- ↑ C. Söderhäll, I. Marenholz, T. Kerscher, F Rüschendorf, F. Rüschendorf, J. Esparza-Gordillo, G Mayr, M Albrecht: Varianter i et nytt epidermalt kollagengen (COL29A1) er assosiert med atopisk dermatitt . I: PLoS Biology . 5, nr. 9, 2007, s. E242. doi : 10.1371 / journal.pbio.0050242 . PMID 17850181 . PMC 1971127 (fri fulltekst).
- ↑ K. Rappold: Gelatin - En naturlig mat. bmi aktuell 1/2004, forlag Informasjonssenter for bakemidler og bakeredienser for produksjon av brød og fine bakevarer e. V.
- ↑ a b gelatin . Gelatine Manufacturers of Europe , åpnet 23. mai 2013.
- ↑ a b Oliver Türk: Materiell bruk av fornybare råvarer . 1. utgave. Springer Vieweg, Wiesbaden 2014, ISBN 978-3-8348-1763-1 , s. 111-115 .
- ^ PDB Community Focus: Julian Voss-Andreae, Protein Sculptor . I: Protein Data Bank Newsletter . Nei. 32 (vinter), 2007 ( PDF ).
- ↑ Barbara Ward: 'Rakne kollagen struktur som skal installeres i Orange Memorial Park Sculpture Garden . I: Expert Rev. Proteomics . teip 3 , nei. 2 , april 2006, s. 174 , doi : 10.1586 / 14789450.3.2.169 .