Deskriptor (kjemi)
I kjemisk nomenklatur, en deskriptor er et prefiks i fronten av den systematiske stoff navn som beskriver konfigurasjonen eller stereokjemien av molekylet. Noen deskriptorer har bare kjemisk historisk betydning og bør ikke lenger brukes i gjeldende publikasjoner, ettersom de ikke lenger tas i betraktning i gjeldende IUPAC- anbefalinger .
Beskrivelser brukes ofte i kombinasjon med lokanter for å gi navn til en kjemisk struktur.
Når du sorterer alfabetisk, blir ikke beskrivelsene som vanligvis er i begynnelsen av det systematiske navnet tatt i betraktning.
Konfigurasjonsbeskrivere
cis -, trans -
Beskrivelsene cis - (lat. Denne siden ) og trans - (lat. Over ... over (fra) , utover ) brukes i beskrivelsen av kjemiske konfigurasjoner i forskjellige sammenhenger.
I organisk strukturell kjemi kan cis - og trans - brukes til å beskrive konfigurasjonen av en dobbeltbinding , forutsatt at den har et enkelt substitusjonsmønster med bare to radikaler. Posisjonen til to radikaler i forhold til hverandre, som ligger på forskjellige punkter i et ringsystem eller et større molekyl, kan også beskrives som cis - og trans - forutsatt at strukturen er stiv når det gjelder konfigurasjon og ikke tillater enkel inversjon.
I uorganisk kompleks kjemi brukes deskriptorene cis - og trans - til å identifisere posisjonsisomerer i oktaedriske komplekser med A 2 B 4 X-konfigurasjon eller kvadratplanære komplekser med A 2 B 2 X-konfigurasjon.
Kvadrat-plan kompleks: cisplatin
Typografisk er cis - og trans - alltid skrevet med små bokstaver og kursiv .
Cis / trans nomenklaturen er tvetydig på mer høyt substituerte dobbeltbindinger og er nå i stor grad erstattet av ( E ) / ( Z ) nomenklaturen.
Konfigurasjonen av en enkeltbinding ( s- står for "enkeltbinding") mellom to dobbeltbindinger (for eksempel av diener ) kan beskrives med s-cis og s-trans . Hvis begge dobbeltbindinger er på samme side av enkeltbindingen, er det s-cis- konfigurasjonen. Hvis dobbeltbindingene er motsatte, er det en s-trans- konfigurasjon. Begrepene synperiplanar og antiperiplanar brukes også om dette. Disse er imidlertid ikke identiske med s-cis eller s-trans , men avhenger av substitusjonsmønsteret på dobbeltbindingen. I praksis kan enkeltbindingsisomerer knapt skilles fra på grunn av den lave aktiveringsenergien for omdannelsen (3,9 kcal / mol for 1,3-butadien ) og spiller derfor bare en rolle i reaksjoner som krever en viss konfigurasjon for å fortsette, slik som den Diels -Alder reaksjon .
( E ) -, ( Z ) -
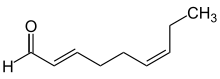
Beskrivelsene ( E ) - (fra motsatt side ) og ( Z ) - (fra sammen ) brukes til å muliggjøre en klar beskrivelse av substitusjonsmønsteret på alkener , kumulaer eller andre dobbeltbindingssystemer som oksimer . For tilskrivningen av ( E ) - eller ( Z ) - er det avgjørende i hvilket posisjonsforhold de to substituentene med høyest prioritet i henhold til CIP-nomenklaturen er på hver side av dobbeltbindingssystemet.
( E ) - / ( Z ) -nomenklaturen kan brukes til alle dobbeltbindingssystemer (inkludert de med heteroatomer ), men ikke for substituerte ringsystemer.
Beskrivelsene ( E ) - og ( Z ) - er alltid skrevet med store bokstaver og i kursiv, de er omgitt av runde parenteser, som, i likhet med flere lokale eller kommaer, er satt normalt.
o -, m -, p -
 |
 |

|
| o - kresol | m - kresol | p - kresol |
Forkortelsene o - (kort for ortho , fra gresk orthós for oppreist , rett ), m - ( meta , gresk omtrent for mellom ) og p - ( para , fra gresk pará for ved siden av , til siden ) beskriver de tre mulige posisjonelle isomerer av to substituenter på en benzenring . Som regel er dette to uavhengige individuelle substituenter, men kondenserte ringsystemer blir også referert til som orto - annulering, eller substitusjonsmønsteret er inkludert i navngivningen av molekylet , slik det er for eksempel med [2.2] paracyklofan . I den nåværende systematiske nomenklaturen blir o -, m - og p - ofte erstattet av spesifiserende lokanter ( 1,2-dimetylbenzen i stedet for o- xylen).
o -, m - og p - eller også stavet ut orto , meta og para - er alltid skrevet med små og kursive.
exo -, endo -
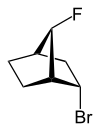
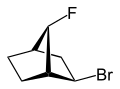
Med exo - (fra gresk = utenfor) eller endo - (fra gresk = endon inni) av den relative konfigurasjonen er brosykliske forbindelser merket. Posisjonen til en substituent i hovedringen i forhold til den korteste broen (ifølge IUPAC: broen med de høyeste lokalitetstallene) i det broforbundne ringsystemet er avgjørende for tildelingen av exo - eller endo -. Hvis substituenten som skal klassifiseres vender mot denne broen, får den tildelt deskriptoren exo - hvis den vender bort fra broen, er den endokonfigurert .
Hvis det er to forskjellige substituenter på samme karbonatom, er tildelingen exo / endo basert på høyere prioritet i henhold til CIP-reglene .
syn -, anti -
Hvis et brosyklisk system har en substituent på den korteste broen, kan det ikke tildeles en exo- eller endo- deskriptor. Disse isomerer klassifiseres ved hjelp av syn / anti- notasjonen. Dersom substituenten som skal bestemmes punkter til ringen med det høyeste antall ringelementer (eller hvis det er identisk med ringen med den mest signifikante substituenten i henhold til de regler CIP), så er det syn- -konfigurert (fra gresk syn. .. = sammen ), ellers tildeles den deskriptoren anti (gresk mot ).
På den annen side er bruken av syn - og anti - for å indikere konfigurasjonen av dobbeltbindinger, spesielt når det gjelder aldoksimer og hydrazoner avledet fra aldehyder, utdatert . Her ble forbindelsene referert til som å ha en syn- konfigurasjon hvis aldehyd-H og -O (av oksim) eller -N (av hydrazon) var i cis- stilling. Disse forbindelsene er nå beskrevet ved bruk av ( E ), ( Z ) nomenklaturen. Aldoximes og hydrazones som pleide å bli klassifisert som syn kan derfor nå beskrives som ( E ) -konfigurert.
syn - og anti - skrives alltid med små og små bokstaver, lokalbefolkningen plasseres foran og skilles med bindestrek.
fac -, mer -
Begrepene fac - (fra latinske facies = ansikt) og mer - (fra meridonal- ) kan brukes til å spesifisere arrangementet av oktaedriske komplekser med tre lignende ligander rundt det sentrale atomet. I dag anses denne nomenklaturen som utdatert, men er fortsatt tillatt. Prefikset fac - beskriver situasjonen når de tre ligandene av samme slag okkuperer de tre hjørnene av et trekantet oktaeder, mens de tre ligandene i mer- konfigurerte komplekser spenner over et plan der det sentrale atomet også kommer til å ligge.
fac - og mer - er plassert foran det komplekse navnet med små og små bokstaver.
n -, iso -, neo -, cyclo -
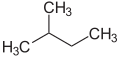
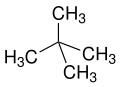
Prefiksene n - ( normal -), iso - (fra gresk ísos = lik ), neo - (gresk néos = ung , ny ) og cyclo - (gresk kyklos = sirkel ) brukes primært til arrangementet av atomer, hovedsakelig av karbon atomer i karbonskjeletter, som skal beskrives nærmere. n -, iso - og neo - brukes ikke lenger i den systematiske nomenklaturen, men brukes fortsatt ofte i vanlige navn og i laboratoriesjargong .
Prefikset n - beskriver et rettkjedet karbonskjelett uten grener, iso - derimot et forgrenet skjelett uten å spesifisere dette nærmere. Mer generelt står iso for en forbindelse som er isomerisk til n- forbindelsen, dvs. hvor individuelle atomer eller grupper av atomer har endret deres arrangement.
neo - er et ikke-spesifikt prefiks for "nye", dvs. mest syntetisk produserte stoffer eller isomerer av kjente n- forbindelser eller naturlige stoffer (for eksempel neomentol avledet fra mentol eller neoabietinsyre fra abietinsyre ). Ifølge IUPAC anbefales neo - bare for neopentan eller neopentylresten .
cyclo - er et ofte brukt prefiks for alle sykliske og heterosykliske forbindelser . I mange egennavn på kjemiske stoffer settes ikke cyclo foran som et prefiks, men integreres direkte i navnet, for eksempel i tilfelle av cyclohexane eller cyclooctatetraene .
n -, iso -, neo - er skrevet med små bokstaver og kursiv, cyclo - derimot, vanligvis bare i uorganiske forbindelser. I organiske forbindelser brukes "Cyclo" ofte som en del av navnet, skilles ikke med bindestrek og blir også tatt i betraktning ved alfabetisk sortering.
sek -, tert -
Prefiksene sec - og tert - brukes til å identifisere substituentmiljøet i et molekyl. Den nøyaktige posisjonen til substituenten er ikke spesifisert, men bare substitusjonsmønsteret til nabatomet (vanligvis et karbonatom). I n- butanol er for eksempel OH-gruppen på et primært karbonatom, i sec- butanol på et sekundært og i tert- butanol er det bindende karbonatom tertiært .
Begrepene sec - og tert - anses å være utdaterte og anbefales bare for usubstituert sec- Butoxy- og sec- Butyl- eller for tert- Butyl-. Det finnes en rekke stavemåter som "sec-butyl-", "s-butyl-", "sBu-", "Bu s -", som også regnes som utdaterte.
spiro
I nomenklaturen for organiske forbindelser beskriver prefikset “spiro” etterfulgt av en Von Baeyer-deskriptor forbindelsen til ringsystemer med bare ett vanlig atom, spiroatomet. Hvis molekylet inneholder flere spiroatomer, får prefikset “spiro” et prefiks som tilsvarer antall spiroatomer (“dispiro”, “trispiro” osv.). Typografisk settes "spiro" normalt.
catena -
Begrepet catena - brukes i uorganisk nomenklatur for å beskrive lineære, kjedelignende polymerer som består av identiske polyatomiske enheter. Catenatriphosphazenene er et eksempel på dette . Beslektede forbindelser innen organisk kjemi er katenanene .
Stereokjemiske beskrivelser som beskriver absolutte konfigurasjoner
( R ) -, ( S ) -
De stereokjemiske deskriptorene ( R ) - (fra Latin rectus = høyre) og ( S ) - (fra Latin sinister = venstre) tjener til å tydelig beskrive den absolutte konfigurasjonen til et stereosenter, vanligvis et chiralt karbonatom. For dette formålet prioriteres alle substituenter ved stereosenteret i henhold til CIP-reglene, og substituenten med lavest prioritet (“D”) rettes bort fra synsfeltet. Hvis de gjenværende substituentene i synkende prioritetsrekkefølge ("A" → "B" → "C") beskriver en sirkel med rotasjonsretning mot venstre, er stereosentret konfigurert til å være ( S ); hvis rotasjonsretningen er til til høyre tildeles stereosenteret ( R ) - konfigurasjon tildelt.
Hvis et molekyl inneholder flere stereosentrere, må deskriptoren innledes med et lokant (for eksempel i (1 R , 2 S ) -2-amino-1-fenyl-propan-1-ol, det systematiske navnet på norefedrin ). Hvis alle stereosentrere er konfigurert på samme måte, kan navnet på lokalbefolkningen utelates til fordel for "(all- R ) -" eller "(all- S ) -".
Typografisk er ( R ) - og ( S ) - med store bokstaver og kursiv; de ofte foregående stedene, de rundtliggende parentesene og kommaene er satt med vanlige bokstaver.
( r ) -, ( s ) -
Beskrivelsene ( r ) - og ( s ) - brukes til å beskrive den absolutte konfigurasjonen av pseudo-asymmetriske (pseudokirale) sentre. Pseudo-asymmetri oppstår når fire forskjellige substituenter er bundet til et karbonatom, hvorav to bare skiller seg i sin absolutte stereokjemiske konfigurasjon. Eksempler er tropanalkaloider og deres opprinnelige forbindelse tropin , systematisk (1 R , 3 r , 5 S ) -8-metyl-8-azabicyclo [3.2.1] oktan-3-ol: Karbonatomet C-3 som - OH-gruppen er bundet er pseudo-asymmetrisk; den stereokjemiske beskrivelsen i det systematiske navnet er skrevet med små og kursiv.
D -, L -
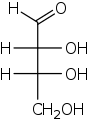
D - glukose i Fischer-projeksjonen.
Rød: gruppe med høyest prioritet,
blå: for å bestemme D - / L - relevant gruppe,
lilla: gruppe med achiral karbonatom
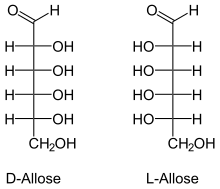
Stereo-deskriptorene D - (fra Latin dexter 'høyre') og L - (Latin laevus 'venstre') brukes til å beskrive konfigurasjonen av α- aminosyrer og sukker . Det romlig strukturerte molekylet må først noteres i en klart definert betegnelse som et todimensjonalt bilde (" Fischer projection "). Her er karbonatomet med høyest prioritet i henhold til de normale nomenklaturreglene plassert på toppen og den andre karbonkjeden er plassert vertikalt under den. For tildeling av D - eller L - er det chirale karbonatomet avgjørende, som er lengst borte fra gruppen med høyest prioritet. Hvis resten på dette C-atomet (vanligvis en OH-gruppe) er til venstre for karbonkjeden, kommer molekylet fra L- serien. Hvis resten er til høyre, er det beskrevet med beskrivelsen D -.
Beskrivelsene D - og L - er skrevet med små bokstaver og skilt fra resten av navnet med bindestrek.
meso -
Beskrivelsen meso - betegner forbindelser som har to (eller høyere jevnt antall) stereogene sentre og kan eksistere i minst en konformasjon som har en c s- symmetri, dvs. H. en roterende speilakse eller speilplan eller punktsymmetri . Molekyler som oppfyller denne definisjonen er achirale og optisk inaktive. Et eksempel på dette er meso - vinsyre .
meso - er skrevet med små bokstaver og i kursiv foran stoffnavnet.
( P ) -, ( M ) -
( P ) - Heptahelicene
De Enantiomerene av aksielt kirale forbindelser er identifisert med de stereokjemiske deskriptorer “pluss” ( P ) - og “minus” ( M ). Den notasjon ( R ) og ( S ), i mer kompliserte tilfeller også R en og S en , hvor indeksen “a” står for “aksiell” blir også brukt.
Spiralformede (spiralformede) molekyler (for eksempel helikener ) er også beskrevet med deskriptorene ( P ) - og ( M ) -, hvor molekyler med høyrehendt helix tildeles deskriptoren ( P ) -, de med venstrehåndede helix er tildelt deskriptoren ( M ) -.
Beskrivelsene ( P ) - og ( M ) -, som ( R ) - og ( S ) -, er plassert i kursiv og i runde parenteser foran stoffnavnet.
Stereokjemiske beskrivelser som beskriver ukjente konfigurasjoner
( RS ) -
Hvis den absolutte konfigurasjonen til et stereosenter ikke er kjent, blir den beskrevet med ( RS ) -, et annet stereosenter i det samme molekylet kan da refereres til som ( SR ) - for å indikere den motsatte absolutte konfigurasjonen .
( R * ) -, ( S * ) -
Hvis den absolutte konfigurasjonen til et stereosenter derimot er kjent, men en eller alle de andre stereosentrene er ukjente, fungerer den kjente konfigurasjonen som en referanse, de andre stereosentrene er merket med ( R * ) - eller ( S * ) - i henhold til deres relative konfigurasjon til referansesenteret .
Relativ konfigurasjon av racemates
Noen ganger brukes beskrivelsene ( R * ) og ( S * ) også for å indikere den relative konfigurasjonen av racemates, f.eks. B. so: (1 R * , 2 R * ) - (±) er en 1: 1 blanding (racemat) av enantiomeren med (1 R , 2 R ) -konfigurasjon og enantiomeren med (1 S , 2 S ) -Konfigurasjon. I kontrast er (1 S * , 2 R * ) - (±) en 1: 1 blanding (racemat) av enantiomeren med (1 S , 2 R ) konfigurasjon og enantiomeren med (1 R , 2 S ) konfigurasjon. Denne nomenklaturen er vanlig, men overholder ikke IUPAC-reglene.
(ξ) -, (Ξ) -, ξ-, Ξ-
Den greske bokstaven Xi kan også brukes til å betegne et stereosenter med ukjent konfigurasjon. Typografien er tilpasset beskrivelsen, som må brukes i tilfelle en viss stereokjemisk konfigurasjon: En liten ξ- uten parentes står for " c / t -", " cis / trans -", " endo / exo - "eller" anti / syn - "; ( r / s ) - derimot, erstattes av (ξ) - med parentes. Stor bokstav står steht - for " D -" eller " L -" og med parentes ( Ξ ) - for "( R ) -" eller "( S ) -" eller "( E ) -" eller "( Z ) -".
rel -
Hvis de absolutte konfigurasjonene av stereosentrene i et molekyl ikke er kjent, men deres relative konfigurasjon til hverandre er bestemt, blir de identifisert med prefikset rel -. For eksempel, ( rel -2 R , 3 S , 4 R ) -heksan-2,3,4-triol skal forstås som å bety at molekylet enten i (2 R , 3 S , 4 R ) -konfigurasjon, eller som (2 S , 3 R , 4 S ) isomer.
Beskrivelsen rel - er skrevet med små bokstaver og i kursiv rett foran det første stedet for det systematiske stoffnavnet.
Stereokjemiske beskrivelser for beskrivelse av blandinger av enantiomerer
I systematiske navn skal mangelen på klare stereokjemiske beskrivere tolkes som en indikasjon på tilstedeværelsen av et racemat.
rac -
Betegnelsen rac - foran navnet tjener til å avklare det faktum at en ekvimolær blanding av enantiomerer er tilstede som ikke viser noen optisk aktivitet. (±) symbolet er synonymt med dette.
ambo -
Uttrykket ambo - (fra latin ambo = begge deler) brukes i stedet for ( RS ) - eller rac - hvis de to isomerer ikke er akkurat i forholdet 1: 1, men bare omtrent tar dette blandingsforholdet, eller det nøyaktige blandingsforholdet er ukjent er. Beskrivelsen ambo - er skrevet med små bokstaver og kursiv foran navnet på molekylet eller den aktuelle delstrukturen (eksempel: L- alanyl- ambo -leucin).
Stereokjemiske beskrivelser som beskriver relative konfigurasjoner
α-, β-
karbohydrater
Beskrivelsene α- og β- brukes innen karbohydratkjemi for å beskrive konfigurasjonen av det såkalte anomere karbonatomet i forhold til et referanseatom. Det anomere karbonatom (også kjent som “anomere senter”) er karbonatomet av aldoser eller ketoser , som blir omdannet fra den prochirale til ringform (for semi-acetal eller halv ketal pyranose formen eller furanoseform ) under overgangen fra åpen kjede til ringen danner nytt stereosenter. I henhold til reglene for nomenklaturen i ringen har det anomere sentrum høyeste prioritet og har derfor lokantnummeret 1. Referanseatomet er det chirale atomet med det høyeste lokalitetstallet i molekylet. Hvis det anomere sentrum og referanseatomet er i samme konfigurasjon ( R / R ) - eller ( S / S ) -, så er det β-anomeren, i ( R / S ) -konfigurasjonen er α-anomeren til stede.
Den anomere beskrivelsen α eller β, atskilt med bindestrek, plasseres rett foran konfigurasjonsbeskrivelsen D - eller L - og navnet på molekylet.
Steroider
Beskrivelsene α - og β - brukes også i sammenheng med steroidnomenklaturen . Her blir substituenter som er i halvområdet over ringens plan vanligvis referert til som β- posisjon, de under ringplanet som α- posisjon. For eksempel er 13-metylgruppen i østran i β- posisjonen.
Hvis beskrivelsene α - og β - refererer til steroider eller strukturelt lignende naturlige stoffer med sammenkoblede ringer, er de festet direkte til de respektive stedene og er satt i kursiv.
threo -, erythro -
De stereokjemiske navnene threo - og erythro - er avledet fra konfigurasjonen av forbindelsene threose og erythrose og kan overføres til forbindelser med nøyaktig to nabostereosentratorer. Hvis restene (for det meste OH-grupper) ved disse stereosentrene er arrangert på samme side i Fischer-projeksjonen , er det en erytroforbindelse ; hvis restene arrangeres vekselvis, er det en treo- forbindelse.
IUPAC anbefaler ikke lenger bruk av threo - og erythro - i stedet er den mer presise ( R ) - / ( S ) eller ( l ) - / ( u ) nomenklaturen å foretrekke i mer kompliserte tilfeller .
( l ) -, ( u ) -
For å klassifisere en forbindelse med to stereosentrere som ( l ) - (fra like ) eller ( u ) - (fra ulikt ), vurderes det om konfigurasjonen til de to stereosentrene er identisk i henhold til CIP-reglene , dvs. ( R , R ) eller ( S , S ) er - i dette tilfellet er det en lignende ( l ) forbindelse, for ( R , S ) eller ( S , R ) en ulik ( u ) forbindelse.
( l ) - eller ( u ) - er plassert foran stoffnavnet med små kursive bokstaver i runde parenteser med bindestrek.
ent -, epi -
Prefikset ent - (kort for enantio -) foran navnet på en kjemisk forbindelse, vanligvis en naturlig substans , brukes til å indikere at forbindelsen som er beskrevet har en stereokjemi som er et speilbilde av stereokjemien til referanseforbindelsen (“ enantiomer ”).
I kontrast ble beskrivelsen epi - brukt til å indikere at nøyaktig ett stereosenter er konfigurert som et speilbilde av den naturlig forekommende forbindelsen.
allo -
Prefikset allo - (fra gresk allos = noen andre) brukes til flere forskjellige ting. I karbohydratområdet karakteriserer den en relativ konfigurasjon av fire stereogene sentre, som tilsvarer den til allosen , der alle OH-grupper ligger på samme side av karbonkjeden i Fischer-projeksjonen.
I området med nomenklaturen for aminosyrer med to chirale sentre ble navnet tidligere tildelt aminosyrediastereomeren som ble oppdaget først. Det vanlige navnet på diastereomeren som ble funnet eller syntetisert nedenfor, ble deretter gitt prefikset allo -. Denne metoden ble bare brukt for trivielle navn, ikke for semisystematiske eller systematiske navn, og anbefales nå bare for allo - isoleucin og allo - treonin .
Prefikset allo - plasseres alltid med små bokstaver og kursiv foran navnet, men det er kjemiske forbindelser der "Allo-" er en del av navnet (for eksempel allocinnamic acid eller alloocimen ), her skal det unngås at "Allo" foran med små og kursiv blir.
Beskrivelser for å beskrive fysiske egenskaper
(+) -, (-) -, (±) -
En fysisk egenskap ved ikke-racemiske blandinger av chirale forbindelser er deres evne til å rotere planet for polarisert lys gjennom en viss vinkel. Denne rotasjonsvinkelen avhenger av konsentrasjonen av løsningen, løsningsmidlet og lengden på målebanen.
For å navngi kirale forbindelser kan følelsen av rotasjon av den optiske rotasjonen også gis (i tillegg til det systematiske navnet og den absolutte stereokjemiske konfigurasjonen). For dette formålet innledes stoffnavnet med et av tegnene (+) - eller (-) -.
Racemiske blandinger av forbindelser med bare ett stereosenter er beskrevet med et prefiks (±) -.
Ingen direkte konklusjoner om den absolutte konfigurasjonen av et molekyl kan trekkes fra (+) - / (-) - spesifikasjonen, deskriptorene (+) - og (-) - er verken med ( R ) - og ( S ) -, ei heller med D - og L - ekvivalent. Fra beskrivelsen (±) - følger det imidlertid at en blanding av stoffer (racemat = 1: 1 blanding av to enantiomerer) er tilstede, dvs. H. (±) - tilsvarer beskrivelsene ( RS ) - og DL -.
Subtraksjonsprefikser
Subtraksjonsprefikser som Des- , Nor- og Anhydro- indikerer at noe har blitt delt fra en moderforbindelse eller at noe ”mangler”.
Se også
Individuelle bevis
- ↑ Oppføring på stereodescript . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.S05976 Versjon: 2.3.1.
- ↑ Oppføring på cis-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på trans-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- UP IUPAC-regler E-2, E-3 (PDF; 542 kB).
- ↑ IUPAC-regel R-7.1.1 .
- ↑ Oppføring på cis, trans . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.C01092 Versjon: 2.3.2.
- ↑ Oppføring på s-cis-. I: Römpp Online . Georg Thieme Verlag, åpnet 20. oktober 2019.
- ↑ adgang til E, Z . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.E01882 Versjon: 2.3.2.
- ↑ Oppføring på Ortho-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på Met (a) .... I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på Para-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på exo-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på endo-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ a b Oppføring på endo, exo, syn, anti . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.E02094 Versjon: 2.3.2.
- ↑ a b oppføring på syn-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på Anti-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på fak-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ^ Oppføring på Mer. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på fak- . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.F02313 Versjon: 2.3.2.
- ↑ oppføring til mer- . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.M03828 Versjon: 2.3.2.
- ↑ Oppføring på Iso .... I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på Neo .... I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på Cyclo .... I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ IUPAC-regler A-2.1, A-2.25 .
- ↑ a b c IUPAC-regel R-9.1, tabell 19b .
- ↑ Oppføring på syklo- . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.C01495 Versjon: 2.3.2.
- UP IUPAC-regler A-2.25 , C-205.1 , R-5.5.1.1 .
- ↑ IUPAC-regel R-9.1 , tabell 26b.
- ^ IUPAC-regel A-2.25 .
- ↑ Oppføring på sek. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på tert-butyl .... I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ IUPAC: Nomenklatur for Spiro-forbindelser , tilgjengelig 23. mai 2016.
- ↑ Oppføring på catena- . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.C00903 Versjon: 2.3.2.
- ↑ Oppføring på katena-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ S. Gorter og GC Verschoor: Krystallstrukturen til catena-tri-µ 2 - (1,12-dodecanedinitrile) kobber (II) heksaklorantimonat (V) Cu (C 12 H 20 N 2 ) 3 (SbCl 6 ) 2 . I: Acta Cryst. (1976). B32, 1704-1707, doi : 10.1107 / S0567740876006262 .
- ↑ IUPAC-regler D-4.4, I-9.7.3 og I-10.8.3.5.
- ↑ Oppføring av CIP-regler. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ inngang knyttet til R, S . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.R05423 Versjon: 2.3.2.
- ↑ Oppføring på pseudo-asymmetrisk karbonatom . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.P04921 .
- ↑ Oppføring på d, l, dl . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.D01512 Versjon: 2.3.2.
- ^ Oppføring på Fischer-Rosanoff-stevne (eller Rosanoff-stevne) . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.F02392 Versjon: 2.3.2.
- ↑ Oppføring på d. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ K.-H. Hellwich: stereokjemi. Springer, 2007, ISBN 3540717080 . S. 11 ( begrenset forhåndsvisning i Google Book-søk).
- ↑ Bernhard Testa: Fundamentals of Organic Stereochemistry , Verlag Chemie, Weinheim, 1983, s. 54–56, ISBN 3-527-25935-X .
- ↑ Oppføring på meso-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på meso . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.M03838 Versjon: 2.3.2.
- ↑ inngang til aksial chiralitet . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.A00547 Versjon: 2.3.2.
- ↑ Oppføring av helisitet . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.H02763 Versjon: 2.3.2.
- ↑ a b oppføring på RS. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring av relativ konfigurasjon . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.R05260 Versjon: 2.3.2.
- ↑ Oppføring av konfigurasjon. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Bernhard Testa: Fundamentals of Organic Stereochemistry , Verlag Chemie, Weinheim, 1983, s. 57–58, ISBN 3-527-25935-X .
- UP IUPAC: Nomenklatur og symbolikk for aminosyrer og peptider (Anbefalinger 1983) (PDF; 539 kB), s. 601.
- ↑ Oppføring på ξ. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på Ξ. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på rel. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring av relativ konfigurasjon . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.R05254 Versjon: 2.3.3.
- ↑ Oppføring på rac-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på racemat . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.R05025 Versjon: 2.3.2.
- ↑ Oppføring på ambo-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på ambo . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.A00261 Versjon: 2.3.2.
- ↑ Oppføring på anomerer. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ a b Oppføring på α (alfa), β (beta) . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.A00003 Versjon: 2.3.2.
- ^ IUPAC: Nomenklatur for karbohydrater 2-Carb-6 og 2-Carb-7 (Anbefalinger 1996).
- ^ GP Moss: Nomenklatur for steroider (Anbefalinger 1989) . I: Ren og anvendt kjemi . Volum 61, utgave 10, s. 1783-1822, doi : 10.1351 / pac198961101783 .
- ↑ Oppføring på tre-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på Erythr (o) .... I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring på erytro, treo . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.E02212 Versjon: 2.3.2.
- ↑ oppføring til l, u . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.L03423 Versjon: 2.3.2.
- ↑ oppføring til un-. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ IUPAC-regler F-6.4, RF-10.3
- ↑ Oppføring på epi-. I: Römpp Online . Georg Thieme Verlag, åpnet 6. mai 2013.
- ↑ a b Oppføring på Allo…. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.
- ↑ Oppføring i allo-in aminosyrenomenklatur . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.A00239 Versjon: 2.3.2.
- ↑ Oppføring av optisk aktivitet. I: Römpp Online . Georg Thieme Verlag, åpnet 14. september 2012.