Linde prosess

The Linde prosess er en teknisk metode for gass-separasjon utviklet ved Carl von Linde på 1,895 , noe som gjør det mulig for flytendegjøring av gassblandinger, slik som luft og de enkelte atmosfæriske gasser , slik som oksygen , nitrogen og argon ( edelgasser ) i store mengder, og, i denne fornuftig, generering av kulde i temperaturområdet 77 til 100 Kelvin (K) brukes.
historie
Selv om det først bare ble brukt til akademiske formål, ble det først brukt i industrien så tidlig som i 1902 som en viktig del av luftseparasjonsanlegget (teknisk forkortelse: LZA) også utviklet av Carl von Linde. Selv i dag brukes luftseparasjonsanlegg i stor skala for å utvinne gassformig og flytende oksygen (GOX og LOX (fra flytende oksygen) - som teknologikoder), nitrogen (GAN og LIN ) og edelgasser . I kontrast blir ikke Linde-prosessen i sin opprinnelige struktur lenger brukt til å generere kulde, ettersom mer effektive tekniske implementeringer (stempelutvidere eller ekspansjonsturbiner ) har blitt utviklet i mellomtiden . Deres kalde generasjon er ikke lenger basert på den rene Joule-Thomson-effekten av den opprinnelige Linde-prosessen, men snarere på å oppnå så adiabatisk avkjøling som mulig mens man oppnår nyttig mekanisk energi fra den ekspanderende gassen. I den opprinnelige Linde-prosessen, derimot, eller med den rene gassutvidelses-isenthalpiske Joule-Thomson-effekten, blir ikke denne energien ikke bare brukt, men den forblir til og med i prosessen som gassfriksjonsvarme som er skadelig for prosessen . Denne z. B. en helium-kondensering uten forkjøling med den opprinnelige rene gassutvidelses-isenthalpiske Linde-prosessen på grunn av den lave inversjonstemperaturen til helium umulig, men med den forbedrede prosessen, fordi fjerning av mekanisk nyttig energi under utvidelsen av en gass under adiabatiske forhold, uavhengig av gasstype og gasstemperatur, fører alltid til avkjøling. Bruk av Joule-Thomson-effekten er derfor fortsatt i bruk.
prinsipp
Den isenthalpiske ekspansjonen av en ekte gass i gasspedalen ledsages av en endring i temperaturen ( Joule-Thomson-effekten ). Den abstrakte modellen av den ideelle gassen viser ikke denne effekten. Hvorvidt temperaturendringen skjer i form av kjøling eller oppvarming, avhenger av om temperaturen har falt under inversjonstemperaturen (dvs. temperaturen der Joule-Thomson-koeffisienten til gassen gjennomgår en forandring i tegnet). Hvis systemet er over inversjonstemperaturen, varmes gassen opp under ekspansjon (mer presist: isenthalpisk ekspansjon, entalpien endres ikke på grunn av volumendring), lavere temperaturer resulterer i avkjøling; denne effekten brukes i Linde-prosessen. (Merk: en isenthalpisk ekspansjon oppstår i henhold til den første loven om termodynamikk i en gass hvis endringen i potensialet og den kinetiske energien til flytende væske fra gassinntak til gassutløp kan neglisjeres, og det kan antas at gassen er adiabatisk isolert .)
For å oppnå koketemperaturen, som er lav for mange gasser (for oksygen -183 ° C, for nitrogen -196 ° C), brukes den ekspanderte gassen i motstrømningsprinsippet for å forkjøle komprimert gass.
applikasjon
Linde-prosessen ble tidligere brukt til å avkjøle atmosfæriske gasser oksygen , nitrogen , argon og andre edelgasser til de flytende.
Flytende luft
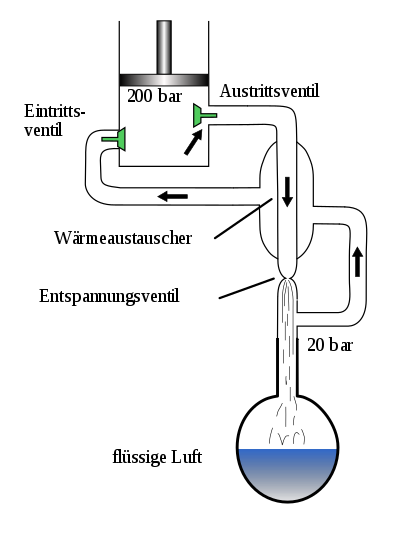
En kompressor komprimerer luften til et trykk på ca. 200 bar . Temperaturen deres øker med ca. 45 Kelvin, for eksempel fra +20 ° C til ca. +65 ° C. Den komprimerte, oppvarmede luften blir deretter avkjølt i en første varmeveksler, og temperaturen returneres til omgivelsestemperaturens område. I prosessen frigjøres varme fra luftets flytende system til miljøet. Luften vaskes først og frigjøres fra vanndamp, støv, hydrokarboner, lystgass og karbondioksid ved hjelp av en molekylsikt . Hydrokarboner og lystgass kan forårsake en deflagrasjon eller til og med en eksplosjon i rettingskolonnen . Luften ekspanderes deretter ved hjelp av en turbin, hvorved temperaturen på luften synker til like før fortettingspunktet. Luften føres deretter gjennom en gassventil, hvor luften deretter når kondenspunktet (ca. -170 ° C).
Ingeniøren Fränkl lyktes i å erstatte motstrømsrekuperatorene med regeneratorer. Disse kan bygges mye mindre, billigere og kraftigere enn motstrømsrørbuntvarmevekslere . Denne oppfinnelsen ble overtatt av Linde AG og markedsført under navnet Linde-Fränkl-Verfahren. Prosessen med regeneratorer ble brukt med suksess til rundt 1990, da en nyere teknologi dukket opp som igjen inkluderte rekuperative motstrøms platevekslere med oppstrøms adsorberende tørking og rengjøring.
Flytende luft har en tetthet på ca. 875 kg / m³ (0,875 g / cm3). I en åpen beholder under atmosfærisk trykk antar den en temperatur på -194,25 ° C = 78,9 K. Det koker, slik at den lave temperaturen opprettholdes, fordi dette fjerner fordampningsvarmen fra den flytende luften . Siden oksygen og nitrogen har forskjellige koketemperaturer, fordamper nitrogenet raskere og koketemperaturen til den gjenværende væsken stiger litt, opp til 81,7 K. Mengden kokeluft reguleres på en slik måte at varmen som tilføres ved ledning eller stråling blir lik fordampningsvarmen som forbrukes er. Avhengig av størrelsen og isolasjonen på beholderen, kan den flytende luften holdes i noen timer til mange dager. Imidlertid må flytende luft aldri lagres i lukkede beholdere uten sikkerhetsanordninger og passende design, da det indre trykket, som øker gradvis på grunn av oppvarming, vil føre til at det sprekker.
Fraksjonere den flytende luften
Flytende luft kan brytes ned i dets bestanddeler ved hjelp av fraksjonering ved å bruke de forskjellige kokepunktene til de enkelte luftbestanddelene. Kokepunktene for oksygen og nitrogen er imidlertid veldig tett sammen. En rektifikasjonskolonnen blir derfor benyttet : den flytende luft renner nedover over flere likerettede skuffer i motstrøm til den oppstigende gass. Den absorberer oksygen fra gassen og frigjør nitrogen. Rektifiseringen utføres ved et trykk på ca. 5-6 bar. Dette gjør væsken mer oksygenholdig og gassen mer nitrogenholdig.
Liquefaction av hydrogen og helium
For å kunne bruke Linde-prosessen for hydrogen- og helium- flytende, må disse gassene først avkjøles under inversjonstemperaturen . Dette gjøres vanligvis med flytende luft. Det flytende helium som til slutt oppnås, koker under atmosfæretrykk ved 4,2 K. Dette er det laveste kokepunktet for alle grunnstoffene. Ved å pumpe ut heliumgassen over det kokende heliumet blir fordampningsvarmen ekstrahert fra sistnevnte, slik at temperaturen kan reduseres ytterligere. Siden damptrykket faller veldig kraftig med temperaturen, når denne metoden imidlertid ikke en temperatur lavere enn 0,84 K; det inkluderer damptrykk 0,033 mbar.
Fysiske grunnleggende
Linde-metoden er basert på Joule-Thomson-effekten: i den ideelle gassen samhandler ikke partiklene med hverandre, og det er derfor temperaturen på den ideelle gassen ikke avhenger av volumet. Når det gjelder ekte gasser, er det imidlertid interaksjoner som er beskrevet ved hjelp av Van der Waals-ligningen . Energiinnholdet i den virkelige gassen endres også med adiabatisk (uten varmeutveksling) avslapning uten eksternt arbeid. Dette kan bevises ved endring i temperatur.
Hvis du kobler to gassbeholdere med en porøs vegg og bruker et stempel for å sakte skyve gassen under trykk i rom 1 gjennom denne membranen, som tjener til å forhindre virvler og stråledannelse, i rom 2, som er under et konstant, men lavere trykk enn rom 1 så er det en liten temperaturforskjell mellom de to rommene. Med karbondioksid er det omtrent 0,75 K per bar trykkforskjell, med luft omtrent 0,25 K.
Dette kan forklares hvis du vurderer at volumet i rom 1 er fjernet. Stempelet har gjort arbeidet for gassen . Mengden gass vises i rom 2 og må utføre arbeidet mot stempelet. Forskjellen i arbeid har gitt gassen som intern energi.
- eller.
Den entalpi forblir konstant. I Van der Waals er gass den indre energien , hvor er antall frihetsgrader for en partikkel.
Tar vi hensyn til Van der Waals-ligningen , resulterer dette i :
Fordi entalpi beholdes, gjelder følgende for den totale differensialen :
Transformert etter temperaturendringen :
Telleren er positiv ved høy temperatur. Den endrer tegnet ved inversjonstemperaturen .
Så den kritiske temperaturen for en van der Waals-gass er .
Ovenfor varmes en gass opp når den slippes ut, under den avkjøles. For karbondioksid og luft er godt over romtemperatur, men for hydrogen, men ved -80 ° C.
En høy verdi av Van der Waals-konstanten har derfor den effekten at temperaturen synker kraftig når den virkelige gassen utvides. Dette er logisk, for når volumet øker, beveger molekylene seg fra hverandre og må arbeide mot tiltrekningskreftene preget av . Dette arbeidet reduserer molekylenes kinetiske energi og dermed temperaturen på gassen.
Alternative prosedyrer
To nyere prosesser brukes til mer kostnadseffektiv produksjon av nitrogen og oksygen i en renhet tilpasset kravene:
- Membrangasseparasjon ( engelsk membrangasseparasjon (MGS) ): diffusjon gjennom hulfibermembranen kan være nitrogen med høy renhet og oksygen på opptil 40% anrikningsgrad gir trykkluft.
- Ved hjelp av trykksving adsorpsjon ( engelsk trykksving adsorpsjon (PSA) ) på molekylsikt , kan CMS - karbonmolekylsikt nitrogen eller zeolitter - "Zeo molekylsikt" er oksygen kan spaltes luft via trykksving i to trykkbeholdere.
litteratur
- Christian Gerthsen , Hans Otto Kneser , Helmut Vogel : Fysikk: en lærebok for bruk i tillegg til forelesninger . 14. utgave. Springer, Berlin / Heidelberg 1982, ISBN 3-540-11369-X , kapittel 5.6.6 og 5.6.7.
- Georg Veranneman: Tekniske gasser. Produksjon, distribusjon, anvendelse (= Library of Technology , bind 10), 4. utgave, Verlag Moderne Industrie, Landsberg am Lech 2000, ISBN 3-478-93229-7 .
weblenker
- Linde-videoer som viser luftseparasjonsprosessen visuelt:
- fra planteperspektivet: https://www.youtube.com/watch?v=-mUKww4iPgw
- fra gassperspektivet: https://www.youtube.com/watch?v=flvW0vTQ1NM
- Informasjon om helium flytende midler fra Linde
- SVGs: Separasjon kolonne , anlegg basert på lav-trykksprosess
- Video: JOULE-THOMSON-effekt og LINDE-metode - Hvordan lager du flytende luft? . Jakob Günter Lauth (SciFox) 2013, gjort tilgjengelig av Technical Information Library (TIB), doi : 10.5446 / 15652 .
Individuelle bevis
- ↑ nitrogengenerator - N2 AIRTEXX gassystemer og utstyr hentet 27. april 2013