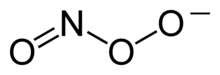
Peroksynitritt

Den peroxynitrite anion (ONOO- - ), hører til de reaktive nitrogen- eller oksygenforbindelser (RNOS; reaktive nitrogenoksidarts eller ROS-; reaktive oksygenarter ). I en organisme kan disse forbindelsene reagere med andre forbindelser (proteiner, DNA) og forårsake skade.
Peroxynitrite anioner som følge av rekombinasjon av nitrogenmonoksid - og superoksid - radikaler .
Superoksider og nitrogenmonoksid ( • NO) dannes kontinuerlig i stoffskiftet i mange forskjellige prosesser, for eksempel dannelse av NO fra nitritt, av NO-syntase (NOS), i sammenheng med immunsystemet, ved automatisk oksidasjon av biologiske molekyler eller i reaksjoner av xantinoxidase ( XO).
Verken superoksid eller NO er giftige in vivo så lenge begge ikke forekommer i ikke-fysiologisk høye konsentrasjoner eller sammen. Superoksydradikaler defuseres veldig raskt ved hjelp av superoksyd-dismutaser (SOD) eller peroksidaser (O 2 • - → H 2 O 2 → O 2 , H 2 O). I motsetning til dette reagerer NO overveiende med oksygenert hemoglobin for å danne nitrater.
På grunn av disse og andre beskyttelsesmekanismer (for eksempel glutation , askorbinsyre , tokoferol ), bør dannelsen av enda mer giftige stoffer forhindres. Hvis dette ikke skjer, kan peroksynitrittioner og hydroksylradikaler ( • OH) oppstå.
På grunn av deres høye reaktivitet reagerer hydroksylradikaler veldig raskt med den nærmeste forbindelsen. Peroksinitritter har derimot lengre halveringstid og kan dermed reagere mer selektivt med forbindelser. De brukes for eksempel av makrofager for å avverge bakterier. De er meget potente celletoksiner og oppstår fra diffusjonskontrollerte reaksjoner mellom NO- og superoksydradikaler (O 2 • - + • NO → ONOO - ). Peroksynitritter oppstår derfor raskt når NO og superoksider produseres samtidig i store mengder eller ikke kan brytes tilstrekkelig ned. For eksempel kan dannelsen av peroksynitrittioner øke en million ganger under sterkt proinflammatoriske forhold. Siden superoksydradikaler diffunderer mye dårligere enn NO-radikaler og har kort halveringstid, er dannelsen av peroksynitritt primært assosiert med dannelsen av superoksydradikaler. Peroksynitrittioner i seg selv kan utvikle sin skadelige effekt innen en til to cellediametre med en (fysiologisk) halveringstid på rundt 10 ms.
Peroksinitritter eller de resulterende radikaler kan skade enzymer , genetisk materiale ( DNA ), mitokondrier og membraner ; Signalkaskader kan endres eller forstyrres; dannelsen av Lewy-legemer er favorisert og til slutt kan apoptose initieres eller nekrose kan forårsakes. Vaskulære og kardiovaskulære sykdommer, sirkulasjonssjokk , immunforsvarssykdommer , smerte, nevrodegenerasjon, aldring og andre er assosiert med utvikling av peroksynitritt.
Peroksynitrittioner reagerer med det alltid tilstede karbondioksidet for å danne den kortvarige nitrosoperoksykarbonationen, som brytes ned i to svært reaktive radikaler som er ansvarlige for DNA-skaden av peroksynitritter:
- ONOO - + CO 2 → ONOOCOO - → NO 2 • + CO 3 • -
De fleste av de mange endogene og eksogene peroksynitritt-"scavengers" eller "nøytralisatorer" samhandler bare med sekundære radikaler (for eksempel med • OH, • NO 2 , CO 3 • - ) og har derfor bare begrenset eller lav effektivitet . Metalloporfyriner reagerer derimot (f.eks. Oksygenert hemoglobin ) direkte og raskt med peroksynitritt. Fe (III) porfyriner inaktiverer peroxynitrite ioner ved isomerisering av dem til nitrationer . Tilsvarende forbindelser blir utviklet for klinisk bruk og ser ut til å tilby lovende terapeutiske alternativer for de nevnte sykdommene.
Individuelle bevis
- ↑ Szabó C, Ischiropoulos H, Radi R: Peroksynitritt: biokjemi, patofysiologi og utvikling av terapi Arkivert fra originalen 21. juli 2011. Info: Arkivkoblingen ble satt inn automatisk og er ennå ikke sjekket. Vennligst sjekk originalen og arkivlenken i henhold til instruksjonene, og fjern deretter denne meldingen. (PDF) I: Nat Rev Drug Discov . 6, nr. 8, august 2007, s. 662-680. doi : 10.1038 / nrd2222 . PMID 17667957 . Hentet 18. oktober 2010.