flamme
Ettersom en flamme er av, generelt som en del av en utgående brann , området for forbrenning eller på annen måte eksotermisk reagerende referert til gasser og damp, i lyset som sendes ut .
prosess
Strålingen som frigjøres under en reaksjon er forårsaket av lysemisjonen fra molekylbåndene og atomlinjespekteret til molekylene og atomene som er involvert i forbrenningen, samt av faste partikler og aerosoler . Faste partikler som sot eller aske avgir et strålespektrum som tilsvarer det for en svart kropp ved flamtemperaturen. Hvis det er faste partikler i flammen, dominerer deres termiske stråling .
I de fleste tekniske applikasjoner refererer begrepet "flamme" til den synlige reaksjonen av et drivstoff med det oksiderende oksygenet . Reaksjonsområdet omfatter forvarmingssonen, reaksjonssonen og likevektssonen. Flammen dannes ut av reaksjonssonen. Dette fører vanligvis til en intens glød som skarpt avgrenser reaksjonsområdet ( flammefronten ) og kan få forskjellige farger.
Flammefarge
En betydelig andel av flammefargen er forårsaket av forskjellige komponenter i reaksjonssonen:
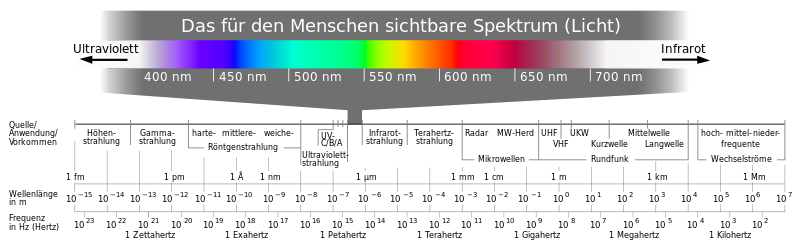
- gul til oransje: på grunn av (glødende) sotpartikler (størrelse på noen få 10 nm). Deres utslippsspektrum tilsvarer omtrent det til en svart kropp
- blå: av begeistret CO 2 , CH radikaler
- turkis: på grunn av C 2- molekyler.
I motsetning til dette har reaksjonsproduktene fra forbrenningen av hydrokarboner ( CO 2 og H 2 O ) en tendens til å stråle i det (usynlige) infrarøde spektrale området. Hvis det er urenheter i flammen, blir resultatet intens flammefarging , hvis farge avhenger av innholdet. Her bidrar strålingen fra energisk lavtliggende resonansoverganger (første opphisset tilstand) hovedsakelig til flammebelysningen. En spesielt enkel fargeendring til gul kan oppnås gjennom natriuminnholdet i bordsaltet . Denne muligheten brukes for fyrverkeri som reagerer på alle fargene i fargehjulet.
karakterisering
Det er flere måter å karakterisere en flamme på. Dette inkluderer typen flyt ( laminær eller turbulent ), forholdet mellom drivstoff og oksidasjonsmiddel og om disse allerede er blandet eller ikke blandet før forbrenning.
Når det gjelder "forblandet flamme", er det for eksempel en homogen blanding av drivstoff og oksidasjonsmiddel før forbrenningsprosessen finner sted (for eksempel blåselys og bensinmotor ). I tilfelle "ikke-forblandte flammer", møtes drivstoff og oksidasjonsmiddel bare i reaksjonssonen og reagerer der med hverandre. Forbrenningsprosessen finner sted ved grenseflaten, der gassene blandes (for eksempel lys , bål, fly turbiner og trykkforstøver olje-brennere ).
I tillegg kan en flamme beskrives ved forholdet mellom drivstoff og oksidasjonsmiddel. Flammer med overflødig drivstoff blir referert til som "fett" flammer, mens flammer med overflødig oksidasjonsmiddel er "magre" flammer. En mer presis indikasjon på hvilken blanding som er tilstede, gjøres via ekvivalensforholdet Φ (kjemisk navn) eller luftforholdet λ (teknisk navn).
- En flamme med lav andel oksygen blir referert til som reduserende flamme ( lysende flamme ). Under den pyrolytiske forbrenningsreaksjonen dannes CH- radikaler fra hydrokarbonmolekylene . Disse reagerer (blant andre reaksjoner) med dannede oksygenradikaler for å danne vanndamp. På grunn av oksygenmangel ( forbrenningsluftforhold ) dannes mer karbonmonoksid og elementært karbon i form av sot ; begge kan oksideres i varmen gjennom oksygenopptak. Flammen har reduserende effekt , oksygenfrigivende stoffer som holdes i flammen reduseres (se også boraksperle ). Den emissiviteten til den sot er ansvarlig for den intense lyset fra flammen, for sin gul farge den relativt lave forbrenningstemperaturen (omkring 1,000-1,200 ° C). Soten fra slike eksosgasser kan berolige skorsteinens indre vegger eller sote taket hvis stearinlys og oljelamper brukes intensivt.
- Oksidasjonsflammer inneholder overflødig oksygen. Under forbrenningsreaksjonen, blir det bundne karbon til hydrokarbonene (fra CC og CH-bindinger) oksyderes til karbon oksider . Oksidasjonsflammer er varmere enn reduksjonsflammer. På grunn av det lave sotinnholdet skinner de bare svakt og har blå flammefronter på grunn av kjemiluminescens (kjemiluminescens av CH-radikaler nær 314, 390 og 431 nm, av OH-radikaler med en topp nær 309 nm, av CO 2 -radikaler rundt 415 nm og C- 2 i nærheten av 510 nm).
Et flammesignal oppstår så snart en oksiderbar, trykkgassblanding plutselig kan kombineres med oksygen. Aktiveringsenergien til denne reaksjonen må oppnås av en ekstern tenningskilde, spesielt hvis antenningstemperaturen til den respektive reaksjonsblandingen overskrides.
Trivia
- Den hotteste flammen til dags dato er produsert av en reaksjon mellom dicyanoetin og ozon ved 40 bar trykk og når en flammetemperatur på rundt 6000 ° C. Den teoretiske forbrenningstemperaturen for hydrokarboner med luft er rundt 2000 ° C. Slike temperaturer, som er mulige under ideelle forhold, oppnås på ingen måte i hverdagens flammer, siden gassen avkjøles under forbrenning på grunn av strålingsutslipp. Lanseringsbilene for romsatellitter avgir også veldig varme flammer .
- Den avledede betydningen "flamme" har blitt brukt metaforisk siden 1700-tallet for en jente man er forelsket i og som man derfor er betent for. Sammenlign også tekstene med tekstene No fire, no coal can burn so hot, // Som hemmelig stille kjærlighet som ingen vet noe om. (Folkesang, 1700-tallet.)
- Varmen fra en flamme kan estimeres ved hjelp av "spektralbriller" (et leketøy til barn): Spektralbrillene bryter ned lysstrålene til flammefargen i deres spektrale komponenter, og temperaturen kan utledes fra størrelsen på lyse flekker
Se også
- Brann
- Skyting
- Kirchhoffs strålingslov
- Forbland flammen
- Diffusjonsflamme
- flammeløs forbrenning i en porøs brenner
weblenker
- Norbert Peters: Technical Combustion - Lecture Reprint, RWTH Aachen University (PDF; 3.6 MB)
Individuelle bevis
- ↑ Jürgen Warnatz, Ulrich Maas, Robert W. Dibble: Combustion - Fysikokjemisk grunnleggende, modellering og simulering, eksperimenter, generering av miljøgifter. Springer, Berlin / Heidelberg 2001, ISBN 978-3-540-42128-3 , doi : 10.1007 / 978-3-642-56451-2 .
- ↑ Krzysztof Adam Grabinski: Eksperimentell og numerisk kinetisk studie på ladede og eksiterte arter i okseldrivstoffforbrenning for CO2-fangst , Norges teknisk-naturvitenskapelige universitet, (fulltekst)
- E Johannes Eichmeier: Kombinert forbrenning av drivstoff blandet inne i forbrenningskammeret med forskjellige antennbarheter undersøkt ved hjelp av eksemplet på diesel og bensin. Logos Verlag Berlin GmbH, 2012, ISBN 978-3-832-53172-0 , s. 59 ( begrenset forhåndsvisning i Google-boksøk).
- ↑ Maurizio De Leo, Alexei Saveliev, Lawrence A. Kennedy, Serguei A. Zelepouga: OH og CH luminescens i motstrøm metan oxy-flammer. En annen viktig kilde til kjemiluminescens; , 2007, sitert av Krzysztof Adam Grabinski: Eksperimentell og numerisk kinetisk studie på ladede og eksiterte arter i okseldrivstoffforbrenning for CO2-fangst , Norges teknisk-naturvitenskapelige universitet, side 14 (fulltekst)
- Leine Madleine M. Kopp, Olivier Mathieu, Eric L. Petersen: Rate Determination of the CO2 * Chemiluminescence Reaction CO + O + M <--> CO2 * + M , 2014, sitert av Krzysztof Adam Grabinski: Eksperimentell og numerisk kinetisk studie på ladede og glade arter i forbrenning av okseldrivstoff for CO2-fangst , Norges teknisk-naturvitenskapelige universitet, 2016, side 14 (fulltekst)
- ↑ Eric Petersen, Madleine Kopp, Nicole Donato: Assessment of Current Chemiluminescence Kinetics Models at Engine Conditions , 2011, sitert av Krzysztof Adam Grabinski: Eksperimentell og numerisk kinetisk studie på ladede og begeistrede arter i oksidrivstoffforbrenning for CO2-fangst , Norsk universitet for vitenskap og Technology, 2016, side 14 (fulltekst)
- ↑ Zoltán Faragó: Stikke peisen ordentlig - se på flammene gjennom spektralbriller