Lysdiskmikroskopi

Den lette ark av fluorescensmikroskopi eller lysskiven fluorescensmikroskopi ( LSFM fra engelsk Lys Sheet Fluorescensmikroskopi , også SPIM fra engelsk enkelt plan belysning mikroskopi , selektiv flyet belysning mikroskopi , også Lys blad Mikroskopi og lys ark mikroskopi ) er et fluorescens mikroskopmetode, belyst i hvilken bare et tynt lag på prøve vanligvis noen få mikroner . Sammenlignet med konvensjonell fluorescensmikroskopi fører dette til bedre oppløsning og en betydelig redusert bakgrunnsbilde. Det reduserer også de negative effektene av bleking eller lysindusert stress i biologiske prøver.
Metoden brukes i cellebiologi og også til fluorescensstudier på levende organismer. Mange applikasjoner kan også bli funnet i langsiktige observasjoner av embryonal utvikling i modellorganismer ( utviklingsbiologi ).
Lysdiskmikroskopi, utviklet på begynnelsen av det 21. århundre, introduserte en belysningsgeometri i fluorescensmikroskopi som allerede ble brukt med suksess i mørke feltmikroskopi i en sammenlignbar form på begynnelsen av det 20. århundre med spalten ultralydsmikroskop .
konstruksjon
Grunnleggende struktur
Med denne typen mikroskopi stråles eksitasjonslys vinkelrett på observasjonsretningen (vanligvis av en laser som er tilpasset absorpsjonsbåndene til det valgte fluorescerende fargestoffet , f.eks. Fra en argonlaser ved 488 nm for grønt fluorescerende protein ). Den utvidede, kollimerte laserstrålen er bare fokusert i en retning ved hjelp av en sylindrisk linse. Resultatet er en “lysdisk” i fokus som bare lyser opp et tynt lag i prøven. For å øke linsens numeriske blenderåpning (og dermed redusere tykkelsen), brukes vanligvis en kombinasjon av en sylinderlinse og et mikroskopmål. Fluorescerende fargestoffmolekyler i det opplyste laget gleder seg til fluorescens, som deretter observeres vinkelrett på det ved hjelp av et lysmikroskop. For å ha nok plass til projeksjon av lysskiven, brukes vanligvis såkalte nedsenkningsglass med stor arbeidsavstand (f.eks. 2-3 mm med en numerisk blenderåpning på 1), som er helt nedsenket i vann eller i en bufferløsning. Av denne grunn konstrueres et vannfylt prøvekammer rundt prøven i de fleste SPI-mikroskop, som også gjør det mulig å undersøke prøven under fysiologiske forhold (f.eks. Fysiologiske saltkonsentrasjoner og 37 ° C).
Fokuseringen av forskjellige deler av prøven foregår her (i motsetning til fluorescensmikroskopi med bredt felt ) vanligvis ikke ved å flytte målet (da må posisjonen til lysplaten endres tilsvarende), men ved å flytte selve prøven.
Noen tekniske forbedringer
Siden de første implementeringene av SPIM-prinsippet har flere utvidelser blitt introdusert som forbedrer egenskapene til et SPI-mikroskop eller forenkler strukturen:
- To motstående lysplater reduserer typiske SPIM-gjenstander, for eksempel B. Shadows (se første z-stack ovenfor).
- I tillegg til de motstående lysrutene ble det i 2012 foreslått å integrere to deteksjonsarmer i et SPIM, noe som øker målingen av z og rotasjonsstabler betydelig. Begge sammen er nødvendige for en fullstendig 3D-rekonstruksjon av prøven.
- Lysdisken kan også opprettes ved å skanne et normalt laserfokus opp og ned. Denne prosessen gjør det også mulig å bruke selvbærende laserstråler, for eksempel Bessel-stråler , som betydelig øker dybden for inntrengning av lysarket inn i prøven, fordi den negative effekten av spredning på prøven reduseres.
- Med den såkalte skråplanmikroskopi (OPM) brukes deteksjonslinsen også til å projisere lysarket. Dette etterlater målet i en vinkel på ca. 60 °, og ekstra optikk i deteksjonsstrålebanen til mikroskopet brukes til å vippe brennplanet eller deteksjonsplanet tilsvarende.
- En fluorescens-eksitasjon i henhold til to-foton-prinsippet (to fotoner med dobbel bølgelengde stimulerer fluoroforen sammen) ble realisert. Fremfor alt forbedrer denne belysningsmodaliteten penetrasjonsdybden i spredning av prøver.
- SPIM ble brukt som en mikroskopiteknikk i forbindelse med fluorescenskorrelasjonsspektroskopi (SPIM-FCS) for å måle romlig oppløste mobilitetskart over fluorescerende partikler (f.eks. Fluorescerende mikrosfærer, kvanteprikker eller fluorescensmerke proteiner) i levende biologiske prøver / organismer.
- LSFM har også blitt kombinert med superoppløsnings mikroskopiteknikker for å overvinne Abbes oppløsningsgrense. Det stimulerte utslippsutarmingsprinsippet (STED) ble også implementert for objektivbelysningen for å redusere tykkelsen på linsen og dermed forbedre den langsgående oppløsningen.
Prøveholder
Separasjonen av lys- og deteksjonsstrålebanene i de fleste LSFMer og det faktum at disse for det meste er ordnet i et horisontalt plan gjør det nødvendig med spesielle prøveholdere. Prøvene blir ofte hengt opp ovenfra eller montert på en stående holder (se bilder til høyre). Det er utviklet forskjellige holdere for forskjellige prøver:
- Døde (f.eks. Faste ) og store prøver kan plasseres på en holder i prøvekammeret, f.eks. B. festes med lim.
- Større levende organismer (embryoer ...) kan senkes og deretter lukkes i en myk gelsylinder som skyves ut av et kapillær av glass eller plast
- Adherente celler får vokse direkte på små glassplater, som deretter henger ovenfra i prøvekammeret.
- Planter kan vokse i klare geler hvis gelene er laget med et passende vekst- og næringsmedium. Gelene fjernes vanligvis fra observasjonsområdet slik at de ikke forringer kvaliteten på linsen gjennom spredning og absorpsjon.
- Væskeprøver (f.eks. For SPIM-FCS) kan krympes inn i små pakninger laget av en tynn plastfilm. Det er viktig at plastfilmen har den samme brytningsindeksen som det omgivende mediet for ikke å forstyrre bildebehandlingen til SPIM.
Noen LSFM-er er også utviklet som implementerer eksitasjons- og deteksjonsstrålebanen i et oppreist plan. Dette betyr at prøver også kan settes sammen ved hjelp av standard mikroskopiske metoder (f.eks. Celler i en petriskål). En kombinasjon av en LSFM med et omvendt mikroskop under er også mulig.
Løser kraft
Med SPIM foregår observasjon via et mikroskopmål, som er nedsenket i det vannfylte prøvekammeret og avbildet prøven direkte. Den laterale oppløsningen er således fullstendig gitt av dette målet og når et maksimum på omtrent en halv bølgelengde til en bølgelengde (for eksempel med grønn fluorescens, ca. 250-500 nm). Den aksiale oppløsningen er betydelig dårligere (vanligvis med mer enn en faktor 4). Imidlertid kan det forbedres noe ved å gjøre lysarket tynnere slik at fluorescens bare blir begeistret i en del av observasjonsfokuset. Ideelt sett er den aksiale oppløsningen den samme som den laterale.
Sammenlignet med et vanlig bredfeltmikroskop er den aksiale oppløsningen betydelig bedre. For små numeriske blenderåpninger er den aksiale oppløsningen enda bedre enn for konfokale mikroskop; for større numeriske blenderåpninger er den fremdeles av en tilsvarende størrelsesorden. Sammenlignet med konfokalmikroskopi skannes ikke bildet i 3D, men i skiver hvorfra alle bildepunkter kan tas opp samtidig.
historie
På begynnelsen av 1900-tallet introduserte RA Zsigmondy ultramikroskopet, en ny belysningsmetode i mørk feltmikroskopi. Sollys eller en hvit lyslampe lyser en optisk spalte , som deretter avbildes i prøven med en linse. Små partikler som passerer gjennom lysarket som dannes på denne måten, kan observeres ved hjelp av deres spredte lys i rett vinkel mot belysningen med et observasjonsmikroskop. Dette mikroskopet tillot observasjon av partikler som er mindre enn den optiske oppløsningen til observasjonsmikroskopet, og førte til tildeling av Nobelprisen til Zsigmondy i 1925.
Den første anvendelsen av dette belysningsprinsippet for fluorescensmikroskopi var fra 1993 av Voie et al. publisert under navnet Orthogonal-planet fluorescens optisk snitting (OPFOS). På den tiden for å kartlegge den indre strukturen til sneglehuset med en oppløsning på 10 µm lateralt og 26 µm i lengderetningen, men med en prøvestørrelse i millimeterområdet. En enkel sylindrisk linse ble brukt til å forme linsen. Prosessen ble videreutviklet og forbedret fra og med 2004. Etter det ble teknologien mye brukt og har blitt tilpasset den dag i dag med nye varianter (se ovenfor). Ultramikroskop med fluorescenseksitasjon og lav oppløsning har vært kommersielt tilgjengelig siden 2010 og SPIM-mikroskop siden 2012. En god oversikt over utviklingen finner du f.eks. B. i Ref. I 2012/2013 ble de første open source- prosjektene på LSFM startet. De publiserer den komplette byggeplanen, inkludert den nødvendige programvaren for å sette opp en LSFM.
applikasjon
SPIM brukes ofte i utviklingsbiologi, der f.eks. B. muliggjør langsiktig observasjon av embryonal utvikling. Imidlertid kan det også kombineres med teknikker som fluorescenskorrelasjonsspektroskopi for å muliggjøre romlig løste mobilitetsmålinger av fluorescerende partikler (f.eks. Perler, kvantprikker, fluorescensmerkede proteiner) i (biologiske) prøver.
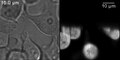
SPIM bilde av et levende celle sfæroide, hvis cellekjerner er merket med fusjonsproteinet H2B -HcRed.
SPIM-bilder av en amøbe hvis membran ble merket med DiI
HeLa-celler som uttrykker tetramerer av det grønne fluorescerende proteinet EGFP . Et overført lysbilde kan sees til venstre og et bilde tatt opp med et SPIM til høyre. Typiske SPIM-gjenstander som skyggelegging kan sees tydelig. Lyset kom inn nedenfra.
Volmetrisk rekonstruksjon av SPIM z-stacken til venstre
Brun bevegelse av fluorescerende latexperler (diameter ca. 20 nm) i vann, registrert med et SPI-mikroskop.
litteratur
- Gjennomgå artikkel:
- J. Huisken, DYR Stainier: Selektivt planbelysningsmikroskopiteknikker i utviklingsbiologi . I: Utvikling . 136, nr. 12, 22. mai 2009, s. 1963-1975. doi : 10.1242 / dev.022426 .
- PA Santi: Light Sheet Fluorescence Microscopy: A Review . I: Journal of Histochemistry & Cytochemistry . 59, nr. 2, 1. februar 2011, s. 129-138. doi : 10.1369 / 0022155410394857 .
weblenker
- Video av et typisk eksperiment fra utviklingsbiologi med SPIM : I den sammenkoblede videoen ble utviklingen av et fruktflueembryo observert i omtrent 20 timer. Den viser to projeksjoner av det komplette 3D-datasettet.
- OpenSPIM : OpenSPIM er en plattform for å bygge, tilpasse og forbedre SPIM-teknologi.
- Mikroskopi: nervekanaler av et kyllingembryo (lysskivemikroskopi)
Individuelle bevis
- ↑ Philipp J. Keller, Ernst HK Stelzer: Light disk microscopy in molecular cell biophysics In: LABORWELT. 7 år, nr 5, 2006, s 18-21 (. Online versjon ( Memento av den opprinnelige fra 20 januar 2013 i Internet Archive ) Omtale: The arkivet . Koblingen er satt inn automatisk og har ennå ikke blitt sjekket Kontroller originalen og arkiv lenke i henhold til instruksjonene og fjern deretter dette notatet .; PDF; 7,5 MB).
- ↑ U. Krzic, S. Günther, L. Hufnagel, D. von Gegerfelt, H. Karlsson, E. Illy, J. Hel: Light disk fluorescence microscopy (SPIM) and laser excitation in orange for imaging levende organismer. I: BioPhotonics. Nr. 1, 2011, s. 42-44 ( online versjon ).
- ↑ a b A. H. Voie, DH Burns, FA Spelman: Ortogonal-plan fluorescens optisk snitting: Tredimensjonal avbildning av makroskopiske biologiske prøver . I: Journal of Microscopy . 170, nr. 3, juni 1993, s. 229-236. doi : 10.1111 / j.1365-2818.1993.tb03346.x .
- ↑ a b c J. Huisken, J. Swoger, F. Del Bene, J. Wittbrodt, EH Stelzer: Optisk snitting dypt inne i levende embryoer ved selektiv planbelysningsmikroskopi . I: Vitenskap . Volum 305, nr. 5686, 2004, s. 1007-1009, doi: 10.1126 / science.1100035 , PMID 15310904 .
- ↑ Timo Mappes, Norbert Jahr, Andrea Csaki, Nadine Vogler, Juergen Popp, Wolfgang Fritzsche: The Invention of Immersion Ultramicroscopy in 1912-The Birth of Nanotechnology? . I: Angewandte Chemie International Edition . 51, nr. 45, 5. november 2012, s. 11208-11212. doi : 10.1002 / anie.201204688 .
- ↑ a b c K. Greger, J. Swoger, EH Stelzer: Grunnleggende bygningsenheter og egenskaper til et fluorescerende enkeltplan-belysningsmikroskop. I: Gjennomgangen av vitenskapelige instrumenter. Volum 78, nr. 2, 2007, s. 023705, PMID 17578115 .
- ↑ Jan Huisken, Didier YR Stainier: Selv fluorescenseksitasjon ved flerveis selektiv flyet belysning mikroskopi (mSPIM) . I: Optikkbokstaver . 32, nr. 17, 2007, s. 2608. doi : 10.1364 / OL.32.002608 .
- ^ Raju Tomer, Khaled Khairy, Fernando Amat, Philipp J Keller: Kvantitativ høyhastighetsavbildning av hele utviklende embryoer med samtidig multisyn-lysarkmikroskopi . I: Naturmetoder . 9, nr. 7, 3. juni 2012, s. 755-763. doi : 10.1038 / nmeth.2062 .
- ↑ Uros Krzic, Stefan Gunther, Timothy E Saunders, Sebastian J Streichan, Lars Hufnagel: Multiview- lysarkmikroskop for rask bildebehandling . I: Naturmetoder . 9, nr. 7, 3. juni 2012, s. 730-733. doi : 10.1038 / nmeth.2064 .
- ^ PJ Keller, AD Schmidt, J. Wittbrodt, EHK Stelzer: Rekonstruksjon av sebrafisk tidlig embryonal utvikling ved skannet lysarkmikroskopi . I: Vitenskap . 322, nr. 5904, 14. november 2008, s. 1065-1069. doi : 10.1126 / science.1162493 .
- ^ FO Fahrbach, A. Rohrbach: Et linjeskannet lysarkmikroskop med faseformede selvrekonstruerende bjelker. I: Optikkekspress. Volum 18, nummer 23, november 2010, s. 24229-24244, PMID 21164769 .
- ^ TA Planchon, L. Gao, DE Milkie, MW Davidson, JA Galbraith, CG Galbraith, E. Betzig: Rask tredimensjonal isotrop avbildning av levende celler ved bruk av Bessel-stråleplanbelysning. I: Naturmetoder. Volum 8, nummer 5, mai 2011, s. 417-423, doi: 10.1038 / nmeth.1586 . PMID 21378978 .
- ↑ C. Dunsby: Optisk snittet skrå avbildningsplan ved mikroskopi . I: Optics Express . 16, nr. 25, 2008, s. 20306. doi : 10.1364 / OE.16.020306 .
- ↑ Zeno Lavagnino, Francesca Cella Zanacchi, Emiliano Ronzitti, Alberto Diaspro: To-foton eksitasjon selektiv planbelysning mikroskopi (2PE-SPIM) av sterkt spredte prøver: karakterisering og anvendelse . I: Optics Express . 21, nr. 5, 2013, s. 5998. doi : 10.1364 / OE.21.005998 .
- ↑ a b J. Capoulade, M. Wachsmuth, L. Hufnagel, M. Knop: Kvantitativ fluorescensavbildning av proteindiffusjon og interaksjon i levende celler. I: Nature Biotechnology . Volum 29, nummer 9, september 2011, s. 835-839, doi: 10.1038 / nbt . 1928 . PMID 21822256 .
- ↑ a b c T. Wohland, X. Shi, J. Sankaran, EH Stelzer: Single plane illumination fluorescence correlation spectroscopy (SPIM-FCS) sonder inhomogene tredimensjonale miljøer. I: Optikkekspress. Volum 18, nr. 10, 2010, s. 10627-10641, PMID 20588915 .
- ↑ a b Jan W Krieger, Anand P Singh, Nirmalya Bag, Christoph S Garbe, Timothy E Saunders, Jörg Langowski, Thorsten Wohland: Imaging fluorescens (cross-) correlation spectroscopy in live celler and organisisms . I: Naturprotokoller . teip 10 , nei. 12. 5. november 2015, s. 1948 , doi : 10.1038 / nprot.2015.100 ( uni-heidelberg.de [PDF]).
- ↑ Francesca Cella Zanacchi, Zeno Lavagnino, Michela Perrone Donnorso, Alessio Del Bue, Laura Furia, Mario Faretta, Alberto Diaspro: Live-celle 3D superoppløsningsbilder i tykke biologiske prøver . I: Naturmetoder . 8, nr. 12, 9. oktober 2011, s. 1047-1049. doi : 10.1038 / nmeth.1744 .
- ↑ Jerome Mertz, Jinhyun Kim: avsøkningslyset-ark mikroskopi i hele musehjerne med HiLo bakgrunn avvisning . I: Journal of Biomedical Optics . 15, nr. 1, 2010, s. 016027. doi : 10.1117 / 1.3324890 .
- ^ M. Friedrich, Q. Gan, V. Ermolayev, GS Harms: STED-SPIM: Stimulert utslippsutmattelse forbedrer arkbelysningens mikroskopioppløsning. I: Biophysical Journal. Volum 100, nummer 8, april 2011, s. L43-L45, doi: 10.1016 / j.bpj.2010.12.3748 . PMID 21504720 . PMC 3077687 (gratis fulltekst).
- ↑ Alexis Maizel, Daniel von Wangenheim, Fern n Federici, Jim Haseloff, Ernst HK Stelzer: Høyoppløselig levende bildebehandling av plantevekst i nær fysiologiske lyse forhold ved bruk av lysarkfluorescensmikroskopi . I: Plant Journal . 68, nr. 2, oktober 2011, s. 377-385. doi : 10.1111 / j.1365-313X.2011.04692.x .
- Rence Terrence F. Holekamp, Diwakar Turaga, Timothy E. Holy: Rask tredimensjonal fluorescensavbildning av aktivitet i nevrale populasjoner ved objektiv-koblet plan belysningsmikroskopi . I: Neuron . 57, nr. 5, 13. mars 2008, s. 661-672. doi : 10.1016 / j.neuron.2008.01.011 .
- ↑ Y. Wu, A. Ghitani, R. Christensen, A. Santella, Z. Du, G. Rondeau, Z. Bao, D. Colon-Ramos, H. Shroff: Invertert selektiv flyet belysning mikroskopi (iSPIM) muliggjør koplet celle identitetslinjering og nevroutviklingsbildebehandling i Caenorhabditis elegans . I: Proceedings of the National Academy of Sciences . 108, nr. 43, 25. oktober 2011, s. 17708-17713. doi : 10.1073 / pnas.1108494108 .
- ^ Nobelprisforedrag av RA Zsigmondy (engelsk): Egenskaper ved kolloider (PDF; 108 kB), med illustrasjon og en kort forklaring av ultramikroskopet
- ↑ Pressemelding fra LaVision Biotech ( Memento of 24 December 2013, Internet Archive ) (åpnet 4. november 2012)
- ↑ Carl Zeiss pressemelding om Lightsheet Z.1 lysarkmikroskopsystem (åpnet 4. november 2012)
- ^ PA Santi: Light Sheet Fluorescence Microscopy: A Review . I: Journal of Histochemistry & Cytochemistry . 59, nr. 2, 1. februar 2011, s. 129-138. doi : 10.1369 / 0022155410394857 .
- ↑ OpenSPIM-prosjektets webside (åpnet 8. juni 2013)
- ↑ Peter G Pitrone, Johannes Schindelin, Luke Stuyvenberg, Stephan Preibisch, Michael Weber, Kevin W Eliceiri, Jan Huisken, Pavel Tomancak: OpenSPIM: en åpen tilgang lys-mikroskopi ark plattform . I: Naturmetoder . 9. juni 2013. doi : 10.1038 / nmeth.2507 .
- ↑ Den OpenSPIN prosjektet nettsiden (åpnes 08.06.2013)
- ↑ Emilio J Gualda, Tiago Vale, Pedro Almada, Jos A Feij, Gabriel G Martins, Nuno Moreno: Open Spin Microscopy: en åpen kildekode-integrert mikroskopiplattform . I: Naturmetoder . 9. juni 2013. doi : 10.1038 / nmeth.2508 .
- ↑ PJ Verveer, J. Swoger, F. Pampaloni, K. Greger, M. Marcello, EH Stelzer: Høy oppløsning tredimensjonal avbildning av store prøver med lys platebasert mikroskopi. I: Naturmetoder . Bind 4, nr. 4, 2007, s. 311-313, doi: 10.1038 / nmeth1017 , PMID 17339847 .
- ↑ Corinne Lorenzo, Céline Frongia, Raphael Jorand, Jérome Fehrenbach, Pierre Weiss, Amina Maandhui, Guillaume Gay, Bernard Ducommun, Valérie Lobjois: Levende celledelings dynamikk overvåkning i 3D store sfæroide tumormodeller ved hjelp av lys ark mikroskopi . I: Cell Division . 6, nr. 1, 2011, s. 22. doi : 10.1186 / 1747-1028-6-22 .
- ↑ Daisuke Takao, Atsushi Taniguchi, Takaaki Takeda, Seiji Sonobe, Shigenori Nonaka, Alexandre J. Kabla: High-Speed Imaging of Amoeboid Movements Using Light-Sheet Microscopy . I: PLoS ONE . teip 7 , nei. 12. 5. desember 2012, s. e50846 , doi : 10.1371 / journal.pone.0050846 .