Galvanisk celle

En galvanisk celle [ galˈvaːnɪʃə t͡sɛlə ], galvanisk element eller galvanisk kjede er en anordning for spontan omdannelse av kjemikalier til elektrisk energi . Enhver kombinasjon av to forskjellige elektroder og en elektrolytt kalles et galvanisk element, og de tjener som kilder til direkte spenning . Den karakteristiske verdien er den påførte spenningen . Den kapasitans av et galvanisk element er produktet av utladningsstrømmen multiplisert med tid.
Navnet går tilbake til den italienske legen Luigi Galvani . Han oppdaget at froskens ben berørt av instrumenter laget av forskjellige typer metall utløser muskelsvingninger, siden redoks-systemet således dannet seg, som et galvanisk element, bygger opp spenning slik at strømmen strømmer.
historie
Bevisene for de tidligste galvaniske cellene i antikken er kontroversielle; Det var mulig å generere en elektrisk spenning med en kopi av det omtrent 1800 år gamle Bagdad-batteriet . Om den opprinnelige antikke leirepotten opprinnelig ble brukt til dette formålet, er ikke kjent og er en hypotese.
Utviklingen av galvaniske celler, slik de er vanlige i dag, begynte i nyere moderne tid . Forskningsarbeidet ble utløst av observasjoner gjort av Luigi Galvani rundt 1780: Da han berørte et froskelår med to ledninger laget av forskjellige metaller koblet til hverandre, rykket musklene. I 1790 viste Alessandro Volta at dyrekomponenter ikke er nødvendige for bygging av battericeller. De neste årene brukte han papir fuktet i saltløsning , som ble stablet mellom metallplater laget av kobber og sink og var kjent som den voltaiske kolonnen .
Den Leclanché element ble patentert av Georges Leclanché i 1866 og er en av de “våte batterier” som ikke lenger er i bruk i dag. Det er et elektrisk batteri (primærelement), så det er ikke oppladbart og var i sin opprinnelige form utstyrt med flytende elektrolytt. Tekniske forbedringer av Leclanché-elementet førte til en gelert elektrolytt, og det er en forløper for tørre batterier som sink-karboncelle og det alkaliske manganbatteriet som er vanlig i dag.
Den nikkel-jern akkumulator , en av de første oppladbare akkumulatorer (sekundærcelle), ble utviklet nærmest samtidig og uavhengig av hverandre ved hjelp av den amerikanske Thomas Alva Edison og den svenske Waldemar Jungner rundt 1900. Det anses å være forløperen for den senere utviklede og forbedrede nikkel-kadmiumakkumulatoren .
Generell
Galvaniske celler er systematisk delt inn i tre grupper:
- Primærceller , også kjent som et batteri . Det er karakteristisk at cellen blir ladet og kan tømmes en gang etter sammenføyning. Utladningen er irreversibel - primærcellen kan ikke lenger lades elektrisk.
- Sekundære celler , ofte kjent som et batteri eller et kort batteri . Etter utladning kan sekundære celler lades ved å bruke en strøm som er motsatt utladningen. De kjemiske prosessene i cellen er reversible, begrenset av antall sykluser. Energitettheten til sekundære celler er lavere sammenlignet med primære celler ved samme temperatur.
- Drivstoffceller , også kjent som tertiære celler. I disse galvaniske cellene lagres ikke den kjemiske energibæreren i cellen, men gjøres kontinuerlig tilgjengelig fra utsiden. Denne typen fôr muliggjør kontinuerlig og i prinsippet ubegrenset drift.
Funksjonen til de galvaniske cellene er basert på en redoksreaksjon . Reduksjon og oksidasjon skjer separat i en halvcelle ( halvelement ). Den Kretsen er lukket ved å forbinde de to halvceller med en elektronleder og en ioneleder . Spenningen til den elektriske strømmen kan beregnes ved hjelp av Nernst-ligningen . Det avhenger av typen metall ( elektrokjemisk serie ), konsentrasjonen i løsningen av den respektive halvcellen og temperaturen. I motsetning til elektrolyse , for eksempel ved galvanisering , kan elektrisk energi oppnås i den galvaniske cellen, mens elektrolyse krever elektrisk energi.
Ved utlading av galvaniske celler er den negative polen alltid anoden (= polen der oksidasjonen finner sted), den positive polen er alltid katoden (= polen der reduksjonen finner sted). En eselbro for dette er "OMA (oksidasjon, negativ pol og anode)". Under ladeprosessen til sekundærcellene blir de kjemiske reaksjonene på polene reversert: Oksidasjonen skjer ved den positive polen, og derfor fungerer den annerledes som en anode - følgelig er den negative polen da stedet for reduksjon og dermed katoden. Eselbroen for reaksjonen under ladeprosessen er følgelig: "OPA (oksidasjon, positiv pol og anode)".
En galvanisk celle leverer spenning til kjemisk likevekt er nådd. I motsetning er en galvanisk celle der ingen strøm strømmer, men en elektrodespenning, i elektrokjemisk likevekt .
Oksidasjonen skjer ved anoden og reduksjonen finner sted ved katoden.
Eksempler
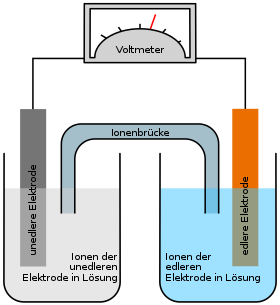
I tillegg til Daniell-elementet (kobber / sink), kan et galvanisk element også produseres av kobber- og sølvelektroder: kobberelektroden er nedsenket i en kobbernitratløsning , sølvelektroden i en sølvnitratløsning . Disse er forbundet med en ledning (elektronleder) med et voltmeter og en ioneleder .
Hvis begge elektrodene er koblet til hverandre via en elektrisk leder, sørger de forskjellige redoks-potensialene til elektrodene for at reaksjonen kan fortsette. Siden redokspotensialet til kobber er lavere enn sølv, går flere ioner i løsning ved kobberelektroden enn ved sølvelektroden. Derfor er den negative ladningen i kobberelektroden høyere enn den i sølvelektroden, så det oppstår en spenning der elektronene "skyves" mot sølvelektroden. Dette fører til at løsningen av sølvatomene stoppes, i stedet reagerer overflødige elektroner med Ag + -ionene i sølvnitratløsningen og sørger for at disse holder seg til sølvelektroden som normale sølvatomer.
Så sølvioner blir redusert til elementært sølv ved sølvelektroden:
Sølvelektroden er altså katoden (elektroden som reduksjonen finner sted på) og den positive polen til den galvaniske cellen (siden det mangler elektroner her).
På den annen side skjer følgende oksidasjon på kobberelektroden:
Kobberelektroden er anoden (elektroden som oksidasjonen finner sted på) og den negative polen til den galvaniske cellen (siden det er et overskudd av elektroner her).
En redoksreaksjon finner sted i den galvaniske cellen, hvis reaksjonsdeler imidlertid er romlig skilt fra hverandre. Derfor er elektroderommene koblet til hverandre via en ionebro (saltbro) , som er nødvendig for å lukke kretsen. Ionbroen er ofte et U-rør som er fylt med en elektrolytt, hvis ender er utstyrt med en membran eller en membran. Ionediffusjon finner sted over saltbroen for å motvirke lading av de enkelte cellene. En annen mulighet for å skille elektroderommene fra hverandre består i en selektiv permeabel (valgt permeabel) membran, som også muliggjør ladningsutjevning. Saltionene (i dette tilfellet nitrationer) vandrer via ionebroen fra katoden til anoden, dvs. fra sølvhalvcellen til kobberhalvcellen.
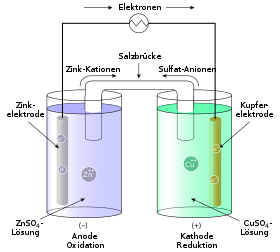
Den Daniell element er en sink-kobber-celle. På grunn av den mindre edle karakteren til sink, er sinkhalvcellen den halvcellen der sinkatomene primært oksideres , fordi mindre edle metaller har en tendens til å donere elektroner.
Det er et overskudd av elektroner ved denne donorhalvcellen (halvcellen som frigjør elektroner); Det danner den negative polen.
Elektroner strømmer nå fra sinkstangen via den ledende forbindelsen til den positive polen, kobberstangen. Kobberhalvcellen er akseptorhalvcellen, siden det er her reduksjonen finner sted. Det mangler elektroner i kobberstangen.
Hvis bare de to elektrodereaksjonene skulle finne sted, måtte løsningen av sinkhalvcellen lades positivt og kobberhalvcellen ville bli ladet negativt og strømmen av elektroner ville komme til å stå stille. Den totale ladningen i halvcellene endres imidlertid ikke, siden migrasjon av kationer og anioner resulterer i en ladningsbalanse i løsningene.
Det er også galvaniske celler med to identiske halvceller, som avviker i konsentrasjon, disse kalles konsentrasjonselementer . Den deflagrator er også en galvanisk celle.
Forkortet notasjon
En galvanisk celle blir noen ganger også beskrevet i forkortet form. Daniell-elementet vist grafisk ovenfor vil se slik ut i denne notasjonen:
Begge halvcellene er atskilt i en galvanisk celle med en membran , dvs. en tynn, semi-permeabel membran ( semipermeabel membran ). Nesten utelukkende får de negativt ladede anionene passere gjennom denne membranen . I tilfellet med den Daniell elementet, disse er SO 4 2- ioner (sulfationer), som er tilstede i saltoppløsninger av begge halvceller.
Denne membranen er representert i forkortet form av den doble vertikale linjen (||). Til høyre og venstre for denne dobbeltlinjen vises de to halvcellene i den galvaniske cellen og reaksjonene som foregår i dem i forkortet form. I tillegg er konsentrasjonen av metallsaltoppløsningen, dvs. konsentrasjonen av de oppløste metaller i begge halvceller, gitt. Anodehalvcellen er vanligvis til venstre.
weblenker
- Forståelig, enkel forklaring på den galvaniske cellen med tydelig animasjon
- Informasjon om galvanisk element
- Flash-animasjon på engelsk
- Videoopplæring om den galvaniske cellen
- Video: Hva skjer med elektrodene? - Strøm og spenning i elektrolyse og galvaniske celler . Jakob Günter Lauth (SciFox) 2013, gjort tilgjengelig av Technical Information Library (TIB), doi : 10.5446 / 15232 .
Individuelle bevis
- ↑ Roland M. Horn: Mankind Riddle : From Atlantis to Sirius , ISBN 978-3-7418-3767-8 ( delvis forhåndsvisning online )
- ↑ Michael Buchholz: Identifikasjon av underrom for modellering av PEM-drivstoffcellebunker . KIT Scientific Publishing, 2010, ISBN 978-3-86644-477-5 , pp. 109 .
- ↑ Elements Chemistry II - Complete Volume , ISBN 3-12-756700-6 , s. 157.