Zwitterion
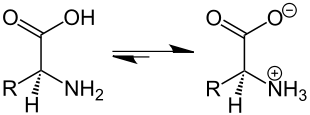
Et zwitterion (se også ion ) er et molekyl med to eller flere funksjonelle grupper , hvorav den ene er positivt og den andre negativt ladet. For eksempel, hvis et zwitterion har to funksjonelle grupper med motsatte ladninger, er molekylet (ved det isoelektriske punktet ) generelt nøytralt nøytralt. Noen ganger brukes begrepet "indre salt" også for en zwitterion.
Gruppene er vanligvis en syre- og en basefunksjon . Det mest kjente eksemplet er aminosyrer som er zwitterioniske både i vandig løsning og i fast fase. Syregruppen frigjør et hydrogenion og bærer en negativ ladning, aminogruppen aksepterer et hydrogenion og bærer en positiv ladning. I motsetning til betaines , kan kostnadene kompenseres ved protonmigrasjon.
I oppløsning, ved en bestemt pH-verdi , er det isoelektriske punktet , så mange syregrupper er negativt ladet som aminogrupper er positive. Da migrerer ikke aminosyrer lenger i det elektriske feltet, men retter seg bare inn siden den totale ladningen er nøytral. Hvis pH er under det isoelektriske punktet, reduseres dissosiasjonen av syregruppen og aminosyren bærer en positiv total ladning. Hvis pH er over dette, øker dissosiasjonen av syren og aminogruppen frigjør hydrogenionet, har molekylet en negativ total ladning. Denne effekten brukes i elektroforese og isoelektrisk fokusering . Vannløseligheten til aminosyrer er lavest ved det isoelektriske punktet , da de resulterende intramolekylære ladningene betyr at et stabilt hydratiseringsskall ikke lenger kan dannes.
For peptider og proteiner er forholdene analoge med dem med aminosyrer. En proton migrerer fra en karboksygruppe av peptidet eller proteinet til en basisk aminogruppe, som kan være i den N- terminale enden, men ikke nødvendigvis må være.
Beregning av det isoelektriske punktet
PH ved det isoelektriske punktet kan være (ved ikke for høy fortynning) fra pK s- verdiene til syregruppen og aminogruppen for å beregne:
Avledning:
Syrekonstantene er definert som:
Ved å multiplisere disse to ligningene elimineres konsentrasjonen av zwitterion:
Siden konsentrasjonene av anion og kation er de samme på det isoelektriske punktet, forenkler ligningen å:
Å ta røttene og ta logaritmen resulterer i:
Multi-proton-systemer
I surt (f, eks., Asparaginsyre , glutaminsyre ) eller basiske aminosyrer (f.eks. Som lysin , arginin ), pK for beregning av det isoelektriske punkt s verdier av de to karboksyl- eller aminogrupper tatt i betraktning. For å beregne IEP for aminosyrer med mer enn to pK-verdier, brukes bare pK-verdiene til de tilsvarende ioniserende gruppene. Dette betyr at når det gjelder basiske aminosyrer, blir de to proksimale pK-verdiene over det isoelektriske punktet, og i tilfelle sure aminosyrer, de to proksimale pK-verdiene under det isoelektriske punktet satt inn i ovenstående ligning og middelverdien blir dannet for enkelhets skyld, f.eks. For lysin (8,95 + 10,53) / 2 = 9,74 og for asparaginsyre (2,09 + 3,86) / 2 = 2,98.
Lecithins

Lecitiner er fosfolipider som er avledet fra fettsyrer , glyserin , fosforsyre og kolin . De er komponenter i cellemembranen i dyre- og plantelivet, tillater emulgering (blanding) av fett og vann, og er derfor viktige naturlige overflateaktive stoffer (emulgeringsmidler) for mat og fôr så vel som i farmasøytisk industri. To hydroksylgrupper i glyserol forestres med fettsyrer. Den tredje OH-gruppen i glyserol danner en ester med en fosfatgruppe . Fosfatgruppen forestres videre med kolinens OH-gruppe og danner således en diester. Kolin er en kvartær ammoniumforbindelse , så den har en positiv ladning og er et kation . Fosfatgruppen eksisterer som et anion over et bredt pH-område , så den har en negativ ladning. Dermed kan lecitiner forstås som zwitterioner eller indre salter .
Se også
Individuelle bevis
- ↑ Oppføring på zwitterioniske forbindelser / zwitterioner . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.Z06752 Versjon: 2.1.5.
- ↑ Olaf Kühl: Organisk kjemi. Wiley-VCH, Weinheim, 2012, s. 242, ISBN 978-3-527-33199-4 .
- ↑ Albert Gossauer: Struktur og reaktivitet av biomolekyler. Verlag Helvetica Chimica Acta, Zürich, 2006, s. 371, ISBN 978-3-906390-29-1 .
- ↑ Reinhard Kuhn: Kapillær elektroforese: prinsipper og praksis. Springer Science & Business Media, 2013, ISBN 978-3-642-78058-5 , s.79 .
- ↑ Cherng-ju Kim: Avansert farmasi. CRC Press, 2004, ISBN 978-0-203-49291-8 , s. 86-99.
- ↑ WT Godbey: En introduksjon til bioteknologi. Elsevier, 2014, ISBN 978-1-908818-48-5 , s.15 .
- ^ Raymond Chang: Fysisk kjemi for biovitenskap. University Science Books, 2005, ISBN 978-1-891389-33-7 , s.291.






