Bompengeaktige reseptorer
Avgiftslignende reseptorer (TLR kort, engelsk toll-lignende reseptor ) er strukturer i det medfødte immunforsvaret (medfødt immunitet) og tilhører en gruppe reseptorer , PRR (mønster-gjenkjenningsreseptorer) . De brukes til å gjenkjenne PAMPer ( patogenassosierte molekylære mønstre) , som er strukturer som utelukkende forekommer på eller i patogener , og kontrollerer den tilsvarende aktivering av gener . Dette initierer og modulerer aktiveringen av det “antigenspesifikke ervervede immunsystemet” (antigenspesifikk ervervet immunitet) . Det medfødte forsvarssystemet er i stand til å skille mellom "selv" og "ikke selv" gjennom de "toll-like reseptorene". TLR uttrykkes vanligvis i dendritiske celler og makrofager, med liten eller ingen uttrykk i epitelceller.
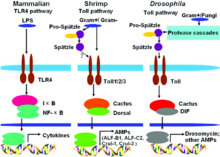
Navnet toll-lignende reseptor (henvist til i tyskspråklig litteratur som signal transduction- medierer PRRS eller sjelden også som toll-lignende reseptor ) er avledet fra et protein i Drosophila melanogaster , som forskningsgruppen rundt nobelprisvinner Christiane Nüsslein-Volhard var så begeistret for at hun humoristisk kalte det flott , ifølge det tyske uttrykket . Øyeblikket som ga fruktens flotte gen sitt navn, var da hun satt overfor kollegaen Eric Wieschaus ved et dobbeltmikroskop som gjør at to personer kan undersøke det samme objektet samtidig. ”En dag da vi så et mutant embryo med en utvikling som var ventralisert, ble vi begge helt overrasket og ropte spontant" flott ". Inntil da kjente vi bare dorsaliserte embryoer ”. TLR-er består av proteiner som ligner Toll, dvs. er toll-lignende .
Siden oppdagelsen av den første tolllignende reseptoren på midten av 1990-tallet, har nye varianter blitt oppdaget igjen og igjen hos mennesker og dyr . TLR finnes i alle virveldyr , men også i enklere organismer som Drosophila melanogaster , noe som antyder at dette er et evolusjonært veldig gammelt system. De fleste arter har mer enn ti forskjellige (kjente) TLR-er. B. forekommer i musen , men ikke hos mennesker.
TLR gjenkjenner forskjellige funksjonelle komponenter i virus , bakterier og sopp og kan dermed utløse biokjemiske reaksjonskjeder i cellene som tjener til å forsvare seg mot disse patogenene.
Oppdagelse av TLR

Da mikroorganismer først ble identifisert som årsaken til smittsomme sykdommer , var det klart at flercellede organismer måtte kunne gjenkjenne dem, og at for å gjøre dette er det nødvendig å gjenkjenne molekylære strukturer som er typiske for mikroorganismer. En stor mengde litteratur, som strekker seg over store deler av 1900-tallet, er viet til nøkkelmolekyler og deres reseptorer. For mer enn 100 år siden laget Richard Pfeiffer , en student av Robert Koch , begrepet ' endotoksin ' for å nevne et stoff som ble produsert av gramnegative bakterier og som førte til feber og sjokk i dyreforsøk. I tiårene som fulgte ble endotoksinene kjemisk karakterisert og identifisert som lipopolysakkarider (LPS), som produseres av de fleste gramnegative bakterier. Det er vist at andre molekyler (bakterielle lipopeptider, flagelliner og umetylert DNA ) også fører til en immunrespons . Logisk ble det konkludert ut fra dette at det må være reseptorer som er i stand til å indusere en immunrespons for slike molekylære strukturer. Imidlertid ble disse ikke funnet på mange år.
På midten av 1990-tallet oppdaget forskning i utviklingsbiologien til Drosophila melanogaster, ganske tilfeldig, at tollnegative mutanter er veldig utsatt for soppangrep. Denne observasjonen initierte et målrettet søk etter lignende proteiner i pattedyrceller. I 1994 klarte Nomura og kollegaer å finne den første menneskelige TLR, som Taguchi og kollegaer kunne tilordne et kromosom i 1996 . Dette viser at immunresponsen formidlet via toll-lignende reseptorer er en evolusjonært veldig gammel form som er genetisk høyt konservert. Siden TLRs rolle i immunforsvar ikke var kjent på det tidspunktet, ble det antatt at TLR-1 ville spille en rolle i pattedyrs utviklingsbiologi. I 1997 viste Charles Janeway og Ruslan Medzhitov at en toll-lignende reseptor, når den er kunstig bundet til passende antistoffer, kan aktivere visse gener som er nødvendige for en adaptiv immunrespons. Funksjonen til TLR-4 som en LPS-reseptor ble oppdaget av Bruce A. Beutler og kolleger. Over tid ble ligandene til de andre TLRene også bestemt. Shizuo Akira spilte en sentral rolle i dette.
Struktur og ligander
De vanlige strukturelle egenskapene til alle bompengeaktige reseptorer er de N-terminale leucinrike LRR-sekvensene ( Leucinrike gjentakelser ) og TIR-domenet (Toll / IL-1R homologidomen) . De forskjellige TLRene kan hver identifisere forskjellige PAMPer ( patogenassosierte molekylære mønstre) gjennom direkte interaksjon med den respektive membranoverflaten av patogenet. TLR-3, TLR-7, TLR-8 og TLR-9 er lokalisert på membranen til endosomer eller endolysosomer, mens de gjenværende tolllignende reseptorene er plassert på cellemembranen.
TLR-2 gjenkjenner mange komponenter av bakterier, mycoplasma, sopp og virus. Dette inkluderer også lipoproteiner fra bakterier og mycoplasmas. Påvisningen skjer ved at TLR2 danner en heterodimer med enten TLR1 eller TLR6. De resulterende TLR-1 / TLR-2 og TLR-6 / TLR-2 kompleksene gjenkjenner triacyl og diacyllipoproteiner. Aktivering av TLR2 fører til frigjøring av et antall cytokiner . Alfa-interferon (IFN-α) frigjøres bare delvis. Det antas generelt at frigjøringen av IFN-α avhenger av celletypen. TLR-10 er i sin primære struktur (sekvensmatch) lik TLR-1 og TLR-6, men liganden er foreløpig ikke kjent. TLR-4 kan gjenkjenne lipopolysakkarid (LPS) på celleoverflaten sammen med MD2 (myeloid differensieringsfaktor 2) . LPS er et stoff fra den ytre membranen av gramnegative bakterier og brukes i dyremodeller for den begrensede simuleringen av akutte infeksjoner. I påvisningen av LPS jobber to TLR4-MD2-LPS-komplekser sammen for å danne en TLR4-homodimer.
TLR5 uttrykkes hovedsakelig i lamina propria , hvor den gjenkjenner bakteriell flagellin. Som en immunrespons induserer TLR-5 differensiering av B-celler i IgA-produserende blodceller og av T-celler til antigenspesifikke Th17- og Th1-celler. TLR-11, som bare forekommer hos mus, men ikke hos mennesker, viser store likheter med TLR-5. Den gjenkjenner et profilin-lignende molekyl avledet fra den intracellulære protozoen Toxoplasma gondii . En rekke TLRer, inkludert TLR-3, TLR-7, TLR-8 og TLR-9, gjenkjenner nukleinsyrer avledet fra virus eller bakterier. Aktivering av disse TLR-ene fører til dannelse av alfa-interferon og andre inflammatoriske cytokiner . TLR-3 oppdager viralt dobbeltstrenget RNA i endolysosomet. DsRNA binder seg til den N-terminale og den C-terminale enden av LRR-sekvensen.
| reseptor | Ligander | Opprinnelsen til ligandene | Adapterprotein til TLR | Mobil lokalisering | Celletyper |
|---|---|---|---|---|---|
| TLR-1 | Ulike triacyl lipopeptides | Bakterielt lipoprotein | MyD88 / MAL | Celleoverflate |
|
| TLR-2 | Ulike glykolipider | Bakterielle peptidoglykaner | MyD88 / MAL | Celleoverflate |
|
| Ulike lipopeptider og proteolipider | Bakterielle peptidoglykaner | ||||
| Lipoteichoic syre | Grampositive bakterier | ||||
| HSP70 | Vertceller | ||||
| Zymosan ( beta-glukan ) | Sopp | ||||
| Mange andre | |||||
| TLR-3 | Dobbeltstrenget RNA , poly I: C | Virus | TRIF | Celle rom |
|
| TLR-4 | Lipopolysakkarid , Eritoran | Gramnegative bakterier | MyD88 / MAL / TRIF / TRAM | Celleoverflate |
|
| Flere varmesjokkproteiner | Bakterier og vertsceller | ||||
| Fibrinogen | Vertceller | ||||
| Heparansulfatfragmenter | Vertceller | ||||
| Fragmenter av hyaluronsyre | Vertceller | ||||
| nikkel | |||||
| Ulike opioider | |||||
| TLR-5 | Bakteriell flagellin | bakterie | MyD88 | Celleoverflate |
|
| Profilin | Toxoplasma gondii | ||||
| TLR-6 | Ulike diacyllipopeptider | Mycoplasma | MyD88 / MAL | Celleoverflate |
|
| TLR-7 | Imidazokinolin | Syntetiske stoffer med lav molekylvekt | MyD88 | Celle rom |
|
| Loxoribine (en guanosinanalog ) | |||||
| Bropirimin | |||||
| Imiquimod , resiquimod | |||||
| Enkeltstrenget RNA | RNA-virus | ||||
| TLR-8 | Syntetiske stoffer med lav molekylvekt, RNase-behandlet viral og bakteriell RNA, resiquimod | MyD88 | Celle rom |
|
|
| TLR-9 | Umetylerte CpG-oligonukleotider (DNA) | Bakterier, DNA-virus | MyD88 | Celle rom |
|
| TLR-10 | Triacylerte lipopeptider | ukjent | Celleoverflate |
|
|
| TLR-11 | Profilin | Toxoplasma gondii | MyD88 | Celle rom |
|
| TLR-12 | Profilin | Toxoplasma gondii | MyD88 | Celle rom |
|
| TLR-13 | Bakteriell ribosomal RNA-sekvens CGGAAAGACC (umetylert) | Virus, bakterier | MyD88, TAK-1 | Celle rom |
|
Den intracellulære signalkaskaden
Kjemoattraktorproteinene "C3a" og "C5a" i komplementsystemet oppstår gjennom proteolytisk spaltning fra de inaktive forløperne C3 og C5. Aktivert lokke makrofag og nøytrofile granulocytter på. Disse fagocyttene har TLR-reseptorer på overflaten. TLR-ene reagerer på bakterielle proteoglykaner eller lipopolysakkarider (LPS), DNA og RNA. De utløser en signalkaskade i bærercellene som til slutt stimulerer forsvaret mot infeksjon. Etter å ha gjenkjent disse bakterielle overflatestrukturene på den ekstracellulære siden, utløses intracellulære signalkaskader av TLR.
Anerkjennelsen av PAMPs (Pathogen Associated Molecular Patterns) av TLR fører til en økning i transkripsjonshastigheten til visse gener, avhengig av hvilke TLRer og hvilke celletyper som er involvert. Forskjellen mellom signalkaskadene som er aktivert av de enkelte TLRene, kan i det minste delvis forklares med de TIR-domeneholdige adaptermolekylene (TIR-domene-holdige adaptermolekyler). Det er fem TIR-domeneholdige adaptermolekyler, inkludert MyD88, TRIF / TICAM-1 (TIR-domeneholdig adapter som induserer IFN-β), TIRAP / Mal, TRAM (TRIF-relatert adaptermolekyl) og SARM (steril alfa og Armadillo motivholdig protein). TLR-signalkjeder er omtrent delt inn i to forskjellige reaksjonskjeder, avhengig av involveringen av adaptermolekylene MyD88 og TRIF.
Dette fører til fosforylering og dermed aktivering av intracellulære kinaser , hvis oppgave er å fosforylere intracellulære inhibitorer av transkripsjonsfaktorer . Først binder adapterproteinet MyD88 til den cytoplasmatiske delen av TLR. Som et resultat binder IL-1-reseptorassosiert kinase (IRAK) nå til MyD88 og aktiverer seg selv gjennom autofosforylering. I ytterligere individuelle trinn aktiveres transkripsjonsfaktoren NF-KB , som deretter translokeres til cellekjernen og uttrykker den der Regulerer gener for TNFα, IL-1, IL-12 og E-selectin.
litteratur
- K. Takeda, S. Akira: Bompengeaktige reseptorer i medfødt immunitet. I: International immunology , Volume 17, Number 1, January 2005, ISSN 0953-8178 , s. 1-14, doi: 10.1093 / intimm / dxh186 , PMID 15585605 (anmeldelse).
- Luke AJ O'Neill: Det immunologiske systemet for tidlig varsling. Spectrum of Science , august 2005, s. 68–75
- SE Turvey, TR Hawn: Mot subtilitet: forstå rollen som toll-lignende reseptorsignalering i mottakelighet for infeksjoner hos mennesker. I: Clinical immunology (Orlando FL), Volum 120, nr. 1, juli 2006, ISSN 1521-6616 , s. 1-9, doi: 10.1016 / j.clim.2006.02.003 , PMID 16563867 (anmeldelse).
- Nicola Siegmund-Schultze: Deutsches Ärzteblatt: Bompengeaktige reseptorer: Ny målstruktur for immunstimulerende stoffer . I: Deutsches Ärzteblatt . teip 104 , nr. 16 . Deutscher Ärzte-Verlag, 20. april 2007, s. A-1072 / B-954 / C-908 .
Individuelle bevis
- ↑ a b c d Peter Fritsch: Dermatology and Venereology . 2. utgave. Springer Verlag, 2004, ISBN 3-540-00332-0 .
- ↑ Toll-like receptor , tysk. Doctor Bl 2007; 104 (16): A-1072 / B-954 / C-908. Hentet 8. juni 2020.
- ↑ B. Lemaitre, J. Hoffmann: Verten forsvar av Drosophila melanogaster . I: Årlig gjennomgang av immunologi . 25, 2007, s. 697-743. doi : 10.1146 / annurev.immunol.25.022106.141615 . PMID 17201680 .
- ↑ S. Valanne, JH Wang, M. RAMET: Drosophila Toll signalveien . I: Journal of Immunology . 186, nr. 2, januar 2011, s. 649-656. doi : 10.4049 / jimmunol.1002302 . PMID 21209287 .
- ↑ JP Dudzic, MA Hanson, I. Iatsenko, S. Kondo, B. Lemaitre: Mer enn svart eller hvitt: Melanisering og tollandel Regulerende serinproteaser i Drosophila . I: Cell Reports . 27, nr. 4, april 2019, s. 1050-1061.e3. doi : 10.1016 / j.celrep.2019.03.101 . PMID 31018123 .
- ^ MA Hanson, PT Hamilton, SJ Perlman: Immunegener og divergerende antimikrobielle peptider i fluer av undergenen Drosophila . I: BMC Evolutionary Biology . 16, nr. 1, oktober 2016, s. 228. doi : 10.1186 / s12862-016-0805-y . PMID 27776480 .
- ↑ B. Lemaitre, E. Nicolas, L. Michaut, JM Reichhart, JA Hoffmann : Den regulerende dorsoventral genkassett spätzle / Toll / kaktus styrer potente antifungale responsen i Drosophila voksne. I: Cell . Volum 86, nummer 6, september 1996, ISSN 0092-8674 , s. 973-983, PMID 8808632 .
- ^ T. Kawai, S. Akira: Rollen til mønstergjenkjenningsreseptorer i medfødt immunitet: oppdatering på bompengeaktige reseptorer. I: Naturimmunologi . Volum 11, nummer 5, mai 2010, s. 373-384, doi: 10.1038 / ni.1863 , PMID 20404851 (anmeldelse).
- ↑ a b c Kilden er, med mindre annet er angitt i tabelloppføringene: C. Waltenbaugh, T. Doan, R. Melvold, S. Viselli: Immunology (= Lippincott's Illustrated reviews). Wolters Kluwer Health / Lippincott Williams & Wilkins, Philadelphia 2008, ISBN 978-0-7817-9543-2 , s. 17.
- ↑ a b I. Sabroe, SK Dower, MK Whyte: Rollen til toll-lignende reseptorer i reguleringen av nøytrofil migrasjon, aktivering og apoptose . I: Kliniske smittsomme sykdommer . 41 Suppl 7, november 2005, s. S421-426. doi : 10.1086 / 431992 . PMID 16237641 .
- ↑ a b c d F. Sallusto, A. Lanzavecchia: Den lærerike rollen til dendritiske celler på T-celleresponser . I: Arthritis Research . 4 Suppl 3, 2002, s. S127-132. doi : 10.1186 / ar567 . PMID 12110131 . PMC 3240143 (fulltekst).
- ↑ CF Nikodemus, JS Berek: TLR3-agonister som immunoterapeutiske midler. I: Immunterapi. Volum 2, nummer 2, mars 2010, s. 137-140, doi: 10.2217 / imt.10.8 , PMID 20635920 .
- ↑ KA Shirey, W. Lai et al.: TLR4-antagonisten Eritoran beskytter mus mot dødelig influensainfeksjon. I: Natur. Volum 497, nummer 7450, mai 2013, ISSN 1476-4687 , s. 498-502, doi: 10.1038 / nature12118 , PMID 23636320 , PMC 3725830 (fri fulltekst).
- ^ EJ Hennessy, AE Parker, LA O'Neill: Targeting Toll-like receptors: emerging therapics? I: Naturomtaler. Legemiddeloppdagelse. Volum 9, nummer 4, april 2010, ISSN 1474-1784 , s. 293-307, doi: 10.1038 / nrd3203 , PMID 20380038 (anmeldelse).
- ↑ S. Gerondakis, RJ Grumont, A. Banerjee: Regulering B-celleaktivering og overlevelse i respons til TLR signaler . I: Immunologi og cellebiologi . 85, nr. 6, 2007, s. 471-475. doi : 10.1038 / sj.icb.7100097 . PMID 17637697 .
- ^ E. Cario, IM Rosenberg, SL Brandwein, PL Beck, HC Reinecker, DK Podolsky: Lipopolysakkarid aktiverer forskjellige signalveier i tarmepitelcellelinjer som uttrykker toll-lignende reseptorer . I: Journal of Immunology . 164, nr. 2, januar 2000, s. 966-972. doi : 10.4049 / jimmunol.164.2.966 . PMID 10623846 .
- ↑ M. Peana, K. Zdyb, S. Medici, A. Pelucelli, G. Simula, E. Gumienna-Kontecka, MA Zoroddu: Ni (II) interaksjon med et peptid modell av det menneskelige TLR4 ektodoménet . I: Journal of Trace Elements in Medicine and Biology . 44, desember 2017, s. 151-160. doi : 10.1016 / j.jtemb.2017.07.006 . PMID 28965571 .
- ↑ RM Salazar Gonzalez, H. Shehata, MJ O'Connell, Y. Yang, ME Moreno-Fernandez, CA Chougnet, J. Aliberti: Toxoplasma gondii- avledet profilin utløsere human Toll-like receptor 5-avhengig cytokinproduksjon . I: Journal of Innate Immunity . 6, nr. 5, 2014, s. 685-694. doi : 10.1159 / 000362367 . PMID 24861338 . PMC 4141014 (fri fulltekst).
- ↑ Thomas Ostendorf, Thomas Zillinger, Katarzyna Andryka, Thais Marina Schlee-Guimaraes, Saskia Schmitz: Immune Sensing av syntetisk, bakteriell og protozo RNA av Toll-like receptor 8 Krever samordnet behandling av RNase T2 og RNase to . I: Immunitet . teip 52 , nr. 4. april 2020, s. 591–605.e6 , doi : 10.1016 / j.immuni.2020.03.009 ( elsevier.com [åpnet 18. september 2020]).
- ↑ C. Maisonneuve, S. Bertholet et al.: Å frigjøre potensialet til NOD og toll-lignende agonister som vaksineadjuvanser. I: Proceedings of the National Academy of Sciences . Volum 111, nummer 34, august 2014, ISSN 1091-6490 , s. 12294-12299, doi: 10.1073 / pnas.1400478111 , PMID 25136133 , PMC 4151741 (gratis fulltekst) (anmeldelse).
- . Y. Guan, DR Ranoa, S. Jiang, SK Mutha, X. Li, J. Baudry, RI Tapping: Human TLRs 10 og 1 deler vanlige mekanismer for medfødt immunsensing, men ikke signalisering . I: Journal of Immunology (Baltimore, Md.: 1950) . 184, nr. 9, mai 2010, s. 5094-5103. doi : 10.4049 / jimmunol.0901888 . PMID 20348427 .
- ↑ T. Chuang, RJ Ulevitch: Identifisering av hTLR10: en ny human Toll-like receptor fortrinnsvis uttrykt i immunceller . I: Biochimica Et Biophysica Acta . 1518, nr. 1-2, mars 2001, s. 157-161. doi : 10.1016 / s0167-4781 (00) 00289-x . PMID 11267672 .
- ^ V. Hornung, S. Rothenfusser, S. Britsch, A. Krug, B. Jahrsdörfer, T. Giese, S. Endres, G. Hartmann: Kvantitativ uttrykk for toll-lignende reseptor 1-10 mRNA i cellulære undergrupper av menneskelig perifer mononukleære blodceller og følsomhet overfor CpG oligodeoksynukleotider . I: Journal of Immunology . 168, nr. 9, Baltimore, Md .: 1950, mai 2002, s. 4531-4537. doi : 10.4049 / jimmunol.168.9.4531 . PMID 11970999 .
- ^ A b T. Regan, K. Nally, R. Carmody, A. Houston, F. Shanahan, J. Macsharry, E. Brint: Identifikasjon av TLR10 som en nøkkelformidler for den inflammatoriske responsen til Listeria monocytogenes i tarmepitelceller og makrofager . I: Journal of Immunology . 191, nr. 12, desember 2013, s. 6084-6092. doi : 10.4049 / jimmunol.1203245 . PMID 24198280 .
- ↑ F. Yarovinsky, D. Zhang, JF Andersen, GL Bannenberg, CN Serhan, MS Hayden, S. Hieny, FS Sutterwala, RA Flavell, S. Ghosh, A. Sher: TLR11 aktivering av dendrittceller ved en protozo profilin lignende protein . I: Vitenskap . 308, nr. 5728, juni 2005, s. 1626-1629. bibcode : 2005Sci ... 308.1626Y . doi : 10.1126 / science.1109893 . PMID 15860593 .
- ↑ R. Pifer, A. Benson, CR Sturge, F. Yarovinsky: UNC93B1 er essensielt for aktivering TLR11 og IL-12-avhengig motstand mot Toxoplasma gondii . I: Journal of Biological Chemistry . 286, nr. 5, februar 2011, s. 3307-3314. doi : 10.1074 / jbc.M110.171025 . PMID 21097503 . PMC 3030336 (gratis fulltekst).
- ↑ AA Koblansky, D. Jankovic, H. Oh, S. Hieny, W. Sungnak, R. Mathur, MS Hayden, S. Akira, A. Sher, S. Ghosh: Gjenkjenning av profilin ved Toll-like receptor 12 er kritisk for motstand mot vert mot Toxoplasma gondii . I: Immunitet . 38, nr. 1, januar 2013, s. 119-130. doi : 10.1016 / j.immuni.2012.09.016 . PMID 23246311 . PMC 3601573 (fri fulltekst).
- ↑ BB Mishra, UM Gundra, JM Teale: Ekspresjon og distribusjon av bompengeaktige reseptorer 11-13 i hjernen under murin neurocysticercosis . I: Journal of Neuroinflammation . 5. desember 2008, s. 53. doi : 10.1186 / 1742-2094-5-53 . PMID 19077284 . PMC 2631477 (gratis fulltekst).
- ↑ Z. Shi, Z. Cai, A. Sanchez, T. Zhang, S. Wen, J. Wang, J. Yang, S. Fu, D. Zhang: En ny bompellignende reseptor som gjenkjenner vesikulær stomatittvirus . I: Journal of Biological Chemistry . 286, nr. 6, februar 2011, s. 4517-4524. doi : 10.1074 / jbc.M110.159590 . PMID 21131352 . PMC 3039399 (fulltekst).
- Old M. Oldenburg, A. Krüger, R. Ferstl, A. Kaufmann, G. Nees, A. Sigmund, B. Bathke, H. Lauterbach, M. Suter, S. Dreher, U. Koedel, S. Akira, T Kawai, J. Buer, H. Wagner, S. Bauer, H. Hochrein, CJ Kirschning: TLR13 gjenkjenner bakteriell 23S rRNA uten erytromycin-resistensdannende modifikasjon . I: Vitenskap . 337, nr. 6098, august 2012, s. 1111-1115. bibcode : 2012Sci ... 337.1111O . doi : 10.1126 / science.1220363 . PMID 22821982 .
- ↑ H. Hochrein, CJ Kirschning: Bakterier unngå immungjenkjennelse via TLR13 og binding av deres 23S rRNA av MLS-antibiotika ved de samme mekanismer . I: Onkoimmunologi . 2, nr. 3, mars 2013, s. E23141. doi : 10.4161 / onci.23141 . PMID 23802068 . PMC 3661153 (fulltekst).