Tautomerisme
Den tautomeri (fra gr. Tauto "de samme" og meros "del") beskrives en spesiell form for isomeri i kjemi . Den ble oppdaget i 1876 av Alexander Michailowitsch Butlerow (1828-1886) og ble introdusert som et begrep i 1885 av Conrad Peter Laar .
| Oversikt | |||
|---|---|---|---|
| A-X-Y = Z med A = H + | X = Y-Z-A | Prototropi | |
| H-C-C = O | C = C-O-H | Keto-enol | |
| H-C-N = O | C = N-O-H | Nitro-acinitro | Nitroso oxime |
| H-C-N = N | C = N-N-H | Azo hydrazo | Hydrazo-azo |
| H-N-C = O | N = C-O-H | Amidimidinsyre | Lactam-lactim |
| H-C-C = N | C = C-N-H | Imine-enamine | |
| Ringkjede tautomeri | |||
| A - X - Y = Z med A = OH - | Anionotropi | ||
| HO-C-C = C | C = C-C-OH | ( se nedenfor ) | |
| A-X-Y | X-Y-H | dyadisk tautomeri | |
Når molekyler har den samme molekylformelen, men de enkelte atomer er koblet forskjellig, snakker man om konstitusjonelle isomerer . Tautomerer er isomerer som raskt smelter sammen til hverandre på grunn av migrasjon av individuelle atomer eller grupper av atomer. H. de to isomerer er i dynamisk kjemisk likevekt med hverandre. På grunn av den raske likevekten kan de enkelte tautomerer ofte ikke isoleres; forholdet mellom tautomerer og hverandre er konstant.
Tautomerer er ofte forskjellige i gruppens posisjon og i posisjonen til en dobbeltbinding:
Enverdige kationer slik som proton eller monovalente anioner, så som klorid , hydroksyd eller acetat -ioner kommer i betraktning som trekkende grupper . Hvis en dobbeltbinding blir erstattet av en ringdannelse fra enkeltbindinger, snakker man om ringkjede-tautomerisme .
Tautomerisme må ikke forveksles med mesomerisme , der bare det samme molekylet er beskrevet av forskjellige grenseformler .
Prototropi
I prototropi endrer en proton sin plass i molekylet:
Keto-enol tautomerisme
Den vanligste formen for tautomerisme er keto-enol tautomerisme . På grunn av polariseringen av C - O dobbeltbinding på grunn av oksygenets høye elektronegativitet og muligheten for å avlokalisere den negative ladningen over tre atomer etter deprotonering , kan protoner ved karbonylgruppens α-C-atom lett deles av. Reprotonation av enolatet ion på oksygen fører til enol. Denne tautomeriseringen kan katalyseres av baser, som støtter spaltningen av protonen, eller av syrer, som styrker polarisasjonen av C-O-bindingen ved å protonere karbonyloksygenet.
| Keto-enol tautomerisme | |||||
|---|---|---|---|---|---|

|
 
|
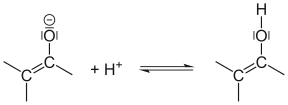
|
|||
| Å dele en proton: α-C-atomet frigjør en proton i en grunnleggende løsning. | Denne karbanionen er mesomerisk stabilisert : Mesomerisk stabilisering av enolatanionet. | Hvis protonen binder seg til det negative oksygenet, dannes enolen: protonen er festet til enolatanionet. | |||
| Karbonylforbindelse | Enol-form i% |
|---|---|
| Propanon ( aceton ) | 0,00025 |
| Butan-2,3-dion ( diacetyl ) | 0,0056 |
| Sykloheksanon | 0,02 |
| Etyl-3-oksobutyrat ( acetoeddikester ) | 8. plass |
| Pentan-2,4-dion ( acetylaceton ) | 80 |
| enverdige fenoler | 100 |
Balansen er vanligvis på siden av ketoformen. Andelen av enolform i aceton er bare 0,00025%. Når det gjelder pentan-2,4-dion (vanlig navn acetylaceton ) dominerer enolformen derimot i likevekt. Fenoler er hovedsakelig i enolform, siden dannelsen av ketoformen (eksempel: kinoidstruktur ) avskaffer det aromatiske systemet.
Eksempel: Etanal og etanol er i en tautomer likevekt i løsning, men likevekten er tydelig på siden av etanalen. Det er både bindingsisomerisme (C = C / C = O) og funksjonell isomerisme (-CH = O / -C-OH).
| Etanal-etenol tautomeri |
|---|
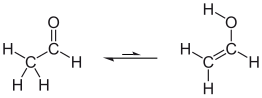
|
Reaktiviteten kan ikke utledes fra likevektens posisjon. Enolformen er ofte betydelig mer reaktiv enn ketoformen. Men fordi dette stadig reproduseres på grunn av den raskt etablerte likevekten, observeres bare reaktiviteten til enol makroskopisk (se Le Chateliers prinsipp ).
Dette kan vises veldig pent i reaksjonen av aceton med brom. Etter å ha tilsatt en dråpe brom, forsvinner fargen på brom sakte først, deretter raskere og raskere, ettersom HBr som dannes sterkt akselererer etableringen av keto-enolbalansen. Hvis mer brom tilsettes, oppstår misfargingen nesten øyeblikkelig med dannelsen av bromaceton .
Ketol-enediol tautomerisme
α- Hydroxy-ketones ( acyloins ) viser en spesiell form for keto-enol tautomerisme.
1. 2-hydroksy-propanal har en hydroksylgruppe på a-karbonatomet (det andre karbonatomet). På grunn av sin negative induktive effekt, polariserer dette CH-bindingen på α-C-atomet og letter dermed oppdeling av en proton. En eniol dannes som et molekyl med en dobbeltbinding og to (- di -) tilstøtende hydroksylgrupper. Ved å omorganisere en proton, kan den omdannes til et molekyl med karbonyloksygen, i dette tilfellet et keton.
| Hydroksypropanal-propendiol-hydroksypropanon tautomeri |
|---|
Det er også posisjonsisomerisme her, siden 2-hydroksypropanal og 1-hydroksypropanon bare skiller seg i stillingene til hydroksyl- og karbonylgruppene.
2. Hvis metylgruppen i eksemplet propanal erstattes av en hydrokarbonkjede med fire karbonatomer og fire hydroksylgrupper, er en aldoheksose tilstede, som er i likevekt med ketoheksose i vandig løsning via enediolform . I vandig løsning er epimer glukose og mannose i likevekt som aldohexoses med ketohexose- fruktose ( Lobry-de-Bruyn-Alberda-van-Ekenstein-omlegging ). Den tidligere aksepterte forklaringen på at den positive Fehling-testen for fruktose også kan spores tilbake til en keto-enol-tautomeri, er i mellomtiden blitt tilbakevist. Imidlertid er endioler (eller deres anioner, slik de oppstår i den alkaliske Fehlings løsning) i seg selv sterke reduksjonsmidler som er dehydrert til 1,2-diketoner. For eksempel har benzoin og acetoin (3-hydroksybutanon-2) også en sterk reduserende effekt . Ved glykolyse katalyseres omdannelsen av glukose-6-fosfat til fruktose-6-fosfat av enzymet glukose- fosfatisomerase , i et senere glykolysetrinn katalyseres reaksjonen av glyseraldehyd-3-fosfat til dihydroksyacetonfosfat av enzymet triose fosfat isomerase .
Ytterligere eksempler: ribose og arabinose som aldopentoser er i tautomer likevekt med ketopentose ribulose .
3. Epimerisering er også en tautomerisering: I vandig oppløsning omdannes epimerer, det vil si aldoser som bare skiller seg fra hverandre i stillingen til hydroksylgruppen på det andre karbonatomet. Eksempler på epimerpar: glukose / mannose, ribose / arabinose, erytrose / treose , D - glyseraldehyd / L- glyseraldehyd
Se også: ketol-enediol tautomerisme i floroglucinol , redusertoner .
Nitro aci nitro tautomeri
Forbindelser med en nitrogruppe er i likevekt med sin aci- form i sur løsning . Likevekten er vanligvis på siden av nitroforbindelsen.
| Nitro aci nitro tautomeri |
|---|

|
| Nitroetan : tautomerisme av nitrogruppen |
Nitroso-oxime tautomerism
Forbindelser med en nitrosogruppe er i likevekt med sin oksimform i sur løsning . Likevekten er vanligvis 100% på siden av oksimet.
| Nitroso-oxime tautomerisme |
|---|

|
Amidimidinsyre tautomerisme
Imidsyrene er tautomerer av amidene .
| Amide-imide tautomeri | ||
|---|---|---|

|

|

|
| Tautomerisme amid / imidinsyre | Urea tautomerisme | Tautomeri av hydroksaminsyre |
Imine-enamine tautomerisme
| Imine-enamine tautomerisme | |
|---|---|
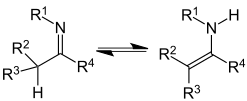
|

|
| Imine- Enamin tautomerisme | Et eksempel på syklisk og dobbelt imine-enamin tautomeri er histidin . |
Azo-hydrazo-tautomerisme
Azoforbindelser med et enoliserbart hydrogenatom på α-karbonatomet ved siden av azogruppen er i likevekt med hydrazoformen. Som regel er likevekten overveiende på siden av hydrazoformen.
| Azo-hydrazo-tautomerisme |
|---|

|
Tautomerisme i tetrazoler
Tautomer likevekt av den heteroaromatiske 1 H -etrazoles og 2 H -etrazoles i sammenligning med 5 H -etrazole (høyre):
| Tetrazol tautomeri |
|---|
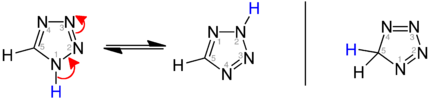
|
Lactam-lactim tautomeri
| Lactam-lactim tautomerisme | ||
|---|---|---|

|

|

|
| Tautomeri av en laktam | Tautomerismen av cyanursyre | Tautomerisme av hypoxanthin (en purin ) |

|
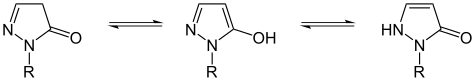
|
Guanin også har en NH 2 -gruppen i 2-stilling , urinsyre i stilling 2 og 8 hver har en OH-gruppe |
| Tautomerisme av barbitursyre (en pyrimidin ) | Tautomeri av dihydropyrazoloner | |
Tiolactam-thiolactim tautomerisme
| Tiolactam-thiolactim tautomerisme |
|---|

|
| Tautomerisme av 6- purinthiol : 6-tioguanin har også en NH 2- gruppe i posisjon 2 |
Ringkjede tautomeri
Oxy-Cyclo-Tautomerism
I tilfelle av langkjedede okso-forbindelser, cyklo- etere kan bli dannet. Et eksempel er hemiacetal syklo-tautomerisme . Halvacetaler dannes i en tilsetningsreaksjon av alkoholer med karbonylforbindelser. Hvis et molekyl inneholder en hydroksylgruppe som er langt nok unna karbonylgruppen, kan en reaksjon i molekylet føre til ringlukking. Karbonyl-oksygenet mottar protonen til hydroksylgruppen og blir dermed hydroksylgruppen selv. Ringlukkingen skjer gjennom dannelsen av en binding mellom det negativt polariserte oksygenet til den fjernede hydroksylgruppen og det positivt polariserte karbonet i karbonylgruppen. I vandig løsning er det en likevekt mellom den åpne kjede aldehyd- eller ketoformen og ringformen. Dette er tilfelle med alle aldo- og ketopentoser og heksoser i vandig løsning.
| Oxy-Cyclo-Tautomerism | |
|---|---|

|

|
| Sykloacetal likevekt | Ribose tautomeri |
(sammenlign ATP og RNA ; se også glukose og fruktose )
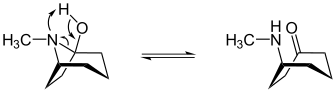
Tropanol-cykloheptanon tautomerisme
(1 R ) -1- tropanol er i en tautomer likevekt med ( R ) - (metylamino) cykloheptanon:
| Tropanol-heptanon tautomeri |
|---|
|
| Tautomerisme av (1 R ) -1-tropanol |
Anionotropi
| Anionotropi |
|---|
| Tautomerisme av butenol |
Eksempel på butenoler : 3-hydroksy-1-buten er i tautomer likevekt med 1-hydroksy-2-buten ( crotylalkohol ) hvis den oppvarmes til 100 ° C i flere timer med fortynnet svovelsyre (likevektforhold 3: 7) . Denne tautomerismen tilsvarer bare formelt en anionotropi der et hydroksidanion endrer stilling. Den faktiske reaksjonsmekanismen er at hydroksylgruppen først protoneres og deretter deles av som et vannmolekyl. Det som gjenstår er et mesomert-stabilisert karbeniumion , som er positivt polarisert på 1. og 3. karbonatom. Et vannmolekyl kan binde seg til et av de to karbonatomer, som igjen blir en hydroksylgruppe ved å dele av et proton.
Dyadisk tautomeri
I dyadisk tautomerisme (fra gresk dyas = dualitet) foregår protonvandring mellom nærliggende atomer.
| Dyadisk tautomeri | |
|---|---|
|
|
|
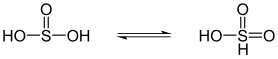
Svovelsyre er i likevekt med sulfonsyre |
Hydrogencyanid ( hydrocyansyre ) er i likevekt med hydrogenisocyanid, likevekten er på siden av hydrogencyanid (til venstre). |
Individuelle bevis
- ^ Oppføring ved tautomerisering . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.T06253 Versjon: 2.3.3.
- ^ L Antonov: Tautomerism: Methods and Theories , 1. utgave, Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33294-6 .
- ↑ a b oppføring om tautomerisme . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.T06252 Versjon: 2.3.3.
- ↑ Holger Fleischer: Feiltolkning av Fehlings test for reduksjon av sukker - Fra observasjon i kjemiklasse til bevis mot oksidasjon av aldehydgruppen . I: CHEMKON . teip 24 , nei. 1 , 2017, ISSN 1521-3730 , s. 27–30 , doi : 10.1002 / ckon.201610283 .
- ↑ Entry på imidic syrer. I: Römpp Online . Georg Thieme Verlag, åpnet 23. februar 2019.




