Naturlig stoff
Naturprodukter ( engelsk naturlig produkt i) betegner kjemi en forbindelse avledet fra organismer blir dannet for å møte biologiske funksjoner; et moderne synonym for naturlig stoff i betydningen kjemi er biomolekyl . Bare rene stoffer eller definerte blandinger av stoffer forstås slik. Lovgiveren definerer organiske stoffer ved hjelp av Biological Agents Ordinance .
I vanlig språkbruk er naturlig substans et bredere begrep: alle stoffer som mennesker ikke har produsert kunstig. Denne artikkelen refererer bare til det spesifikke begrepet som er definert ovenfor i betydningen kjemi. Etter det teller de ikke blant de naturlige stoffene
- Komplekse, ikke-rene stoffer dannet av levende vesener, naturlige produkter som fjær , tre eller bomull , som består av naturlige stoffer, men er ikke-ensartede blandinger av stoffer
- alle naturlig forekommende uorganiske stoffer som mineraler eller bergarter
Selv om et naturlig stoff er en definert forbindelse, forekommer det i organismer i mange modifiserbare modifikasjoner. Den biologiske funksjonen styres eller kontrolleres av modifikasjonene. Etter ekstraksjon og rensing oppnås vanligvis den stabile grunnstrukturen, som kan tildeles klassene naturlige stoffer.
Naturlige stoffer bygges opp eller omdannes til hverandre i alle levende organismer. Syntesen deres er forbundet med en energiforbruk for organismen. Oppgavene deres varierer avhengig av stoffklassen og spenner fra enkel metabolisme eller energiproduksjon gjennom cellekomponenter og byggematerialer i organismen til komplekse kontrolloppgaver. Når det gjelder funksjonene deres, kan det skilles mellom primære og sekundære naturlige stoffer. De primære naturlige stoffene inkluderer alle forbindelser som kreves for at organismen skal støtte liv og vekst. Disse inkluderer fremfor alt fett og biopolymerer av karbohydrater og proteiner . De sekundære naturlige stoffene er dannet av årsaker som ofte er ukjente, og er delt inn i de store stoffklassene terpener , aromater og alkaloider .
Kjemien til naturlige stoffer er en tverrfaglig vitenskap som kan bruke metoder for organisk og analytisk kjemi for å svare på spørsmål innen biologi , biokjemi , fysiologi og farmasi . Naturproduktkjemi er av stor betydning i farmakologi , i utviklingen av nye aktive ingredienser og generelt i utviklingen av metoder i disse fagene.
historie
Det opprinnelige begrepet naturprodukt ble bestemt av den historiske definisjonen av organisk kjemi ; den omfattet hele stoffene som brukes i strukturen til dyr og planter . I 1827 antok Jöns Jakob Berzelius på grunn av kunnskapsnivået og den komplekse kjemiske strukturen til naturlige stoffer at det måtte være en livskraft ( vis vitalis ) for produksjonen . Skillet mellom selvorganiserte og eksternt organiserte stoffer ble revidert av Friedrich Wöhler (1828), som med syntese av urea hadde demonstrert at forbindelsen ammoniumcyanat, definert som uorganisk, kan omdannes til forbindelsen urea, som er definert som organisk .
I dagens definisjon inkluderer organisk kjemi praktisk talt alle karbonforbindelser. I løpet av tiden utviklet kjemisk naturprodukt seg til et underområde og omhandler isolering, strukturoppklaring , syntese eller biosyntese og egenskapene til forbindelser som forekommer i organismer (som dyr, planter og mikroorganismer).
Opprinnelig handlet naturproduktkjemi bare om ingredienser av planteopprinnelse, da det var veldig påvirket av farmakognosi (legemiddelvitenskap). Forbindelser (opprinnelig hovedsakelig alkaloider ) ble isolert fra planteekstrakter og det ble gjort forsøk på å belyse strukturen.
I midten av 1800-tallet utvidet Justus Liebig konseptet med naturlige stoffer til å omfatte forbindelser av animalsk opprinnelse. Emil Fischer ble en pioner innen strukturoppklaring og syntese av karbohydrater og proteiner mot slutten av 1800-tallet .
På slutten av 1930-tallet hadde de viktigste klassene av naturlige stoffer blitt funnet, undersøkt og strukturen deres avklart. Viktige milepæler er her:
- Terpener av Otto Wallach fra essensielle oljer
- Steroider av Adolf Windaus og Heinrich Otto Wieland
- Karotenoider av Paul Karrer
- Porfinfargestoffer av Richard Willstätter og Hans Fischer
- Vitaminer av Paul Karrer , Adolf Windaus , Robert R. Williams , Richard Kuhn og Albert von Szent-Györgyi Nagyrápolt, blant andre
- Hormoner av Adolf Butenandt og Edward Calvin Kendall
Med oppdagelsen av penicillin i 1940 av Alexander Fleming , Ernst Boris Chain og Howard Walter Florey , ble mikroorganismer også anerkjent som en lønnsom kilde til naturlige stoffer.
Etter slutten av andre verdenskrig ble naturlig produktkjemi fremmet ved utvikling av nye og veldig kraftige analytiske og fysiske metoder. Både massespektrometri , røntgenkrystallografi og senere NMR-spektroskopi tillot hittil ufattelige muligheter for strukturbestemmelse uten derivatisering av det naturlige produktet og små mengder analyt . De eneste sakte etablerte metodene for kromatografi og elektroforese gjorde det mulig å skille stoffblandingene med en tidligere uoppnåelig hastighet og renhet.
Definisjon i kjemikalieloven
Uttrykket naturlig substans er juridisk definert som "naturlig forekommende substans som sådan, ubearbeidet eller bare behandlet manuelt, mekanisk eller ved gravitasjonskraft, ved oppløsning i vann, ved flotasjon, ved ekstraksjon med vann, ved dampdestillasjon eller ved oppvarming for dehydrering eller ved noen midler hentet fra luften " .
I henhold til vedlegg V avsnitt 7 og 8 i REACH-forordningen (EG 1907/2006) er naturlige stoffer unntatt fra registrering hvis de ikke har blitt kjemisk modifisert. Dette gjelder ikke hvis de er klassifisert som farlige i henhold til kriteriene i CLP-forordningen (EF nr. 1272/2008), oppfyller kriteriene for PBT- eller vPvB-stoffer eller er like bekymringsfulle.
Definisjon fra forordningen om biologiske agenter
I følge BioStoffV er biologiske midler i hovedsak mikroorganismer, proteinstrukturer som kan forårsake sykdommer og cellekulturer.
"I tillegg til det europeiske direktivet 2000/54 / EF (beskyttelse av arbeidstakere mot risiko fra biologiske agenser på jobben) setter forordningen om biologiske agenter også det europeiske direktivet 2010/32 / EU (unngå skader fra skarpe / spisse instrumenter i sykehus og helsesektor) i tysk lov om arbeidsbeskyttelse.
Forordningen om biologiske agenter regulerer arbeidsrelaterte aktiviteter med biologiske agenser, dvs. i vid forstand med mikroorganismer / patogener. Den inneholder forskrifter for beskyttelse av ansatte under disse aktivitetene, i. H. for å beskytte mot infeksjoner så vel som mot sensibiliserende, giftige eller andre helseskadelige effekter. Forordningen om biologiske agenter deler biologiske agenser i fire risikogrupper. Risikovurderingen og definisjonen av nødvendige tiltak utføres på dette grunnlaget. "
Viktigheten av naturlig produktkjemi
farmakologi
Siden Alexander Flemings oppdagelse av penicillin har naturlige stoffer blitt en viktig kilde til blystrukturer for aktive farmasøytiske ingredienser. Naturlige stoffer har farmakologiske effekter som antibiotika , immunsuppressiva , enzymhemmere , reseptorantagonister og agonister , toksiner , antitumoral og antivirale midler.
Et helt utvalg av aktive ingredienser er avledet av naturlige stoffer i dag. I tillegg til β-laktamantibiotika inkluderer dette også kjemoterapeutiske midler som paclitaxel fra stillevtreet i Stillehavet ( Taxus brevifolia ) eller epothilon fra myxobacterium Sorangium cellulosum .
Nukleosider er modifisert slik at de kan brukes som antivirale midler, slik som den HIV-aktive ingrediensen zidovudin .
Århundrer med erfaring i folkemedisin har gjort oppmerksom på mange planter og dermed deres bestanddeler som blystrukturer. For eksempel har ginseng ( Panax ginseng ), ginkgo ( Ginkgo biloba ) eller neem-tre ( Azadirachta indica ) vært gjenstand for intensiv forskning i lang tid .
Blystrukturene oppnådd på denne måten tjener som grunnlag for den farmakologiske optimaliseringen av den aktive ingrediensen. Her er struktur-aktivitetsforhold etablert (QSAR), og prøver å optimalisere de fysiske egenskapene som løselighet i vandige medier. Teknikker som parallell syntese eller kombinatorisk kjemi brukes ofte til dette formålet .
Naturlige stoffer omtales farmakologisk som privilegerte strukturer fordi de dannes under fysiologiske forhold og viser fordelaktige farmakokinetiske egenskaper. Det faktum at rundt halvparten av de bestselgende aktive ingrediensene er naturlige stoffer eller deres derivater, viser den spesielle betydningen av naturlige stoffer for farmakologi.
biologi
Avklaringen av fysiologiske forhold er viktig for biologien . Innenfor naturlige stoffer inkluderer dette biosyntese og den biologiske funksjonen i organismer, det være seg som et enzym , messenger-stoff eller som en energileverandør eller butikk. Messenger-stoffene inkluderer Hormoner , nevrotransmittere og feromoner . Energileverandører og butikker er vanligvis fett, proteiner og karbohydrater. Biosyntesen av naturlige stoffer er like mangfoldig som deres varians i struktur.
Avklaringen av en biosyntetisk vei krever ofte stor innsats. Forskjellige teknikker brukes:
- Isotopteknologi - Potensielle forløpermolekyler er merket med en sjelden, muligens radioaktiv, men ikke for raskt forfallende isotop , slik som 14 C-isotopen (halveringstid 5736 år). Etter at den har blitt introdusert i stoffskiftet (f.eks. Ved å mate eller injisere), observeres skjebnen til isotopen i målmolekylet. Fra dette kan banen til biosyntese utledes.
- Enzymatiske teknikker - her må den biosyntetiske veien være tilnærmet kjent. Man jobber på isolerte enzymer eller med cellekulturer for å studere biosyntetiske veier under laboratorieforhold og ikke lenger in vivo .
- Gentekniske metoder - for eksempel her blir biosyntese av bakterier avbrutt ved hjelp av genmutasjoner; et mellomprodukt av en biosyntetisk sekvens akkumuleres i prosessen.
Organisk kjemi
For organisk kjemi representerer kjemien til naturlige produkter på mange måter en utfordring. På den ene siden innen strukturoppklaring, dvs. analyse: det er ikke uvanlig at flere arbeidsgrupper jobber med strukturoppklaring over en periode på år . Komplekse strukturer som B. Azadirachtin krevde flere forsøk til riktig struktur var bevist. Selv den totale syntesen av et naturprodukt beviser ikke alltid den rette strukturen - som det ble vist av patchuliaalkoholen og syntesen av Büchi.
Generelt er syntesen av en kompleks naturlig substans også en utfordring for organisk kjemi. For å få betydning som et farmasøytisk middel , må en total syntese eller delvis syntese utvikles for et naturlig produkt . Dette er enda viktigere i sammenheng med strukturoptimalisering, fordi tusenvis av forbindelser på grunnlag av et naturlig stoff må syntetiseres for å etablere et struktur-aktivitetsforhold og for å kunne optimalisere de farmakologiske egenskapene. Naturprodukter er vanligvis komplekse forbindelser med chiralitetssentre som må bygges opp i ønsket stereokjemisk konfigurasjon. Reagensene som brukes må være kompatible med de funksjonelle gruppene i molekylet, eller en passende beskyttelsesgruppestrategi må også velges.
De totale syntesene av vitamin B 12 av Robert B. Woodward og Albert Eschenmoser i 1973, syntesen av palytoksin av Yoshito Kishi i 1994 eller løpet for den første totale syntesen av taxol viser hvor lang og arbeidskrevende en naturlig produktsyntese kan være mellom Robert A. Holton , Kyriacos C. Nicolaou og Samuel J. Danishefsky fra samme år. Syntesen av vitamin B 12 tok rundt 20 års utviklingsarbeid. For dette formål, helt nye reaksjonstrinn måtte utvikles, og for vitamin B 12 , den regler Woodward-Hoffmann med skapt nye teoretiske grunnlag. Roald Hoffmann ble tildelt Nobelprisen for deres utvikling . Robert B. Woodward hadde allerede mottatt en pris i 1965 for sitt arbeid innen naturproduktkjemi.
En annen betydning av naturlige produkter i organisk kjemi er bruken som kilde til syntetiske byggesteiner. Mange naturlige stoffer, som f.eks B. sukker eller aminosyrer er chirale forbindelser og kan brukes som forløpermolekyler for chirale synteser eller som reagenser. Men naturlige produkter kan også bare være en kilde for komplekse utgangsforbindelser og til og med for industrielle synteser. For eksempel er shikiminsyre utgangsmaterialet for storskala syntese av den influensaaktive ingrediensen oseltamivir (Tamiflu) fra Roche .
Klassifisering etter biologisk funksjon
Når man klassifiserer naturlige stoffer i henhold til deres biologiske funksjon, skilles det mellom primære naturlige stoffer og sekundære naturlige stoffer . Skillet går tilbake til Nobelprisvinneren Albrecht Kossel .
I dag er denne klassifiseringen ganske vilkårlig og historisk, men den brukes fortsatt i litteraturen. Denne klassifiseringen er foreldet i form av både kjemisk struktur og biologisk funksjon, ettersom et naturlig stoff både kan ha en livsopprettholdende funksjon i betydningen Kossel, men kan også ha klassiske funksjoner av sekundære naturlige stoffer (transmittermolekyler, feromoner, anti- fôring osv.).
Primære naturlige stoffer
I følge A. Kossels definisjon inkluderer primære naturlige stoffer alle forbindelser som er nødvendige i organismen for livsstøtte og vekst. Dette er imidlertid ikke en strengt avgrenset klasse, og overgangene mellom de primære og sekundære metabolske banene er flytende.
Primære naturlige stoffer finnes under utvikling ( vekst ) av levende vesener, men også under nedbrytningen i mindre molekyler, som kan assosieres med en økning i energi for organismen. Denne energien kan igjen brukes til å bygge andre primære eller sekundære biomolekyler. Oppbygging og nedbrytning av naturlige stoffer er grunnlaget for energi og massemetabolisme i alle organismer.
Sekundære naturlige stoffer
Sekundære naturlige stoffer dannes av mange grunner, men er ikke essensielle for organismenes liv. Spesielt som sekundære plantestoffer representerer de et veldig stort utvalg av kjemiske strukturer og dannes i det som kalles sekundær metabolisme. Dette følger av den primære metabolismen og kan derfor ikke finne sted uavhengig av den. Imidlertid er den sekundære metabolismen ikke involvert i energimetabolismen og er verken en del av den anabole (oppbyggende) eller den katabolske (nedbrytende) metabolismen. Sekundære naturlige stoffer dannes bare i spesielle celletyper . Overgangene fra primære metabolske produkter til sekundære metabolske produkter er flytende. Den biologiske funksjonen til sekundære naturlige stoffer er veldig mangfoldig og ofte ikke kjent.
Klassifisering i henhold til kjemisk struktur
Ved klassifisering av naturlige stoffer i henhold til deres kjemiske struktur ( stoffklasse ) skilles det mellom biomolekyler og biomolekylgrupper i henhold til deres funksjonelle grupper , dvs. H. deres strukturelle design. Når det gjelder naturlige stoffer, kan man finne både små, enkle molekyler som f.eks B. steroider , aromatiske forbindelser eller fettsyrer , men også svært komplekse biopolymerer som proteiner , DNA og karbohydrater . Denne klassifiseringen er heller ikke å anse som absolutt, siden sammensatte stoffer, f.eks. B. et høyt glykosylert protein ( glykoprotein ), kan ikke tildeles en ren kjemisk klasse av stoffer.
Aminosyrer, peptider og proteiner
De proteinogene aminosyrene er utelukkende α-aminosyrer. Imidlertid forekommer β-aminosyrer som β-alanin, β-aminosmørsyre eller γ-aminosmørsyre også naturlig. Alle naturlig forekommende α-aminosyrer (med unntak av glycin ) er kirale . Nesten alle er L- aminosyrer.
Fullstendig syntese av alle 20 biogene kanoniske aminosyrer kan bare finnes i mikroorganismer og planter. Dyr - inkludert mennesker - må ta inn visse aminosyrer - hos mennesker er dette valin , leucin , isoleucin , metionin , treonin , lysin , fenylalanin og tryptofan , og i barndommen også tyrosin - som essensielle aminosyrer med maten. For fisk og insekter er arginin og histidin også viktig.
De proteinogene aminosyrene danner grunnlaget for alle varianter av aminosyrer. Andre aminosyrer som B. Ornitin eller homoserin forekommer i proteiner og som metabolske produkter. Andre ikke-proteinogene aminosyrer dannes ved hydroksylering av proteinogene aminosyrer. Dette inkluderer B. 4-hydroksyprolin . Produkter fra N- metylering eller jodering kan også bli funnet. Noen halogenerte aminosyrer har blitt funnet i bløtdyr . Til dags dato er det identifisert totalt over 400 aminosyrer som ikke er innlemmet i proteiner. Mange av disse dannes ved hydroksylering eller metylering av homologe proteinogene aminosyrer. De forekommer i peptidantibiotika eller som giftstoffer (for eksempel i sopp med døds cap ). Sjeldne aminosyrer som canavanin ( Fabaceae ), mimosine ( mimosa arter) og 2-metylensyklopropylglycin ( Sapindaceae ) fungerer som antagonister for de strukturelt relaterte aminosyrene arginin , fenylalanin og tyrosin eller leucin og er derfor toksiske.
Peptider og proteiner
Både peptider og proteiner er kjeder av aminosyrer som er knyttet til hverandre via en amidbinding . Her skilles det mellom oligopeptider , peptider og proteiner avhengig av antall aminosyrer og molær masse .
| Etternavn | Antall aminosyrer | molær masse |
|---|---|---|
| Oligopeptid | 2-10 aminosyrer | |
| peptid | > 10 til ca. 80-90 aminosyrer | |
| protein | fra ca. 80-90 aminosyrer | fra 10.000 Da eller 10 kDa |

Skillet mellom peptid og protein er basert på det faktum at proteiner ikke kan passere gjennom dialysemembraner på grunn av deres høye molare masse . Siden molekylmassen til proteiner er ganske stor, er måleenheten som ofte brukes her kilodalton (enhetssymbol kDa), som tilsvarer den normale masseenheten som brukes for atomer og molekyler, men er utvidet med prefikset “kilo” ( og dermed med en faktor på 10 3 ).
På grunn av den vektorielle binding av en asykliske peptid eller protein, skilles det mellom de to ender, den N- terminale ende (enden med en fri eller modifisert aminogruppe) og den C- terminale ende (enden med en fri karboksylatgruppe).
Peptider som bare er bygd opp fra aminosyrer kalles homeomere peptider. Peptider som også inneholder pseudo-aminosyrer, blir referert til som heteromere peptider. Til pseudoaminosyrene z. B. beregnet hydroksykarboksylsyrer , som avbryter den vekslende amidstrukturen til et peptid ved en esterbinding .
Sykliske peptider kalles også peptolider. Avhengig av om aminosyrene i et peptid bare er knyttet til hverandre via amidbindinger eller om det er andre bindinger som disulfidbroer , snakker man i det første tilfellet om homodetiske peptider og ellers om herodetiske peptider. Mange peptider har en strengt lineær struktur - men det er også forgrenede peptider som dannes ved reaksjoner på sidekjedene. De ribonukleaser er et eksempel på forgrenede peptider.
På grunn av sin modulære struktur er proteiner og peptider veldig varierende i fysiske egenskaper og har derfor veldig spesielle og veldig forskjellige funksjoner i organismer . De viktige oppgavene til proteiner inkluderer å fungere som enzymer , dvs. de katalyserer biokjemiske reaksjoner, er giftstoffer for forsvar mot fiendtlige organismer, er en viktig del av immunsystemet , de danner kroppsstrukturer som muskler og er sendermolekyler.
karbohydrater
Det skilles mellom karbohydratene mellom monosakkarider , oligosakkarider og polysakkarider i henhold til følgende skjema:
| Etternavn | Antall monosakkarid enheter |
Eksempler |
|---|---|---|
| Monosakkarider | 1 | Glukose , fruktose |
| Oligosakkarider | 2-9 | Sukrose , maltose , raffinose |
| Polysakkarider | > 10 | Stivelse , cellulose |
Når det gjelder polysakkarider, skilles det mellom homopolysakkarider som stivelse, som består av en alternerende sukkerenhet, og heteropolysakkarider som inneholder forskjellige sukkerarter.
Karbohydrater har en rekke funksjoner i organismen. De er et energilager, som kan mobiliseres meget raskt, danner den ytre skjelett av de leddyr i form av kitiner , som cellulose de er en viktig bestanddel av celleveggene av planter og med deres stivelse de er et energilager for planter og dermed også en viktig energileverandør for forbruk av dyr og mennesker.
Monosakkarider
De vanligste monosakkaridene er aldoheksoser og pentoser og deres 2-keto-varianter. Av disse har glukose en sentral og viktig rolle i metabolismen av karbohydrater og dermed også i energibalansen til organismer. Nedbrytningen av monosakkarider for energiproduksjon i form av adenosintrifosfat (ATP) kalles glykolyse . Det foregår i praktisk talt alle organismer i samme form.
Alle monosakkarider er kirale forbindelser, og praktisk talt alle naturlig forekommende monosakkarider kommer fra D- serien. Hvis en hydroksylgruppe er fjernet i stoffskiftet , snakker man om deoksy-sukker. Deoksysukkerne er for det meste deoksylal-doser, som vanligvis finnes i glykosidbindinger . Et eksempel på dette er deoksyribose som en komponent i deoksyribonukleinsyre (DNA). Forgrenet deoksy-sukker er også kjent som metyllose og er viktig som en blodgruppesubstans eller i hjerteglykosidene . De dannes i organismen gjennom karbonoverføring eller omorganiseringsreaksjoner .
I tillegg til monosakkaridene, som ikke har noe annet heteroatom bortsett fra oksygen, er aminosukkerne viktige. Glykosidisk bundet, de er en del av antibiotika, en del av murein i celleveggene til bakterier og byggesteiner av kitin rustning.
Cladinose , et eksempel på metylose
Monosakkarider forekommer fritt i naturen, men også i bundet form som karbohydrater, som sukkerinnholdet i et glykosid og som estere av uorganiske syrer slik som fosforsyre eller monosvovelsyre.
De er bygd opp i planter fra karbondioksid og vann i Calvin-syklusen i fotosynteseprosessen . I tilfelle utilstrekkelig inntak av karbohydrater, må dyr og mennesker ty til aminosyrer for å syntetisere monosakkarider fra dem. Imidlertid er denne prosessen forbundet med økt energiforbruk. De forskjellige monosakkaridene kan omdannes til hverandre av alle organismer, slik at, i motsetning til fettsyrene og aminosyrene, ikke er kjent essensielt sukker.
Syklitoler
Syklitolene er nært beslektet med monosakkaridene. Dette forstås å bety cykloalkaner med minst tre hydroksylgrupper. De vanligste representantene her er heksahydroksysykloheksanene, som også kalles inositter . De kommer i fri form eller fosforyleres . Mer nylig ble deres rolle som en andre messenger ( andre messenger ) oppdaget. Substitusjonen av en eller flere hydroksylgrupper med en aminogruppe gir aminodeoksyinositter.
Di- og oligosakkarider
Oligosakkarider består av to eller flere sukkerenheter og blir derfor referert til som di-, tri-, tetrasakkarider, etc. Det klart vanligste disakkaridet er sukrose (sukkerrør eller sukkerroer), som består av en glukose og en fruktoseenhet.
Sukrose finnes i mange planter. Den oppnås industrielt fra dyrkede former for sukkerrør ( Saccharum officinarum , innhold 14–20%) og sukkerroer ( Beta vulgaris , innhold 16–20%).
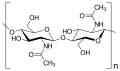
Et annet veldig viktig disakkarid er laktose , som praktisk talt er den eneste kilden til karbohydrater i dietten til nyfødte hos pattedyr (Mammalia). Laktose består av 1,4-bundet galaktose med glukose . Andre viktige representanter for disakkaridene er trehalose (insekter, sopp, gjær, alger, bakterier og mose), gentiobiose (f.eks. Som sukkerrester av amygdalin - glykosidet av bitter mandel ( Prunus amygdalus amara )) og primaverine (fra primula ( Primula) )).
Polysakkarider
Polysakkarider er allestedsnærværende naturlige stoffer. Et viktig polysakkarid er stivelse , et vegetabilsk reserve stoff som er av stor betydning for ernæring fra mennesker og dyr. Polysakkarider tjener som reservemateriale eller danner strukturen til celler eller organismer. De danner også grunnlaget for celleveggene som omgir cellene til bakterier og planter. Som en komponent i celleveggen til planter er cellulose av enestående betydning, noe som også spiller en viktig rolle i ernæringen til drøvtyggere . Andre viktige polysakkarider som fungerer som celleveggbyggesteiner i planter er pektiner og hemicelluloser . Holdige polysakkarider som aminosukkere brukes i dyr og sopp i form av kitin før, noe som er et homopolysakkarid av N -acetyl glukosamin er.
En rekke polysakkarider har naturlig eller kjemisk modifisert betydning som tilsetningsstoffer i næringsmiddelindustrien, farmasøytisk, tekstil- og kosmetikkindustrien. De fås enten fra plantemateriale eller bioteknologisk . Disse inkluderer xantan , dekstran , levan og pullulan .
Glykosider
Glykosider er konjugater av mono- eller oligosakkarider med alkoholer, tioler , aldehyder eller amider , som er koblet direkte via det anomere karbonatomet eller via et heteroatom. C- glykosider er også kjent der det er en ren karbon-karbonbinding fordi den anomere hydroksylgruppen ble fjernet før koblingen. Avhengig av type binding, snakker man om O , S , N eller C glykosider.
Strengt tatt er oligo- og polysakkarider også glykosider, men begrepet glykosid brukes vanligvis bare for konjugater med ikke-karbohydratrester. Denne resten er kjent som aglykonen. Det er funnet en rekke forbindelser for aglykonen. Bare noen få viktige representanter er oppført her som eksempler.
| Funksjonell gruppe av aglykonen bundet til sukkeret | Etternavn | struktur | Hendelse |
|---|---|---|---|
| fenol | Arbutin | 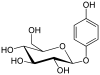 |
Arbutin er et enkelt glykosid og forekommer i et bredt utvalg av frukt. Aglykonen her er en hydrokinon og sukkerresten er en β-glukose. |
| alkohol | Oleandrin | 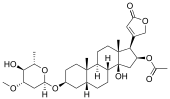 |
Oleandrin er en ingrediens i oleander ( Nerium oleander ) og har et steroid som en aglycon |
| alkohol | Digitoxin |  |
Digitoxin er en ingrediens i den røde fingerbølen ( Digitalis purpurea ) og har et steroid som aglykon |
| Thiocarboxamide | Sinigrin | 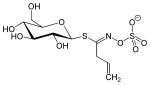 |
Sinigrin er en ingrediens i svart sennep ( Brassica nigra ) og pepperrot ( Armoracia rusticana ) og har et allyltiokarboxamid som aglykon |
| Aldehyd (cyanohydrin) | Amygdalin |  |
Amygdalin er det cyanogene glykosidet av den bitre mandelen ( Prunus amygdalus amara ) og bærer cyanohydrinet av benzaldehyd som en aglykon |
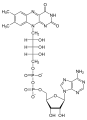
| Nitrogen heterosyklus | Adenosine |  |
Adenosin er en byggestein av DNA og har en purinbase som aglykon |
| Antrakinon | Barbaloin |  |
Barbaloin forekommer i forskjellige typer aloe ( aloe ) og har et antrakinonderivat som aglykon |
Glykosider brukes hovedsakelig i legemidler som hjerteglykosider (digitoksin) eller som antibiotika ( erytromycin ) og er hentet fra naturlige kilder. Biologisk er de av uunnværlig betydning som byggesteiner for DNA og RNA.
Dannelsen av glykosider i organismer tjener ofte til å bringe en ganske apolar aglykon i en vannløselig form.
Peptidoglykaner
Peptidoglykaner, også kalt murein, er konjugater av polysakkarider med peptider. De gir celleveggene til bakterier sin styrke. De består av et disakkarid ( N- acetylglukosamin β- (1,4) -bundet med N- acetylmuraminsyre ), som danner et polysakkarid og er tverrbundet via korte peptidkjeder. Tverrbindingen dannes av en transpeptidase , som kan inhiberes av antibiotika og dermed forhindre oppbygging av stabile cellemembraner.
Lipider
Lipider er en samlebetegnelse for ikke-polære forbindelser som kan ekstraheres fra organisk materiale med ikke-polære organiske løsningsmidler som eter , petroleumeter eller kloroform . Dette begrepet er rent historisk, da det trekker ut forbindelser som ikke har noen strukturell likhet med hverandre (som terpener eller steroider ), mens andre er strukturelt lik fett - som glykolipider .
I dag er lipider forbindelser som er avledet fra fett , dvs. estere av fettsyrer med en- eller flerverdige alkoholer.
Fettsyrer

De vanligste naturlige fettsyrene er langkjedede karboksylsyrer med et jevnt antall karbonatomer. Det skilles mellom mettede og umettede fettsyrer, dvs. med eller uten (en eller flere) dobbeltbindinger i alkylkjeden. Dobbeltbindinger av naturlige fettsyrer er alltid Z- konfigurert ( cis- konfigurasjon).
Noen av de umettede fettsyrene er essensielle for mennesker fordi de ikke kan syntetiseres av kroppen og derfor må inntas med mat. De er delvis henholdsvis vitamin F.
I naturen er fettsyrer sjelden gratis, men er vanligvis knyttet til alkoholer via en esterbinding. Den vanligste alkoholkomponenten er glyserin (glyserolipider). Estere med aminoalkoholer (sfingolipider), monosakkarider (glykolipider), dioler (diollipider) og myo-inositol er også kjent .
Grenede, langkjedede alifatiske karboksylsyrer, på grunn av deres helt forskjellige biosyntese, er ikke klassifisert som fettsyrer, men som terpener .
Eikosanoider
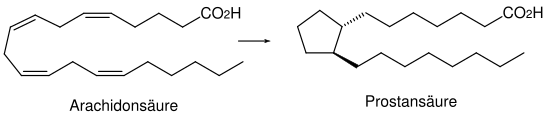
Umettede fettsyrer danner utgangsforbindelsene for et stort antall regulerende stoffer. Grunnlaget for dette er arakidonsyre , som er en umettet fettsyre og inneholder tjue karbonatomer. Derfor er navnet eikosanoider avledet . Arakidonsyren dannes i organismen fra den essensielle linolsyre gjennom kjedeforlengelse og dehydrering.
Rammen til prostaglandinene , som er de viktigste eikosanoidene, er avledet av prostansyre . De består alltid av en femleddet ring med to tilstøtende sidekjeder. Både sidekjedene og den femleddede ringen kan bære forskjellige funksjonelle grupper.
De analoge forbindelsene med en seksleddet ring kalles tromboksaner .
Fett

Fett er estere av fettsyrer med glyserin. Dette er for det meste triglyserider, fordi mono- og diglyserider bare spiller en rolle som metabolske mellomprodukter og er sjelden gratis. Siden glyserin er en treverdig alkohol, er det også blandede estere i tillegg til estere av tre molekyler av samme fettsyre. Hvis dette gir glyserolresten et sentrum for asymmetri, er fett kirale forbindelser og optisk aktivt gjennom biosyntese via L- glyserol-3-fosfat (G3P).
Fett finnes i alle dyr som energibutikker i spesialiserte vev; fettvev kan inneholde opptil 80% fett. Frøene til forskjellige planter lagrer også fett.
Det er vanligvis ikke mulig å skille forskjellige fettstoffer, da de er flere blandinger av stoffer med veldig like kjemiske og fysiske egenskaper.
Voks
Voks er ikke-polære estere av fettsyrer og sykliske eller langkjedede alifatiske alkoholer. Naturlig forekommende voks er vanligvis vanskelig å skille blandinger av stoffer, som er mer av teknisk betydning. Voks fungerer vanligvis som strukturerende midler, for eksempel i bikaker, og kan i de fleste tilfeller sannsynligvis ikke lenger mates inn i stoffskiftet. Unntak er visse marine dyr som produserer voks som reservemateriale, som f.eks B. Hval Rotte ( Cetaceum ). I planter danner voks skjellaget som beskyttelse mot fordampning. Alkylgruppen i alkoholgruppen kan være forgrenet eller uforgrenet. Hos pattedyr består alkoholgruppen for det meste av kolesterol .
Komplekse lipider
Som komplekse lipider eller membrandannende lipider kalles slike lipider som er involvert i syntesen av cellemembraner. I tillegg til de ikke-polære fettsyrerester, har disse lipidene polare grupper. Disse polare gruppene gir dem muligheten til å selvorganisere seg i vandige medier. Dette kan demonstreres under laboratorieforhold ved dannelse av liposomer . En lignende struktur kan bli funnet i cellemembraner. I vandige medier organiserer polargruppene seg i retning av det polære vannet, og de ikke-polare gruppene danner et lipiddobbeltlag - med vann utenfor og inne i lipid-dobbeltlaget.

Fosfolipider , sfingolipider og glykolipider er cellemembrandannende lipider. De skiller seg ut i polare rester. Når det gjelder fosfolipider, er det en fosforsyreester av diglyserid. Det er fortsatt polare rester på fosfatresten, slik som kolin ( lecitin ) eller etanolamin ( cefalin ). I motsetning til fosfolipidene er sfingolipider avledet fra sfingosin . Fettsyren er bundet til sfingosinet via en amidbinding, som igjen er koblet til en polær gruppe som serin , etanolamin eller kolin via en fosfatrest gjennom esterbindinger . Glykolipider, derimot, er forskjellige fettsyrederivater med en sukkergruppe som en polær rest.Disse kan enten være av glycerid-typen, av sfingolipid-typen eller enkle fettsyreestere av monosakkaridene.
Isoprenoidforbindelser
Isoprenoidforbindelser er avledet fra isopren og er formelt oligomerer eller polymerer av isopren. Dette prinsippet ble anerkjent av Nobelprisvinneren Leopold Ružička . Fra dette dannes gruppen av naturlige stoffer som kalles terpener og steroider. Sistnevnte er også terpener i ordets rette forstand, men betraktes separat på grunn av deres spesielle biologiske betydning. Felles for alle terpener er at de er bygget opp fra mevalonsyre og via mevalonsyreveien med samme navn .
Terpenes
Terpengruppen av stoffer har et stort utvalg av karbonstrukturer. Felles for dem alle er imidlertid at de er avledet av isopren og representerer multipler av dette molekylet. Man skiller terpenene i henhold til antall karbonatomer. Nesten alle terpenstrukturer har vanlige navn og er oppkalt etter deres biologiske kilde. Funksjonelle grupper legges ofte til som et prefiks eller suffiks til navnet på karbonstrukturen.
| Etternavn | Antall karbonatomer | Antall isoprenenheter | Eksempler |
|---|---|---|---|
| Isopren | 5 | 1 | Isopren |
| Monoterpenes | 10 | 2 | Mentol , karvone , thujanon , kamfer |
| Sesquiterpenes | 15. | 3 | Farnesol , sesquisabines , cadalenol , artemisites |
| Diterpenes | 20. | 4. plass | Retinal (vitamin A), Paclitaxel , Rosan , Nimbion , Gibberellan |
| Sesterterpenes | 25 | 5 | Neomanoalid , Scalarin , Hyrial |
| Triterpenes | 30. | Sjette | Squalene , Protostane , Lanosterol , Oleanane |
| Tetraterpenes | 40 | 8. plass | Karotener (provitamin A), xanthophylls |
| Polyterpener | > 40 | > 8 | Naturgummi , gutta-percha |
Monoterpenene inkluderer også iridoidene , som er preget av den grunnleggende kroppen iridodial .
Sesterterpenene representerer en kvantitativ liten gruppe terpener. Hvis karbonatomer fjernes under metabolismen, får forbindelsene prefikset Nor, slik som sesquiterpene norpatchoulenol , der et metanmolekyl formelt ble fjernet fra den opprinnelige patchoulialkoholen .
Terpener oppfyller en rekke biologiske funksjoner, alt fra aromaer og dufter til feromoner til vitaminfunksjoner (vitamin A) og hormonforløpere (steroidhormoner). Deres tekniske anvendelser spenner fra legemidler ( taxol ) eller steroider til insektmidler ( pyretroider ) og luktende stoffer for kosmetikkindustrien.
Steroider
Steroider er utbredte naturlige stoffer i dyre- og planteverdenen. De er alle avledet fra triterpen squalen , som sykliserer for å danne den tetracykliske steranstrukturen. I naturlig forekommende steroider, ringene B og C og ringene C og D er hver koblet trans og disse kalles gonans . Ringer A og B til gonan kan kobles enten til cis - (5β-gonan) eller trans - (5α-gonan). Når det gjelder naturlige steroider, er disse alltid cis -forbundet, dvs. 5β-gonaner. Det viktigste steroidet hos mennesker og dyr er kolesterol , som ikke finnes i planter. Lipoproteiner og steroidhormoner er bygget fra kolesterol , akkurat som hormonene i binyrebarken ( kortikosteroider ). Kjønnshormonene til pattedyr, inkludert mennesker, er steroider.
Polyprenyl hydrokinoner
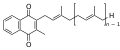
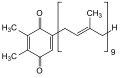
Det humane vitaminet K i tillegg til flere andre lignende stoffer i alle levende ting har det felles trekk ved en hydrokinonrest og en festet polyprenylrest. De mest kjente eksemplene og deres forkortelser er ubikinoner (hos mennesker ubikinon-10 , koenzym Q-10), fyllokinon (vitamin K), menadion , menakinon (MK), plastokinon (PQ) og tokokinon . Relativt komplekse prøvepreparater og analytiske metoder kreves for pålitelig påvisning av disse stoffene , som f.eks B. Tokokinon. De fungerer som elektrontransportører i mitokondriell og bakteriell respirasjonskjede .
Aromatiske forbindelser
I organismer er det i utgangspunktet tre biosyntetiske veier som fører til aromatiske forbindelser - den shikimate banen , den malonate banen og den mevalonate banen .
Den shikimate banen er basert på karbohydratmetabolismen og går gjennom shikiminsyren til de aromatiske naturlige stoffene. Denne banen foregår hovedsakelig i høyere planter. Disse naturlige stoffene er ofte preget av sterkt oksyderte fenolaromater med en lineær sidekjede med funksjonelle grupper. Fenolgruppene er for det meste i 3-, 4- og 5-posisjonene til sidekjeden.
Malonatveien (polyketidvei) er basert på fettsyremetabolismen. Sammenstillingen av acetatenheter skaper en polykarbonylforbindelse som kan sykle i en eller flere aldolkondensasjoner for å danne mononukleære eller polynukleære aromater. Disse forbindelsene er preget av sterkt oksyderte aromater, som ofte også inneholder kinoner eller hydrokinoner , men uten lengre sidekjeder. Oksygengruppene er derfor i 1,4-stilling. Malonatveien finnes hovedsakelig i mikroorganismer.
Mevalonatweg fører også til aromatiske naturlige stoffer, terpenene. Et eksempel er biosyntese av tymol . Aromatene produsert på denne måten bærer ofte isopropylgruppene som er karakteristiske for terpener .
Dyreorganismer produserer sjelden aromatiske forbindelser selv. Disse er derfor vanligvis essensielle matkomponenter (aromatiske aminosyrer og vitaminer).
Fenylpropanderivater
Fenylpropanderivater er aromatiske forbindelser med en propyl-sidekjede. Den aromatiske bærer ofte hydroksyl- eller metoksygrupper. Propyl-sidekjeden kan være mettet eller umettet, danne en syklus eller bære forskjellige funksjonelle grupper. Denne klassen av forbindelser dannes i planter og mikroorganismer via den shikimate biosyntetiske banen . Sammen med terpener er fenylpropanoider den nest vanligste bestanddelen av essensielle oljer. Velkjente fenylpropaner er kanelaldehyd , anetol og estragol . Som et byggemateriale for tre, er ligniner en polymer av fenylpropanderivatene.
Flavonoider
Flavonoider tilhører plantens pigmenter og er strukturelt avledet fra fenylpropanoider. Derfor finner man ofte fenoler eller metoksyfenoler her . De er ofte glykosidisk bundet med karbohydrater og danner aglykonen. Avhengig av den funksjonelle gruppen på den heterosykliske ringen, skilles det mellom flavan, flavon, flavonol, flavonon og flavonolol. Flavonoider er primært viktige som plantepigmenter og danner flertallet av alle blomsterpigmenter.
Garver
Den generiske betegnelse garvemidler refererer til uorganiske og organiske forbindelser som er i stand til å konvertere animalske huder til lær . De organiske solariumene har det til felles at de inneholder fenolgrupper , men de danner ikke en enhetlig klasse av stoffer. Det viktigste og mest kjente garvemidlet, som er et av de naturlige stoffene, er tannin og er en polyhydroksyfenol. Garvemidlene inkluderer også noen fenoliske flavoner og deres dimere kondensasjonsprodukter. Disse, som flavonene i seg selv, er ofte i form av aglykoner av glykosider.
Polyketides
Polyketidene er en stor og veldig heterogen gruppe av naturlige produkter. Den inkluderer alifatiske , sykliske , acykliske og aromatiske forbindelser. Deres biologiske funksjoner er ofte ukjente. De har veldig store strukturelle forskjeller, men alle tilhører samme klasse av naturlige produkter. Polyketides er preget av en felles biosyntetisk vei. Felles for dem alle er at de inneholder et karbonstamme som består av eddiksyre og propionsyre. Som med terpenene skilles det mellom polyketidene i henhold til antall acetatenheter.
Polyketokarboksylsyrer danner utgangspunktet for alle ketider. I utgangspunktet, finner vi reaksjonene i biosyntesen av polyketider Claisen Esterkondensation , den aldolkondensasjon og Dieckmann kondens .
Følgende reaksjoner er kjent som aldolreaksjoner , dannelse av enolestere eller -etere , metyleringer, kloreringer eller hydroksyleringer, men også reduksjoner av karboksyl- eller karbonylgruppene til alkoholer eller metylengrupper. Den dekarboksylering av den β-keto-syregruppene er også observert.
Heterosykler
Pteridiner
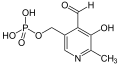
De pteridines er utledet fra den grunnleggende struktur av pteridin , for eksempel vitaminer riboflavin (vitamin B 2 ) og folsyre , coenzymene FAD og FMN og molybden kofaktorer , som alle er avledet fra molybdopterin . Deres funksjoner som medfaktorer er forskjellige.
Pyridinderivater
Spesielt nikotinsyre (vitamin B 3 ) og pyridoksalfosfat med dens forløpere pyridoksin , pyridoksal og pyridoksamin (vitamin B- 6 ) faller inn i denne klassen av substanser.
Nukleosider
Som nukleosider er N- glykosider av heterosykliske angitte systemer. I en smalere forstand kalles spesielt byggesteinene til DNA og RNA nukleinsyrer. Med disse nukleinsyrene er sukkerresten alltid en ribose (RNA) eller deoksyribose (DNA). I DNA bruker deoksyribonukleinsyre den genetiske informasjonen som er lagret. Ved hjelp av ribonukleinsyrer kan RNA katalysere biokjemiske reaksjoner og fungere som en signalgiver eller informasjonslager.
Naturlige nukleosider med purinbaser ( adenin , guanin ) og med pyrimidinbaser ( cytosin , tymin og uracil ) er kjent.
| Puriner | Pyrimidiner | ||
|---|---|---|---|
 Adenine (A) |
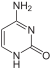 Cytosin (C) |
||
 Guanine (G) |
|
||
| Strukturformler av nukleobasene i DNA (A, G, C, T) og RNA (A, G, C, U). Den N - glykosidbinding til ribose eller deoksyribose i DNA foregår i hvert tilfelle ved NH-gruppen som peker nedover på figurene. | |||
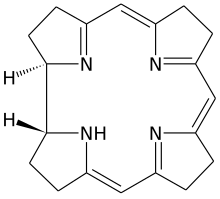
Porfyriner og korrinoider
Den primære naturlige produkter omfatter også en rekke andre klasser av forbindelser, så som tetrapyrroler , som er dannet av fire pyrrolringer rester forbundet med en metin bro. Her er de ringformede tetrapyrrolene, porfyrinene og klorinene av største betydning . Forfyrinene danner grunnlaget for klorofyll , cytokrom og hemoglobin og er den komplekse liganden for et jern (II) atom. I klorofyllene er klorinene den komplekse liganden for magnesium (II) som det sentrale atomet. De har en rekke oppgaver i organismen, alt fra oksygentransport og lagring (hemoglobin og myoglobin ) til elektron- og energioverføring til katalyse av biokjemiske reaksjoner (vitamin B 12 og cytokrom P 450) som et koenzym .
Alkaloider
Allerede i 1806 var morfin det første alkaloidet som ble isolert av den tyske farmasøyten Friedrich Sertürner . Begrepet alkaloider ble laget i 1819 av Carl Friedrich Wilhelm Meißner , som forsto det å bety alle grunnleggende naturlige stoffer. Begrepet ble senere utvidet til å omfatte andre nitrogenholdige naturlige stoffer. I dag er alle nitrogenholdige naturlige stoffer oppsummert under dette navnet, selv om det fremdeles ikke er noen enhetlig definisjon. Alkaloider har ofte biologiske effekter og danner et viktig grunnlag som blystrukturer for aktive farmasøytiske ingredienser.
Det er forskjellige navn på alkaloidklassene som ikke brukes jevnt i litteraturen. På den ene siden blir alkaloider navngitt etter deres botaniske opprinnelse - Solanum -, Papaver -, Angostura -, Lobelia- alkaloider osv. - men på den andre siden er de også delt inn i pyridin, kinolin eller steroidalkaloider av deres kjemiske moderforbindelse. .
Ofte er bare forbindelser referert til som alkaloider som er avledet fra de proteinogene aminosyrene og inneholder aromatiske nitrogenheterocykler. I henhold til denne definisjonen er imidlertid forskjellige nitrogenholdige naturlige stoffer som konin , piperin og koffein ikke alkaloider.
Den systematiske klassifiseringen av alkaloidene er heller ikke ensartet. På den ene siden er det klassifiseringen i henhold til deres kjemiske struktur, dvs. i henhold til typen av heterocykel: Det er for eksempel steroid , indol , pyridin eller tropanalkaloider . Klassifiseringen etter opprinnelse er også vanlig: ergotalkaloider , curare eller opiater .
I dagens kjemiske litteratur er alkaloider gruppert i følgende grupper, som er klassifisert i henhold til deres kjemiske struktur:
- Alkaloider med piperidin , pyrrol , pyrrolidin og pyridin skjelett
- Alkaloider med isokinolin , kinolin , kinazolin og indol skjelett
- Alkaloider med indolizin , pyrrolizidin og kinolizidin stillaser
- purine alkaloider
- Steroid alkaloider
Biogene aminer
Biogene aminer er forbindelser som dannes ved ganske enkelt å dekarboksylere en aminosyre og spille en rolle som en viktig komponent i lipider, som et koenzym eller som en nevrotransmitter ( acetylkolin , tryptamin , serotonin eller histamin ). Farmasøytisk sett spiller L - dopa som en Parkinsons medisinering en viktig rolle her. Andre kjente representanter er adrenalin , efedrin og meskalin .
Se også
litteratur
- Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs, W. Ternes: Naturstoffchemie , 3., fullstendig revidert. og eksp. Utgave, Springer Verlag 2008, ISBN 978-3-540-73732-2 .
- Peter Nuhn : Natural Products Chemistry. Mikrobielle, vegetabilske og animalske naturlige produkter , 4. utgave, S. Hirzel Verlag, Stuttgart 2006, ISBN 978-3-7776-1363-5 .
weblenker
Individuelle bevis
- ↑ Peter Nuhn : Naturproduktkjemi . Mikrobielle, vegetabilske og animalske naturlige produkter , 2. utgave, S. Hirzel Verlag, Stuttgart 1990, s. 20-23; ISBN 3-7776-0473-9 .
- ^ Otto Krätz: 7000 år med kjemi , Nikol Verlagsgesellschaft, Hamburg 1999; ISBN 3-933203-20-1 .
- ↑ Forklaring av termer og forkortelser. I: REACH Helpdesk. 24. juni 2013. Hentet 29. juli 2019 .
- ↑ a b Forordning (EF) nr. 1907/2006 om registrering, evaluering, godkjenning og begrensning av kjemikalier (REACH) i den konsoliderte versjonen av 2. juli 2019
- ↑ BMAS - Laws: Biological Agents Ordinance ( Memento from August 15, 2014 in the Internet Archive )
- ↑ A. Fleming: På den antibakterielle virkningen av kulturer av en Penicillium, med spesiell henvisning til deres anvendelse ved isolering av B. influenzae. 1929. I: Bull. World Health Organ . Bind 79, nummer 8, 2001, s. 780-790, PMID 11545337 . PMC 2566493 (gratis fulltekst).
- ↑ Mansukhlal C. Wani, Harold Lawrence Taylor, Monroe E. Wall, Philip Coggon, Andrew T. McPhail: Plant antitumor midler. VI. Isolering og struktur av taxol, et nytt antileukemisk middel og antitumor middel fra Taxus brevifolia , i: J. Am. Chem. Soc. , 1971, 93 , s. 2325-2327; doi: 10.1021 / ja00738a045 .
- ↑ Gerhard Höfle, Norbert Bedorf, Heinrich Steinmetz, Dietmar Schomburg, Klaus Gerth, Hans Reichenbach: Epothilon A og B - roman, 16-ledd makrolider med cytotoksiske effekter: isolasjon, struktur i krystall og konformasjon i løsning , i: Angewandte Chemie , 1996, 108 , s. 1671-1673; doi: 10.1002 / anie.19961081342 .
- ↑ Ny introduksjon av zidovudin. I: Zeitschrift für Chemotherapie, 1987, utgave 4. Hentet 4. august 2013 .
- ↑ Lee Jia, Yuqing Zhao: Nåværende evaluering av Millennium Phytomedicine - Ginseng (I): Etymology, Pharmacognosy, Phytochemistry, Market and Regulations , i: Curr. Med. Chem. , 2009, 16 , s. 2475-2484; PMC 2752963 (gratis fulltekst).
- ↑ Lee Jia, Yuqing Zhao, Xing-Jie Liang: Current Evaluation of the Millennium Phytomedicine - Ginseng (II): Collected Chemical Entities, Modern Pharmacology, and Clinical Applications Emanated from Traditional Chinese Medicine , i: Curr. Med. Chem. , 2009, 16 , s. 2924-2942; PMC 2754208 (fri fulltekst).
- ↑ Steven D. Ehrlich: Ginkgo Biloba Review. University of Maryland - Medical Center, 13. desember 2010, åpnet 4. august 2013 .
- Gang S. Ganguli: Neem: En terapeut for alle årstider ( Memento 5. juni 2011 i Internet Archive ) (PDF; 21 kB), i: Current Science , 2002, 82 , s. 1304 (Archive.org).
- ↑ Bernd Schäfer: Naturlige stoffer i den kjemiske industrien , spektrum Akademischer Verlag, Heidelberg 2006; ISBN 978-3-8274-1614-8 .
- ^ Gareth Thomas: Medicinal Chemistry , 2. utgave, John Wiley & Sons Ltd, West Sussex, 2007, s. 90-110, 161-163; ISBN 978-0-470-02598-7 .
- ^ Rolf Breinbauer, Ingrid R. Vetter, Herbert Waldmann: Fra proteindomene til legemiddelkandidater - naturlige produkter som blystrukturer for design og syntese av stoffbiblioteker , i: Angewandte Chemie , 2002, 114 , s. 3002–3015; doi : 10.1002 / 1521-3757 (20020816) 114: 16 <3002 :: AID-ANGE3002> 3.0.CO; 2-V .
- ↑ Herbert Waldmann: Naturlig kombinatorisk - naturlig stoffdrevet medisinutvikling , i: Nachrichten aus der Chemie , 2003, 51 , s. 126-131; doi: 10.1002 / nadc.20030510210 .
- ↑ Rudolf Hänsel , Otto Sticher (red.): Pharmakognosie - Phytopharmazie . 9. utgave. Springer Verlag, Heidelberg 2009, ISBN 978-3-642-00962-4 , s. 18-29 .
- ↑ W. Kreis: Prinsipper for sekundær metabolisme. (PDF) I: Fytokjemiske grunnleggende. SWBplus-katalogforbedringer ved Baden-Württemberg bibliotekservicesenter , åpnet 5. august 2013 .
- ↑ Wolfgang Kraus, Michael Bokel, Adolf Klenk, Helmut Pöhn: Strukturen av azadirachtin og 22,23-dihydro-23β-methoxyazadirachtin , i: Tetrahedron Letters , 1985, 26 ., Pp 6435-6438; doi: 10.1016 / S0040-4039 (00) 99020-8 .
- Bü G. Büchi, RE Erickson, N. Wakabayashi: Terpenes. XVI.1,2 Constitution of Patchouli Alcohol and Absolute Configuration of Cedrene , i: J. Am. Chem. Soc. , 1961, 83 , s. 927-938; doi: 10.1021 / ja01465a042 .
- ↑ G. Büchi, William D. Macleod: Syntese av Patchouli alkohol , i: J. Am. Chem. Soc. , 1962, 84 , s. 3205-3206; doi: 10.1021 / ja00875a047 .
- ^ Gareth Thomas: Medisinsk kjemi s. 90-110.
- B Peter Bützer: Artikkel om vitamin B 12 . (PDF; 481 kB) (Ikke lenger tilgjengelig online.) I: Molecular Dynamics - System Dynamics . Januar 2008, arkivert fra originalen 6. desember 2012 ; Hentet 4. august 2013 .
- ^ KC Nicolaou, EJ Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods , VCH Verlagsgesellschaft mbH, Weinheim, 1996, s. 711-729; ISBN 3-527-29284-5 .
- ^ KC Nicolaou, EJ Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods , s. 655-671.
- ^ Nobelprisen i kjemi 1981. I: Nobelprize.org. Hentet 4. august 2013 .
- ^ Nobelprisen i kjemi 1965. I: Nobelprize.org. Hentet 4. august 2013 .
- ^ KC Nicolaou, EJ Sorensen: Classics in Total Synthesis: Targets, Strategies, Methods , s. 99-134.
- ^ KC Nicolaou, SA Snyder: Classics in Total Synthesis II , Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003; ISBN 978-3-527-30684-8 .
- ↑ Stefan Abrecht, Peter Harrington, Hans Iding, Martin Karpf René Trussardi, Beat Wirz, Ulrich Zutter: The Syntetisk Utvikling av anti-influensa neuraminidase inhibitor Oseltamivirfosfat (Tamiflu ® ): En utfordring for syntese & Process Research , i: Chimia International Journal for Chemistry , 2004, 58 , s. 621-629.
- ↑ R. Carle: Fytokjemikaliene - antistoffer og kosttilskudd? I: vetline.de. 10. oktober 2007, åpnet 5. august 2013 . (PDF).
- ^ Bernhard Watzl, Claus Leitzmann: Bioaktive stoffer i mat , 3. utgave, Hippokrates Verlag GmbH Stuttgart, 2005, s. 15; ISBN 3-8304-5308-6 .
- ↑ Peter Nuhn: Naturstoffchemie , s. 23.
- ^ Hans Beyer , Wolfgang Walter : Lærebok for organisk kjemi , 21. utgave, S. Hirzel Verlag, Stuttgart 1988, s. 822-828; ISBN 3-7776-0438-0 .
- ↑ Hans-Dieter Belitz , Walter Grosch: Lærebok om matkjemi . 4. utgave. Springer Verlag, Heidelberg / Berlin 1992, ISBN 3-540-55449-1 , s. 9 .
- ↑ Peter Nuhn: Naturstoffchemie , s 77..
- ↑ Peter Nuhn: Naturstoffchemie , s 159-160..
- ^ Gerhard Michal: Biochemical Pathway , Spectrum Akademische Verlagsgesellschaft, Heidelberg 1999, s. 37–40; ISBN 3-86025-239-9 .
- ↑ Beyer, Walter: Lærebok for organisk kjemi , s. 405.
- ↑ Peter Nuhn: Naturstoffchemie , s 200-201..
- ↑ Peter Nuhn: Naturstoffchemie , s 209..
- ↑ Peter Nuhn: Naturstoffchemie , s 174-181..
- ^ Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs, Naturstoffchemie , 2. utgave, Springer Verlag, 2002, s. 385; ISBN 3-540-43952-8 .
- ↑ Peter Nuhn: Naturstoffchemie , s 297..
- ^ Nomenklatur for glykolipider. I: IUPAC . Hentet 28. januar 2016 .
- ↑ Peter Nuhn: Naturstoffchemie , s 397..
- ^ Roger RC New (redaktør), Liposomes en praktisk tilnærming , IRL Press ved Oxford University Press, Oxford 1990, s. 13; ISBN 0-19-963077-1 .
- ↑ William H. Elliott, Daphne C. Elliott: Biochemistry and Molecular Biology , fjerde red., Oxford University Press, Oxford 2009, s. 16-26; ISBN 978-0-19-922671-9 .
- ↑ Peter Nuhn: Naturstoffchemie , s. 311–322.
- ↑ Leopold Ružička: Nobel Lecture: Multimembered Rings, Higher Terpene Compounds and Male Sex Hormones. I: Nobelprize.org. 12. desember 1945, åpnet 6. august 2013 . (PDF; 525 kB)
- ↑ Katharina Munk: Grunnleggende studier i biologi: botanikk . Spectrum Academic Publishing House, Heidelberg 2001; ISBN 3-8274-0909-8 .
- ↑ Eberhard Breitmaier: Terpenes: Aromen, Düfte, Pharmaka , Pheromone , BG Teubner, Stuttgart 1999; ISBN 3-519-03548-0 .
- ↑ Beyer, Walter: Lærebok for organisk kjemi , s. 678–679, 686–698.
- ↑ H.-U. Melchert, D. Pollok D, E. Pabel, K. Rubach, H.-J. Stan: Bestemmelse av tokoferoler, tokoferolkinoner og tokoferolhydrokinoner ved gasskromatografi-massespektrometri og preseparering med lipofil gelkromatografi. : I J. Chromatogr. A. 2002 8. november; 976 (1-2): 215-20, PMID 12462612
- ↑ D. Pollok, H.-U. Melchert: Bestemmelse av alfa-tokoferolkinon i humane serumprøver ved væskekromatografi med fluorescensdeteksjon og online etterkolonnederivatisering : I J. Chromatogr. A. 2004 12. nov.; 1056 (1-2): 257-62, PMID 15595560
- ^ Gerhard Michal: Biochemical Pathway , Spektrum Akademische Verlagsgesellschaft, Heidelberg, 1999, s. 59–60, 85–86 og 192; ISBN 3-86025-239-9 .
- ↑ Mikio Yamazaki, Taeko Usui, Shoji Shibata: Biogenesen av planteprodukter. II. Biogenesen av Thymol. ; i: Chemical & Pharmaceutical Bulletin , 1963, 11 , s. 363-365; doi: 10.1248 / cpb.11.363 (fulltekst).
- ↑ Peter Nuhn: Naturstoffchemie , s 522..
- ↑ Peter von Sengbusch, Paul von Sengbusch: Fenol stoffer. I: Sekundær metabolisme av planter. Sekundære planteprodukter (plantestoffer). Botanikk online 1996–2004 fra Universitetet i Hamburg , åpnet 6. august 2013 .
- ↑ Otto Th. Schmidt, Walter Mayer: Naturlige tanniner , i: Angewandte Chemie , 1956, 68 (3), s. 103-115; doi: 10.1002 / anie.19560680305 .
- ↑ Beyer, Walter: Lærebok for organisk kjemi , s. 801–803, 882–883.
- ↑ Beyer, Walter: Lærebok for organisk kjemi , s. 762, 768–769.
- ↑ Beyer, Walter: Lærebok for organisk kjemi , s. 851–858.
- ↑ Beyer, Walter: Lærebok for organisk kjemi , s. 710–717.
- ^ Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs: Naturstoffchemie , s. 131–243.
- ↑ Peter Nuhn: Naturstoffchemie , s. 553–597.