Influensa A-virus H1N1
| Influensa A-virus H1N1 | ||||||||
|---|---|---|---|---|---|---|---|---|
TEM- bilde av H1N1 influensa A-virus | ||||||||
| Systematikk | ||||||||
| Taksonomiske egenskaper | ||||||||
| ||||||||
| Vitenskapelig navn | ||||||||
| Influensa A-virus A / H1N1 | ||||||||
| Kort navn | ||||||||
| FLUAV / (H1N1) | ||||||||
| Venstre | ||||||||
|
Influensa A-viruset H1N1 (A / H1N1) refererer til en undertype av den influensa A-virus (slekten Alphainfluenzavirus ) fra familien Orthomyxoviridae , som forekommer i ender , menneske og gris , men kan også Infisere en rekke andre pattedyr og kalkuner . H1N1 influensavirus ble etablert hos mennesker og griser som et resultat av den spanske influensa i 1918. Denne undertypen har forårsaket titalls millioner menneskelige dødsfall. Våren 2009 spredte en tidligere ukjent undertype av H1N1-viruset, kjent som svineinfluensavirus , seg til Nord-Amerika og forårsaket en annen pandemi , H1N1 2009/10-pandemien .
Det første menneskelige utbruddet: Spansk influensa
Den spanske influensa fra 1918 viste flere særegenheter: Med denne H1N1 hadde det antagelig dukket opp en ny influensaundertype. De tre første bølgene fulgte hverandre i løpet av få måneder, noe som er veldig uvanlig, og det var først med den tredje bølgen at de fulgte "influensasongen" på senvinteren, som er vanlig på tempererte breddegrader. Den dødelighet fokusert på aldersgruppen 15 til 40 år; Gravide kvinner i siste tredjedel av graviditeten viste seg å være ekstremt utsatt . Selv om datasituasjonen er motstridende på dette punktet, ser det ut til at den spanske influensa forårsaker smittsomme enn de vanlige influensavirusene. Den epidemien har ført til svært forskjellige dødelighet i ulike deler av verden, med land i tropiske og subtropiske klima generelt å være spesielt hardt rammet.
Spansk influensa var den største epidemien i moderne tid , selv om det eksakte antallet dødsfall fortsatt er ukjent. De fleste dødsfallene var ikke direkte fra viruset, men fra sekundær bakteriell lungebetennelse . I flere tiår ble dødstallene anslått til 21 millioner, noe som virker for lavt gitt at 17 til 18 millioner mennesker døde bare i Britisk India ; denne informasjonen støttes godt av folketellinger. En enda ekstern balanse kan ikke trekkes fordi borgerkrig raste i to tett befolkede stater - det tidligere tsar-imperiet og Kina . En ekstrapolering for disse to landene på grunnlag av de indiske tallene er tvilsom på grunn av de veldig forskjellige forholdene der.
Omstendighetene rundt utbruddet er uklare. De første beskjedene vedrørte soldater som var forberedt på tjeneste i første verdenskrig i treningsleirer i USA i mars 1918 . Fra USA, Japan, Filippinene, Canada og Mexico ble smittet; Amerikanske soldater brakte sykdommen til vestfronten i Frankrike, hvorfra den spredte seg til Spania og Sør-Amerika, resten av Europa, Afrika og Asia. Fordi internasjonale pressebyråer først rapporterte om sykdommen fra Spania, ble opprinnelsen feilaktig tilskrevet dette landet.
Vannfugler er det opprinnelige reservoaret av influensavirus. Jeffery Taubenberger , som senere rekonstruerte årsaken til den spanske influensa, sier at kort før 1918 gikk et komplett influensavirus over fra fugler til mennesker. Andre forskere motsier ham og mistenker en rekombinasjon (engelsk: reassortment ) med gensegmenter fra svineinfluensavirus. På tidspunktet for den spanske influensa var det også rapporter om sykdom blant griser i Harbin , Kina og Iowa i USA, men i det minste ser sekvensen ut som om de hadde blitt smittet av mennesker. Genetiske studier på hemagglutiningenet antyder også denne prosessen.
Det er kontroversielt om H1N1-viruset i 1918 faktisk sirkulerte blant mennesker for første gang. Man kan også tolke den relative beskyttelsen til over 45-åringene i den spanske influensa på en slik måte at de allerede ble utsatt for H1N1-virus i perioden før 1873 og derfor var immun.
Med den tredje bølgen vinteren 1918/19 sluttet den spanske influensa seg til den vanlige influensasesongen på de tempererte breddegradene. Men den fjerde bølgen vinteren 1919/20 viste den karakteristiske økte dødeligheten blant unge voksne, om enn i mindre grad. Som et resultat av sykdommen etablerte stabile linjer av H1N1-virus seg blant mennesker og griser. Man kan anta at influensavirus av undertypen H1N1 har sirkulert i menneskeheten siden 1918 på grunn av virusisolater fra det året. Alvorlig influensaepidemier , som rammet minst Europa og Nord-Amerika, likevel skjedde i 1928-1929, 1932-1933, 1936-1937 og 1943-1944.
Oppdagelsen av viruset

Patogenet var fortsatt ukjent under den spanske influensa. Noen forskere hadde allerede mistenkt et "filtrerbart virus" (hvor "virus" i utgangspunktet betydde "patogen" eller til og med "gift"). I lærebøkene ble imidlertid bakterien , som nå kalles Haemophilus influenzae , ansett å være årsaken til influensa. Med de vanlige metodene for bakteriologi kunne imidlertid ingen patogen oppdages: den kunne verken farges eller dyrkes på kunstige kulturmedier. Hvis det har skjedd et fremskritt i kunnskap gjennom den spanske influensa, er det i den grad den faktiske patogenen til denne influensavarianten fremdeles var ukjent på den tiden, dvs. Haemophilus influenzae ble eliminert som et patogen.
Klassisk svineinfluensa har lenge vært begrenset til det nordlige og midtvestlige USA, hvor årlige vinterutbrudd skjedde etter 1918. I 1930 isolerte Richard Shope et influensavirus fra griser for første gang ved Rockefeller Institute i Princeton. To år senere lyktes de britiske forskerne Wilson Smith , Christopher Andrewes og Patrick Laidlaw å hente ut influensavirus fra mennesker. Den eneste måten å holde viruset i kultur var å infisere ildere med halspinner fra mennesker og deretter overføre infeksjonen fra ilder til ilder før det infiserte dyret ble immun. Senere byttet de til mus.
Utviklingen av en vaksine
I 1935 viste Wilson Smith at viruset reproduserte seg godt i befruktede kyllingegg , en teknikk som hadde blitt brukt med andre virus siden 1932. Dette betydde at forskning ikke lenger bare var avhengig av forsøksdyr. Joseph Stokes fra University of Pennsylvania startet de første dyreforsøkene med influensavaksiner mellom 1936 og 1938 . Resultatene var uklare. Antibiotika utviklet på 1940-tallet forhindret forstyrrende vekst av bakterier i de inokulerte kyllingeggene. I tillegg er det utarbeidet ulike teknikker for å berike virusene.
Under andre verdenskrig , en vaksine som ser moderne ble utviklet for United States Department of Defense . Den inneholdt tre forskjellige virusstammer, ble konsentrert og inaktivert med formalin . Følgende vaksintest var også nyskapende: Forsøkspersonene som skulle vaksineres ble valgt tilfeldig ( randomisert ), kontrollgruppen fikk placebo , og studien var dobbeltblind . I influensabølgen 1943 ga vaksinen gode resultater, og innen 1945 ble alle amerikanske soldater vaksinert. I en større influensa B- virusepidemi tidligere i år, ble vaksinen også vist å være svært effektiv. I 1945 fikk også forskjellige produsenter i USA lisens til å produsere influensavaksiner for sivile.
Flere utbrudd
1947 og 1951-epidemiene
I 1947 var det en rekombinasjon av gensegmenter i undertypen H1N1, noe som førte til en fullstendig svikt i vaksinen. Spesielt skilte hemagglutinin seg i mange aminosyrer fra forgjengeren (referansestamme: A / Fort Monmouth (FM) / 1/1947, da mest kalt FM-1-viruset). Selv om viruset spredte seg over hele verden, var dødeligheten relativt lav. På lang sikt førte denne hendelsen til erkjennelsen av at det ville være umulig å produsere en influensavaksine som ville beskytte på lang sikt. Vaksinasjonen må tilpasses de sirkulerende influensastammene hvert år , først og fremst på grunn av den gradvise endringen i genene gjennom punktmutasjoner ( genetisk drift ). Verdens helseorganisasjon , grunnlagt i 1948, opprettet et overvåkingssystem for dette.
En annen stor epidemi skjedde i 1950-51, med dødelighet i Storbritannia og Canada som til og med overgikk pandemiene 1957 og 1968. I 1957 forsvant H1N1-viruset fra menneskeheten og ble erstattet av det asiatiske influensaviruset H2N2 . Fra dette er det konkludert med at H1- og H2-virus ikke kan eksistere sammen i en populasjon.
Klassisk svineinfluensa sprer seg
Klassisk svineinfluensa må også ha spredt seg over hele verden under eller etter andre verdenskrig . Den ble funnet i Canada og Brasil, hele Asia, Kenya, Storbritannia, Tsjekkoslovakia og i 1959 også i Forbundsrepublikken Tyskland. Den forsvant deretter fra Europa og dukket ikke opp igjen i 1976 i et utbrudd i Nord-Italia. Virusene som ble isolert der viste seg å være nært beslektet med nordamerikanske stammer, slik at sykdommen sannsynligvis ble importert fra USA. Det forble begrenset til Nord-Italia til 1979 og spredte seg deretter over Vest-Europa, Skandinavia og Storbritannia. Også i USA og Asia forble klassisk svineinfluensa den dominerende formen for influensa hos griser frem til 1990-tallet.
H1N1-virusene som sirkulerer blant mennesker kan sporadisk også infisere griser, som dokumentert i Budapest i 1941, men etablerer seg ikke blant griser. Unntaket er spansk influensapatogen, som førte til klassisk svineinfluensa.
Hos mennesker er H1N1-virus gjenstand for konstant endring , forårsaket av punktmutasjoner og fremmet av seleksjonstrykket i immunsystemet. Viruset av klassisk svineinfluensa har derimot holdt seg genetisk stabilt i flere tiår. Mutasjonene er ikke uvanlige, men utvalget fungerer alltid uforstyrret i retning av optimal tilpasning til verten, siden unge svin, ennå ikke immungriser, stadig blir introdusert i flokken. En forsker observerte at influensavirus sirkulerte i en griseflokk i et helt år.
"Svineinfluensaen" fra 1976

I motsetning til svineinfluensa refererer "svineinfluensa" til en sykdom hos mennesker. I 1976 var det et lokalt utbrudd av variant A / New Jersey / 1/1976 blant amerikanske soldater i Fort Dix , New Jersey .
De amerikanske helsemyndighetene vurderte risikoen for tilbakefall av en sykdom på størrelse med den spanske influensa som så stor at de lanserte et vaksineproduksjonsprogram for å beskytte alle borgere i USA. De første vaksinasjonene fant sted 1. oktober 1976, og i midten av desember hadde 40 millioner amerikanere blitt vaksinert - den største vaksinasjonskampanjen i historien da. I Europa var bare Nederland med på vaksinasjonsprogrammet. Samtidig ble det kjent at noen som hadde blitt vaksinert hadde utviklet Guillain-Barré syndrom ; den dag i dag er det fortsatt kontroversielt om dette faktisk er en bivirkning av vaksinasjonen. Det var en mengde erstatningskrav for en sum på 3,5 milliarder amerikanske dollar.
Det er sannsynlig at griser var kilden til influensavirus i Fort Dix, men dette har aldri blitt bevist.
1977 russisk influensa
I mai 1977 skjedde et H1N1-virusutbrudd i Tianjin , Kina, etter at undertypen hadde forsvunnet i tjue år. I november hadde epidemien spredt seg til Sovjetunionen - hvorfra den fikk navnet sitt - og til Hong Kong. Det russiske influensaviruset ble funnet å være nesten identisk med virusene som sirkulerte før 1957, spesielt A / Roma / 1949, så det er allment antatt at det ved et uhell ble løslatt fra et laboratorium. Imidlertid forblir influensavirus genetisk stabil hos fugler, slik at det russiske influensaviruset kunne ha overlevd i dette reservoaret også mellom 1957 og 1977.
H1N1-virus har sirkulert i menneskeheten siden 1977, sammen med H3N2-virusene fra Hong Kong influensa fra 1968. H1- og H3-virus kan derfor eksistere sammen med hverandre. Dødeligheten i en influenssesong der H1N1 dominerer er ganske lav. I tillegg faller den langsiktige trenden i influensarelatert dødelighet i Tyskland.
H1N1-virus hos mennesker endres bare sakte på grunn av genetisk drift, noe som vises av det faktum at sammensetningen av vaksinen bare sjelden trenger å endres. En av de tre undertypene i vaksinen er tradisjonelt reservert for en H1N1-stamme, med A / Brisbane / 59/2007 planlagt for sesongen 2009/2010 på den nordlige halvkule.
2009 H1N1-pandemi
Våren 2009 spredte en ny undertype " A / California / 7/2009 (H1N1) " av H1N1-viruset seg opprinnelig i Nord-Amerika og forårsaket kort tid senere en pandemi . Ifølge en studie publisert i 2016, oppstod pandemivarianten av viruset (pdmH1N1) hos griser i Mexico.
Viruset i seg selv, men også vaksinasjonen, kan i sjeldne tilfeller føre til narkolepsi . I følge EudraVigilance- databasen til det europeiske legemiddelkontoret var det kjent over 1300 tilfeller av vaksinerte mennesker mellom 2010 og januar 2015 , inkludert noen fra Tyskland. Per 28. november 2016 ble 86 personer i Tyskland som hadde blitt vaksinert med Pandemrix rapportert til Paul Ehrlich Institute som "mistenkte narkolepsisaker". I Sverige ble det vedtatt en lov om erstatning til ofre i 2016.
En generell nomenklatur for influensavirus
For å uttrykke kunnskapen om at influensavirus kan overføres over artsgrenser, implementerte Verdens helseorganisasjon en nomenklatur fra 1980 basert på de to viktigste overflateantigenene hemagglutinin (= H) og neuraminidase (= N). Værtypen tas ikke lenger i betraktning.
Rekonstruksjon av det forårsakende middel til spansk influensa
En arbeidsgruppe ledet av Jeffery Taubenberger , da ved Armed Forces Institute of Pathology i Washington, DC, begynte å sekvensere genomet til den spanske influensa patogenet ved hjelp av vevsprøver fra tre forskjellige kilder . Dette gjorde det mulig for dem å bekrefte at det faktisk var et H1N1-virus. Fra den genetiske sekvensen var det også mulig å rekonstruere et virus som har blitt eksperimentert med siden den gang. Det har vist seg å være dødelig for mus, ildere og makaker, mens det bare forårsaker mild sykdom hos griser.
I dyreforsøk på makaker utløste det rekonstruerte patogenet en overreaksjon i den medfødte grenen av immunsystemet, som reagerer på virusinfeksjoner. Kroppen din produserte så mange cytokiner og cellegifter ("cytokin storm") at reguleringen av immunsystemet kollapset. Den samme sekvensen er sannsynlig for de menneskelige ofrene for den spanske influensa og vil forklare hvorfor spesielt unge voksne med godt utviklet immunforsvar døde.
Influensa A-virus 1918 (H1N1) ble tildelt risikogruppe 3 i 2006 , mens det tidligere var klassifisert i risikogruppe 2. Arbeid med det kan derfor bare utføres under strenge sikkerhetsforholdsregler for beskyttelsesnivå 3 . Oppdraget gjelder bare spansk influensavirus, influensa A-viruset H1N1 avledet derfra, slik som det klassiske svineinfluensavirus H1N1, det eurasiske svineinfluensavirus H1N1 eller H1N1-viruset involvert i 2009/10 pandemien, beholdes av Biological Agentforordning i forbindelse med TRBA ( tekniske regler for biologiske agenser) 466 tildelt risikogruppe 2.
H1N1-virus som er direkte avledet fra patogener hos fugler
Alle H1N1-virusene som hittil er diskutert, danner et fellesskap av avstamning som går tilbake til den spanske influensapatogenen. Siden 1979 har imidlertid H1N1-virus, som har blitt overført direkte fra fugler (engelsk: aviærlignende svineinfluensa ), dominert europeiske griser . Det har vist seg at de er nært beslektet med and-H1N1-virus. Siden alle gensegmenter er fra fugler, ser det ut til at et komplett virus har blitt overført. I Europa har disse virusene, som stammer fra fugleriket, fortrengt klassisk svineinfluensa i løpet av få år. Uavhengig av dette ser det ut til at denne prosessen har funnet sted for andre gang i Sørøst-Asia i 1993; der sirkulerer virusene som stammer fra fugler fremdeles sammen med den klassiske svineinfluensa. De opprinnelige fuglevirusene fra Europa og Sørøst-Asia har vist seg å være i slekt med hverandre.
Overføring av influensavirus fra griser til fugler
H1N1-overføring av influensavirus fra griser til kalkun er rapportert i Nord-Amerika. Flere syke kalkuner umiddelbart etter utbrudd av influensa hos griser, og genetiske studier har vist en kraftig utveksling av influensa A-virus mellom de to artene. I ett tilfelle ble et menneske også smittet av et svineinfluensavirus gjennom en kalkun. I Europa har H1N1 svineinfluensavirus, opprinnelig avledet fra ender, også smittet kalkuner. Så det er en mulighet for at griser, mennesker, kalkuner og ender vil smitte hverandre igjen og igjen.
H1N1-virus som rekombinanter fra forskjellige kilder
Grisen som et potensielt "blandekar"
Griser er den eneste pattedyrarten som holdes i stort antall der både fugleinfluensavirus og menneskelig influensavirus kan reprodusere. Dette er fordi luftrøret fra griser er foret med celler som bærer to typer sialinsyre , som kan brukes som forankringspunkt for mennesker og fugleinfluensavirus. Siden genomet til influensa A-viruset er fordelt på åtte segmenter, kan disse segmentene revurdere seg selv i tilfelle en dobbel infeksjon med forskjellige virus . Griser danner et potensielt "blandekar" ( blandekar ) for forskjellige varianter av virus og dermed en potensiell kobling mellom fugler og mennesker.
Overføring av svineinfluensavirus fra griser til mennesker
Rollen griser spilte i utviklingen av den spanske influensa er kontroversiell. Siden 1970-tallet har mer enn 50 menneskelige infeksjoner med klassisk svineinfluensa blitt dokumentert i den vitenskapelige litteraturen. Det er kjent fra studier på serum fra yrkeseksponerte mennesker at det kan forventes et mye større antall.
Trippel kombinanter
Fram til 1990-tallet var det klassiske svineinfluensaviruset det vanligste influensaviruset blant nordamerikanske griser. På slutten av 1990-tallet ble den erstattet av forskjellige stammer og undertyper (H1N1, H3N2 og H1N2) som inneholdt gensegmenter fra tre forskjellige kilder (engelsk: triple-reassortant svin influensa ). Grunnlaget var vanligvis H1 svineinfluensavirus av nordamerikansk opprinnelse med ytterligere gensegmenter fra influensavirus fra fugler og mennesker.
I desember 2005 ble infeksjon av et menneske ved en slik trippelkombinasjon observert for første gang i Wisconsin . I juni 2007 erklærte USA at slike infeksjoner var meldepliktig. I februar 2009 var det totalt kjent elleve tilfeller fra Midtvesten og det sørlige USA (ti av dem H1N1, en H1N2). Ni av de berørte hadde vært i nærheten av griser. Pasientene var veldig unge, medianalderen var 10 år.
En trippel kombinasjon med “pandemisk potensial” ble oppdaget mellom 2011 og 2018 og siden 2016 hovedsakelig i svinepopulasjoner i Folkerepublikken Kina. Genene til H1N1-varianten kjent som "G4 EA H1N1" kommer dels fra en linje kjent fra europeiske og asiatiske fugler, dels fra pandemien H1N1-viruset fra 2009 ("svineinfluensa") og dels fra en linje kjent fra Nord-Amerika, som i sin tur kommer fra består av flere opprinnelser. I følge en studie publisert i juni 2020 i spesialtidsskriftet PNAS , er mer enn 10 prosent av svinebønder (35 av 338 personer som er undersøkt) allerede smittet. Det ble også påpekt at infeksjon med sesonginfluensa ikke beskytter mot “G4 EA H1N1”.
Firemanns kombinanter
Den første og hittil eneste firedoble kombinasjonen ble oppdaget i 2009. Selv om den allerede var tilpasset mennesker, se pandemisk influensa 2009 , ble den ofte referert til som "svineinfluensa" fordi den stammer fra svineinfluensavirus og sannsynligvis hos griser.
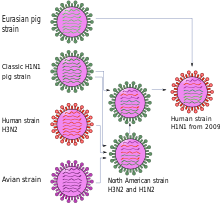
Den første vitenskapelige publikasjonen beskriver den nye virusvarianten som en genetisk ny kombinasjon av to viruslinjer av svineinfluensa , en nordamerikansk og en eurasisk. Tre av de åtte gensegmentene - NP, NS og en som koder for H1-hemagglutinin - går tilbake til det klassiske svineinfluensaviruset fra 1918. To gensegmenter - PB2 og PA - gikk fra fugler til nordamerikanske griser rundt 1998 og PB1 fra fugler til mennesker rundt 1968 og derfra til griser rundt 1998. Denne kombinasjonen av seks gensegmenter finnes i trippelkombinanter som er vanlige i Nord-Amerika. I kontrast er de to andre gensegmentene som koder for en N1-neuraminidase og matriksproteinene M1 og M2 , avledet fra varianten som opprinnelig var fordelt på fugler , som har blitt distribuert blant eurasiske griser siden 1977, men som aldri ble oppdaget i Amerika. Genet for matriksproteinet inneholder en mutasjon som gjør viruset resistent mot influensemedisinene amantadin og rimantadin .
I Canada har griser igjen blitt smittet av den nye varianten av mennesker. Symptomene ligner på klassisk svineinfluensa. Ved et utbrudd i Argentina er det foreløpig ikke klart om det er klassisk svineinfluensa eller den nye H1N1-varianten.
Se også
litteratur
- Rapport om influensapandemien, 1918-1919 . Helsedepartementet (red.). I: Rapporter om folkehelse og medisinske emner . Bind 4, His Majesty's Stationery Office, London 1920 (beste samtidige undersøkelse av den spanske influensa)
- Ian H. Brown: Epidemiologien og utviklingen av influensavirus hos griser . I: Veterinær mikrobiologi . Volum 74, nr. 1–2, 2000, s. 29–46, PMID 10799776 (gjennomgangsartikkel om svineinfluensa)
weblenker
- Virus barberhøvelører i mikrokosmos. Planet Wissen - kringkastet 14. januar 2011
Individuelle bevis
- ↑ ICTV Master Species List 2018b.v2 . MSL # 34, mars 2019
- ↑ a b ICTV: ICTV taksonomihistorie: Akabane orthobunyavirus , EC 51, Berlin, Tyskland, juli 2019; Ratifisering av e-post mars 2020 (MSL # 35)
- ↑ Negative Sense RNA-virus: Orthomyxoviridae , i: ICTV 9. rapport (2011)
- ↑ Edwin O. Jordan: Epidemisk influensa. En undersøkelse . American Medical Association, Chicago 1927, s. 229.
- ^ ID Mills: Influensapandemin fra 1918-1919. Den indiske opplevelsen . I: The Indian Economic and Social History Review . Volum 23, nr. 1, 1986, s. 1-40.
- ↑ Jeffery K. Taubenberger et al. : Karakterisering av influensaviruspolymerasegener fra 1918 . I: Nature , bind 437, 2005, s. 889-893.
- ^ Mark J. Gibbs og Adrian J. Gibbs: Var pandemien i 1918 forårsaket av en fugleinfluensa? samt Janis Antonovics , Michael E. Hood og Christi Howell Baker: Var influensaen fra 1918 aviær? begge i: Natur . Volum 440, 2006, s. E8f.
- ^ JWH Chun: influensa inkludert infeksjonen blant griser . I: The National Medical Journal of China . Volum 5, nr. 1, 1919, s. 34-44.
- ^ JS Koen: En praktisk metode for feltdiagnose av svinesykdommer . I: American Journal of Veterinary Medicine . Volum 14, 1919, s. 468-470.
- ↑ http://www.pandemicinfluenza.org/about.html ( Memento fra 30. januar 2010 i Internet Archive ) Katzelab
- W Selwyn D. Collins: Influensaepidemien fra 1928-1929 med komparative data for 1918-1919 . I: American Journal of Public Health and the Nations Health . teip 20 , nei. 2 , februar 1930, ISSN 0002-9572 , s. 119–129 , doi : 10.2105 / AJPH.20.2.119 , PMID 18012936 , PMC 1555806 (fri fulltekst) - ( aphapublications.org [åpnet 18. februar 2021]).
- ↑ E. Eckardt, H. Flohn og HJ Jusatz: Spredning og forløp av influensaepidemien 1933 avhengig av meteorologiske og geografiske faktorer. I: Journal of Hygiene and Infectious Diseases. Volum 118, 1936, s. 64-91, doi: 10.1007 / BF02177495 .
- ↑ Richard E. Shope: Svineinfluensa. III. Filtreringseksperimenter og etiologi . I: Journal of Experimental Medicine . Volum 54, 1931, s. 373-385.
- ^ Wilson Smith, CH Andrewes og PP Laidlaw: Et virus hentet fra influensapasienter . I: The Lancet . Volum 222, 1933, s. 66-68.
- ^ WIB Beveridge: influensa. Den siste store pesten . Heinemann, London 1977, s.9.
- ↑ John M. Eyler: De Kruif's Boast: Vaccine Trials and the Construction of a Virus . I: Bulletin of the History of Medicine . Volum 80, nr. 3, 2006, s. 409-438.
- ↑ Martha I. Nelson et al. : Flere omorganiseringshendelser i evolusjonshistorien til H1N1 influensa A-virus siden 1918 . I: PLoS Pathogens . Bind 4, nr. 2, 2008.
- ↑ Miklós Dreguss: Om infeksjon av griser med humant influensavirus . I: Archives of Virology . Volum 3, nr. 1-4, 1944, s. 35-48.
- ↑ JC Gaydos et al. : Svineinfluensa A-utbrudd, Fort Dix, New Jersey, 1976. I: Emerging Infectious Diseases . Bind 12, 2006, s. 23-28; Fulltekst (på engelsk)
- ↑ Gina Kolata: influensa. Jakten på viruset. S. Fischer, Frankfurt 2001, s. 153-213
- ↑ Martha I. Nelson et al. : Flere omorganiseringshendelser i den evolusjonære historien til H1N1 influensa A-virus siden 1918 . I: PLoS Pathogens . Vol. 4, nr. 2, 29. februar 2008, e1000012, doi: 10.1371 / journal.ppat.1000012 .
- ↑ Alan P. Kendal et al. : Antigenic Likhet av influensa A (H1N1) Virus fra epidemier i 1977–1978 til “skandinaviske” stammer isolert i epidemier fra 1950–1951 . I: Virologi . Volum 89, 1978, s. 632-636.
- ↑ Influensaassosiert dødelighet i Tyskland 1985–2006 . I: Epidemiologisk bulletin . Nr. 35, 2007, s. 325-327.
- ↑ Ignacio Mena et al. : Opprinnelsen til H1N1-influensapandemien i 2009 hos svin i Mexico. I: eLife. Online publikasjon fra 28. juni 2016, doi: 10.7554 / eLife.16777
-
↑ Syed Sohail Ahmed et al.: Antistoffer mot influensanukleoprotein kryssreagerer med human hypokretinreseptor 2. I: Science Translational Medicine. Volum 7, nr. 294, 2015, s. 294ra105, doi: 10.1126 / scitranslmed.aab2354
Hvordan H1N1 kan utløse søvnløshet . Zeit Online , 1. juli 2015 - Influensavaksine : Hvordan Pandemrix forårsaker narkolepsi. På: aerzteblatt.de 2. juli 2015
- ↑ Gjeldende informasjon om narkolepsi i forhold til A / H1N1 influensavaksinasjon. På: pei.de fra 28. november 2016
- ↑ Skade etter svineinfluensavaksinasjon: Sverige kompenserer narkolepsipasienter . Spiegel Online , 13. mai 2016
- ↑ Darwyn Kobasa: Avvikende medfødt immunrespons ved dødelig infeksjon av makaker med influensavirus fra 1918 . I: Natur . Volum 445, 2007, s. 319-323.
- ↑ TRBA (tekniske regler for biologiske stoffer) 462: Klassifisering av virus i risikogrupper. På: Nettsted for Federal Institute for Occupational Safety and Health (BAuA) . 25. april 2012, åpnet 13. mai 2014 .
- ^ Hermann Müller: Den klassiske aviær influensa ("høypatogen aviær influensa"; "fugleinfluensa") - bakgrunnsinformasjon om den nåværende epidemien i Sørøst-Asia og referanser til informasjon på Internett. (PDF) Direktør for Institutt for virologi, Fakultet for veterinærmedisin, Universitetet i Leipzig, status: 2004
- ↑ Vivek Shinde et al. : Triple-Reassortant Swine Influenza A (H1) in Humans in the United States, 2005-2009. I: The New England Journal of Medicine . Volum 360, nr. 25, 2009, s. 2616-2625, doi: 10.1056 / NEJMoa0903812 .
- ↑ Ny type svineinfluensa med pandemi. På: science.orf.at fra 30. juni 2020.
- Lei Honglei Sun et al.: Prevalent Eurasian avian-like H1N1 svine influenza virus with 2009 pandemic viral genes facilitating human infection. I: PNAS. Online forhåndspublikasjon 29. juni 2020, doi: 10.1073 / pnas.1921186117 .
- ↑ Svineinfluensa-stamme med menneskelig pandemi potensial som i økende grad finnes hos griser i Kina. På: sciencemag.org fra 29. juni 2020.
- ^ RJ Garten, CT Davis et al. : Antigene og genetiske kjennetegn ved svineopprinnelse 2009 A (H1N1) influensavirus som sirkulerer hos mennesker. I: Vitenskap . 10. juli 2009, bind 325, nr. 5937, s. 197-201, doi: 10.1126 / science.1176225 .
- ↑ Saksrapport om det kanadiske utbruddet på nettstedet World Organization for Animal Health OIE
- Saksrapport om det argentinske utbruddet på nettstedet World Organization for Animal Health OIE