Förster resonans energioverføring
Den Förster resonans energioverføring ( FRET for kort ), noen ganger også (feilaktig) kalt fluorescens-resonans-energioverføring , er en fysisk prosess i energioverføringen oppkalt etter Theodor Förster . Som en del av Förster-resonansenergioverføringen overføres energien til et opphisset fargestoff , også kalt donor, til et andre fargestoff, også kalt akseptor. Energien er strålingsfri og byttes derfor ikke ut via frigjøring ( utslipp ) og absorpsjon ( absorpsjon ) av lyspartikler ( fotoner ). For eksempel er lyssamlingskomplekset av organismer som er engasjert i fotosyntese basert på Förster resonans energioverføring . I biokjemi og cellebiologi brukes Förster-resonansenergioverføringen spesielt ved bruk av fluorescerende fargestoffer som en "optisk nanometerskala", siden intensiteten blant annet avhenger av avstanden mellom giver og akseptor og kan observeres i området opp til 10 nm.
historie
Historien om oppdagelsen og forskningen av Förster resonans energioverføring kan spores langt tilbake fra Theodor Försters essay "Intermolecular Energy Migration and Fluorescence", som ble publisert i 1948 i Annalen der Physik . Hans Christian Ørsted , Michael Faraday , James Clerk Maxwell og Heinrich Hertz ga viktig grunnleggende kunnskap for den senere vitenskapelige beskrivelsen av dette fenomenet allerede på begynnelsen av 1800-tallet .
Det første eksperimentelle beviset på energioverføring mellom to molekyler kom fra G. Cario og James Franck i 1922 . I en kvikksølv - talliumdampblanding observerte de et karakteristisk lysutslipp fra tallium, som de kalte "sensibilisert fluorescens", etter eksitering med lys med en bølgelengde som er spesifikk for eksitering av kvikksølv. De første forsøk på å forklare dette energioverføring av Jean-Baptiste Perrin og Francis Perrin er basert på en såkalt nær - felt - dipol-dipol mekanisme . Hartmut Kallman og Fritz London fant en kvantemekanisk forklaring på denne strålingsfrie energioverføringen. Disse funnene ble innlemmet i Francis Perrins forsøk på å kvantitativt beskrive denne energioverføringen. Imidlertid var det basert på misforståelsen om at energioverføringen avtar med den tredje og ikke den sjette kraften til avstanden mellom de to molekylene.
I 1946, kort tid etter andre verdenskrig, deltok Theodor Förster i diskusjonen om den kvantitative beskrivelsen av strålingsfri energioverføring. Men det var ikke før hans essay "Intermolecular Energy Migration and Fluorescence" fra 1948 at den fikk bred respons innen vitenskap.
fysikk

Förster-resonansenergioverføringen kan observeres mellom to fargestoffer som er tilstede som molekyler, komplekser eller nanopartikler . Energien til et opphisset donorfargestoff blir ikke avgitt i form av et foton , men overføres til et akseptorfargestoff uten stråling via dipol-dipolinteraksjoner . Mens Coulombs lov gjelder monopol, er den elektriske dipol-dipol-interaksjonen ansvarlig for energioverføringen, og det er derfor overføringen også avhenger av den sjette kraften i avstanden. Beskrivelser av Förster resonans energioverføring ved hjelp av klassisk fysikk eller kvantemekanikk fører til sammenlignbare resultater. Følgelig induserer den eksiterte giveren D * en oscillasjon i akseptoren A. Et annet kjennetegn ved Förster-resonansenergioverføringen er at den kvantemekaniske egenskapen til donor- og akseptorfargestoffet spinner . Derfor skjer Förster-resonansenergioverføringen vanligvis som en såkalt singlet - singlet transfer:
I motsetning til dette forekommer energioverføringer, som bare finner sted mens du opprettholder den totale sentrifugeringen av giver- og akseptorfargestoffet, som en Dexter-energioverføring basert på en utveksling av elektroner i området mindre enn 2 nm.
Energien overført til akseptorfargestoffet kan avgis igjen av sistnevnte, for eksempel i form av stråling . I motsetning er den overførte energien ikke lenger tilgjengelig for donorfargestoffet for direkte utslipp av stråling. Oppholdstiden til donorfargestoffet i den glade tilstanden avtar også. Makroskopisk uttrykker en Förster resonans energioverføring seg på grunnlag av reduksjonen i strålingsintensiteten og fluorescenslevetiden til donorfargestoffene, og i tilfelle akseptorfargestoffer som er i stand til å stråle, på grunnlag av en økning i strålingsintensiteten til akseptorfargestoffene.
Donor og akseptor er for det meste fluorescerende fargestoffer, og derfor brukes begrepet fluorescensresonans energioverføring ofte som et synonym. Imidlertid er fluorescens ikke et viktig krav og er ikke involvert i energioverføring. En overføring av Förster-resonansenergi kan også observeres mellom givere som er i stand til andre former for stråling, som fosforescens , bioluminescens eller kjemiluminescens , og passende akseptorfargestoffer. Akseptorfargestoffer kan til og med være ikke-emissive og kan føre til fluorescensslukking (mørk slukker) .
FRET effektivitet
Effektiviteten til Förster resonans energioverføring , som kan anta verdier mellom 0 og 1, er forholdet mellom antall energioverføringer og antall donor eksitasjoner. Det gjenspeiles også i Förster-resonansens energioverføringshastighet i forhold til summen av hastighetene for strålingsutslipp fra donorfargestoffet , energioverføring og former for strålingsfri nedbrytning :
For å muliggjøre den mest effektive strålingsfrie energioverføringen fra donorfargestoffet til akseptorfargestoffet via Förster-resonansenergioverføringen, må tre viktige kriterier være oppfylt:
- Avstand: Donorfargestoff og acceptorfargestoff bør bare være noen få nanometer fra hverandre.
- Spektrum: Stråleutslippsspekteret til donorfargestoffet må overlappe med absorpsjonsspekteret til akseptorfargestoffet.
- Orientering: Donor- og akseptorfargestoffer skal ha elektroniske svingningsplan som er så parallelle som mulig.
avstand
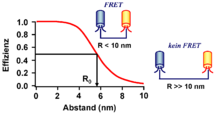
Omfanget av Förster energioverføring, representert som overføringshastighet , avhenger av stråleutslippshastigheten til donorfargestoffet eller dets oppholdstid i den eksiterte tilstanden ( fluorescenslevetid ) og spesielt på avstanden mellom donor- og acceptorfargestoff . I tilfelle av en Förster resonans energioverføring, er dette vanligvis i området fra 0,5 til 10 nm, hvor effektiviteten av energioverføringen synker med den sjette effekten av avstanden mellom de to fargestoffene.
Overføringshastigheten bestemmes også av Förster-radiusen til donor-akseptorfargeparet. tilsvarer avstanden mellom de to fargestoffene der 50% av energien overføres:
På denne måten skiller Förster-resonansenergioverføringen seg fra en energioverføring som er basert på rent utslipp og absorpsjon av stråling, og som avtar med kvadratet av avstanden mellom giver og mottaker. Det skiller seg også fra Dexter-elektronoverføringen , som kan observeres spesielt på svært små avstander (<0,5 nm) , som er basert på en overlapping av elektronorbitalene og avtar eksponentielt med avstanden.
Kriteriet for den lille avstanden mellom giver og akseptor betyr at Förster resonans energioverføring ofte brukes som et "optisk nanometer mål". Bruken gjør det mulig å måle avstanden mellom en giver og dens akseptor i nærområdet, langt under oppløsningen til konvensjonelle optiske metoder, for eksempel mikroskopi . Derfor har bruken av Förster resonans energioverføring etablert seg som en verdifull metode, spesielt innen biokjemi og cellebiologi.
Spectra
En forutsetning for energioverføring er at akseptorfargestoffet er i stand til å absorbere energi. For dette formålet må mengden energi som skal overføres, som tilsvarer energiforskjellen mellom den eksiterte tilstanden og jordtilstanden, være i området for mulig energiabsorpsjon av akseptorfargestoffet. Dette er tilfelle når emisjonsspekteret til donorfargestoffet overlapper absorpsjonsspekteret til akseptorfargestoffet. Størrelsen på det overlappende området til spektrene til donor- og akseptorfargestoff, representert som integralet , er proporsjonalt med overføringshastigheten og den sjette kraften i Förster-radiusen :
- ,
hvor er den normaliserte strålingsintensitet fra donor fargestoff på bølgelengde og den ekstinksjonskoeffisient på akseptoren fargestoff.
orientering
For en optimal energioverføring, bør donor- og akseptorfargestoffer ha elektroniske svingningsplan som er så parallelle som mulig. Overføringshastigheten og den sjette effekten til Förster-radiusen til donor-akseptorparet er proporsjonal med orienteringsfaktoren :
- ,
der vinkelen mellom emisjonsdipolen til donorfargestoffet og absorpsjonsdipolen til akseptorfargestoffet og og vinklene mellom de to dipolene og forbindelsesvektoren mellom donor- og acceptorfargestoffet. kan anta verdier mellom 0 og 4, hvorved verdien 0 oppnås med vinkelrett ( ortogonalitet ) av dipolene og verdien 1 med parallell og verdien 4 med kollinære ordnede dipoler. For fargestoffer som beveger seg fritt, for eksempel når man undersøker prosesser i løsning, er . Hvis derimot donor- og akseptorfargestoffer er faste (f.eks. På samme protein eller i membraner), kan denne verdien avvike, og Förster-resonansenergioverføringen kan gi informasjon om endringen i vibrasjonsnivåene og dermed posisjonen til begge fargestoffene i forhold til hverandre.
Mål
Siden Förster-resonansenergioverføringen er en strålingsfri energioverføring, kan den ikke oppdages og kvantifiseres direkte. Imidlertid kan konsekvensene av en energioverføring, reduksjonen i strålingsintensitet og fluorescenslevetiden til donorfargestoffet, og i tilfelle av akseptorfargestoffer som er i stand til å avgi stråling, akseptoremisjonen kan oppdages ved hjelp av egnede instrumentelle metoder. Fluorescensmikroskoper eller fluorimetre er for eksempel egnet for dette formålet . For å bevise en energioverføring basert på Förster-mekanismen må det strengt tatt også være en omvendt proporsjonalitet mellom energioverføringshastigheten og den sjette kraften til avstanden mellom de to fargestoffene. I praksis sjekkes sjelden imidlertid typen energioverføring, særlig innen biokjemi.
Måling av strålingens utslipp fra giveren
Siden Förster-resonansenergioverføringen fører til en reduksjon i utstrålingen fra donorfargestoffet, er dens måling egnet for påvisning av en resonansenergioverføring. FRET-effektiviteten kvantifiseres ved å måle stråleintensiteten til donorfargestoffet i fravær og nærvær av akseptorfargestoffet :
Strålingsintensiteten kan ikke bare bestemmes i form av et kontrolleksperiment utført parallelt i fravær av akseptoren. kan også bestemmes i nærvær av akseptoren, forutsatt at det kan antas at avstanden mellom donor og acceptorfargestoff er av en størrelsesorden som er irrelevant for en Förster resonans energioverføring. Dette brukes for eksempel i biokjemi for proteiner som er merket med fargestoffer og som assosieres eller dissosieres som svar på en ekstern stimulans, for eksempel et signalstoff. En annen metode for å bestemme om akseptorfargestoffet er til stede til tross for tilstedeværelsen av acceptorfargestoffet, er å ødelegge det, for eksempel ved hjelp av fotobleking . Fotobleking av akseptorfargestoffet, som fører til en økning i stråleintensiteten til donorfargestoffet til en verdi uten resonansenergioverføring, brukes spesielt med immobiliserte prøver, for eksempel i fluorescensmikroskopi .
Måling av energioverføringen til akseptoren
En annen indikasjon på en resonansenergioverføring er økningen i strålingsintensiteten til akseptorfargestoffet, forutsatt at den er i stand til å avgi stråling. I praksis blir imidlertid emisjonsspekteret til akseptorfargestoffet ofte overlagret av eksitasjonsspektret og emisjonsspekteret til donorfargestoffet. I tillegg kan direkte eksitering av akseptorfargestoffet av en strålingskilde som brukes til å stimulere donorfargestoffet ofte ikke unngås. Imidlertid kan disse problemene minimeres gjennom et målrettet utvalg av donor- og akseptorfargestoffer.
Problemet med direkte eksitering av akseptorfargestoffet av en strålingskilde som brukes til å stimulere donorfargestoffet, elimineres når en kjemisk - eller bioluminescerende donor brukes. Spesielt bioluminescerende fargestoffgivere, slik som luciferase av Renilla reniformis og dets substrat coelenterazin , i kombinasjon med det grønne fluorescerende proteinet (GFP) eller dets derivater, finner avstandsbestemmelsen av proteiner ved hjelp av applikasjon for bioluminescensresonans .
En annen mulighet for å unngå en forfalskning av resultater gjennom direkte eksitasjon av akseptoren består i en kort eksitasjon av et donorfargestoff med lang fluorescenslevetid og en tidsforsinket måling av akseptorfluorescens. Langlivede lanthanoids slik som Tb 3+ , Dy 3+ , Eu 3+ eller Sm 3+ , i særdeleshet, er brukt som donorer for denne prosess, som også kalles tidsoppløst FRET . Disse gir også fordelen at deres utslippsspektre, som består av diskrete topper, nesten ikke overlapper det som akseptoren allophycocyanin har .
Kjemisk eller kromatografisk påvisning av fotolytiske reaksjonsprodukter fra akseptorfargestoffet kan også brukes til å beregne FRET-effektiviteten .
Måling av fluorescenslevetiden
Oppholdstiden til donorfargestoffet i den eksiterte tilstanden, som reduseres av Förster-resonansenergioverføringen, kan brukes ved å måle fluorescenslevetiden for påvisning av en energioverføring og for kvantifisering. For å beregne FRET-effektiviteten bestemmes fluorescenslevetiden til donorfargestoffet i fravær og nærvær av akseptorfargestoffet :
Fluorescensens levetid bestemmes vanligvis som en avbildningsmetode ved hjelp av fluorescens livstidsmikroskopi (FLIM). Selve målingen gjøres piksel for piksel. Fluorescensens levetid kan for eksempel bestemmes ved å måle fluorescensreduksjonen over tid ved hjelp av den tidskorrelerte enkeltfotontellingen etter en ultrakort, pulserende eksitasjon. Mye oftere blir imidlertid målingen av faseskiftet etter en intensitetsmodulert eksitasjon brukt til å bestemme fluorescenslevetiden ( fase fluorimetri ).
Forekomst og bruk
fotosyntese
Sammen med Dexter energioverføring er Förster resonans energioverføring ansvarlig for funksjonen til lyssamlingskomplekset i fotosyntese. Oppgaven til dette komplekset, som består av forskjellige membranproteiner , klorofyller , karotenoider og, i tilfelle av cyanobakterier og forskjellige alger, phycobilins , er den effektive samlingen av lysenergi og overføring til reaksjonssenteret i lysreaksjonen . En gradvis energioverføring fra karotenoider eller phycobilins via klorofyll b til klorofyll a i kjernen av lyshøstingskomplekset fører til en effektiv samling av energi fra lys med forskjellige bølgelengder med frigjøring og overføring av elektroner . Förster-resonansenergioverføringen utvider absorpsjonsspekteret til lysoppsamlingskomplekset til å omfatte bølgelengdeområder som klorofyll ikke selv kan bruke.
Bioluminescens

I naturen brukes Förster-resonansenergioverføringen i sammenheng med bioluminescens, generering av lys av levende vesener. Et eksempel på dette er Pacific manetarter Aequorea victoria . Deres lette organer inneholder fotoprotein- aequorin med bundet kofaktor coelenterazin . Dette gir et blått lys i isolert form og i nærvær av Ca 2+ . På den annen side inneholder lysorganene det grønne fluorescerende proteinet (GFP). Takket være en effektiv energioverføring fra aequorin til det grønne fluorescerende proteinet, lyser Aequorea victoria med en blågrønn farge.
Et annet eksempel på bruk av Förster resonans energioverføring i dyreriket er Bioluminescens av sjø fjær arten Renilla reniformis . Med den skjer energioverføringen fra en luciferase , Renilla luciferase (RLuc), til det grønne fluorescerende proteinet.
Begge er basert på Förster resonans energioverføring fluorescerende system av Aequorea victoria fra aequorin og grønt fluorescerende protein og det av Renilla reniformis fra Renilla eksperimentelt luciferase og grønt fluorescerende protein er i biokjemi for påvisning av protein-protein interaksjoner brukt .
Halvlederteknologi
Når du bruker organiske halvledere som det aktive materialet i organiske lysdioder (OLED), spiller Förster-resonansenergioverføringen en avgjørende rolle. Fordi spektrene for emisjon og absorpsjon ikke nødvendigvis er kongruente i bølgelengdeområdet, oppstår et 4-nivå system "av seg selv", slik det er nødvendig for lasere. Samtidig oppnås en gunstig utkoblingssituasjon, siden det utsendte lyset blir mindre sterkt resorbert.
Energioverføringen i organiske lysdioder, som for tiden utvikles som et mulig alternativ til flytende krystallskjerm , er basert på Förster-resonans-energioverføring, Dexter-energioverføring og direkte generering av eksitoner mellom en opphisset vert (giver) og en fosforescerende gjest ( Akseptor). For eksempel brukes karbazoler , polyfenylener og fluorener som vertsmaterialer, mens fosforescerende osmium , platina og spesielt iridiumkomplekser brukes som gjestefargestoffer .
biokjemi
I proteinbiokjemi og, basert på dette, i cellebiologi og farmakologi , brukes Förster resonans energioverføring analytisk for å bevise protein-protein interaksjoner og samspillet mellom proteiner med andre stoffer. I motsetning til de fleste andre metoder, som ko-immunutfelling , affinitetskromatografi , gjær-to-hybrid-systemet og bimolekylær fluorescenskomplementering , tillater måling av Förster-resonansenergioverføring observasjon av protein-protein-interaksjoner i sanntid med en tidsoppløsning i millisekundområdet.
Analyse av protein-protein-interaksjoner
I sammenheng med protein-protein interaksjonsstudiene basert på måling av Förster resonans energioverføring, er proteinparene som skal undersøkes markert ved hjelp av par fluorescerende eller andre selvlysende fargestoffer, slik at når proteinene som skal undersøkes samhandler, øker økningen i Förster resonansenergioverføring mellom de koblede fargestoffene kan observeres. Disse protein-protein-interaksjonsstudiene basert på Förster resonans energioverføring brukes for eksempel for å belyse signaloverføringsveier i cellen og for å søke etter nye aktive ingredienser ved hjelp av screening med høy gjennomstrømning .
Forskjellige metoder er tilgjengelige for merking av proteinene som skal undersøkes. Den uselektive direkte kjemiske merkingen, for eksempel ved hjelp av fluoresceinisotiocyanat (FITC) eller tetrametylrhodaminisotiocyanat (TRITC), er spesielt egnet for isolerte proteiner. En selektiv, om enn indirekte, merking består i bruk av fluorescensmerkede antistoffer som er rettet mot proteinene som skal undersøkes. Merking ved hjelp av enkle molekylærbiologiske metoder har etablert seg særlig innen cellebiologi. På denne måten kan derivater av det grønne fluorescerende proteinet (GFP), som donor-akseptorparet CFP-YFP, også kobles in vivo til proteinene som skal undersøkes. Den bioluminescerende Renilla luciferase brukes også som en donor i kombinasjon med et GFP-derivat som en akseptor i sammenheng med studier av bioluminescensresonans energioverføring. Ulempen med disse fargestoffene er deres størrelse, noe som kan påvirke protein-protein-interaksjonsanalysen. Dette problemet kan omgås ved hjelp av forbindelser med lav molekylvekt, slik som fluorescein arsenisk helixbindemiddel (FlAsH) og resorufin arsenisk helixbindemiddel (ReAsH), som binder seg til spesifikke aminosyresekvenser av proteinene som skal undersøkes og som er satt inn ved bruk av molekylærbiologiske metoder.
Analyse av proteinkonformasjonsendringer
Hvis både donor og akseptorfargestoff er koblet til ett og samme proteinmolekyl, kan observasjon av en intramolekylær Förster resonans energioverføring også gjøre det mulig å trekke konklusjoner om konformasjon og konformasjonsendring av proteiner. Dette prinsippet brukes av FRET-baserte biosensorproteiner , slik som Ca 2+ indikatoren Cameleon og Epac for påvisning av syklisk adenosinmonofosfat (cAMP), som er gjenstand for en konformasjonsendring i nærvær av substratet. De svakt fluorescerende aminosyrene tyrosin og tryptofan , som forekommer endogent i proteiner, kan også brukes som akseptorer i kombinasjon med egnede donorer, for eksempel terbium , for klargjøring av proteinstruktur basert på en Förster resonans energioverføring.
Molekylbiologi
I molekylærbiologi er DNA- baserte metoder som bruker Förster resonans energioverføring mye brukt. I dette tilfellet brukes fargekoblede DNA- oligonukleotider der en energioverføring kan observeres ved å danne en dupleks, eller alternativt avsluttes en energioverføring når deres tertiære struktur blir ødelagt. Disse kan brukes som analytiske verktøy i polymerasekjedereaksjonen (PCR), hybridisering , ligering , spaltning, rekombinasjon og syntese av nukleinsyrer . I tillegg brukes de i DNA-sekvensanalyse , mutasjonsanalyse og bestemmelse av konsentrasjonen av DNA og RNA.
Forskjellige fargekoblede oligonukleotider brukes til dette mangfoldet av bruksområder. I tillegg til givere som fluorescein , brukes rødt fluorescerende rodamin og relaterte fargestoffer, så vel som ikke-fluorescerende mørke slukkere , som akseptorfargestoffer . Selv om sistnevnte ikke tillater at en energioverføring identifiseres på grunnlag av en økning i akseptorutslippet, gir de fordelen av muligheten for en enkeltkanalsmåling av donorfluorescens, som ikke er lagt over av en akseptorfluorescens.
Hybridisering
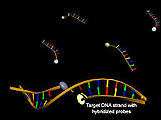
De såkalte hybridiseringsprober (LightCycler-prober) er blant de molekylærbiologiske verktøyene som bruker Förster-resonansenergioverføring og brukes til å identifisere DNA ved hjelp av hybridisering . De består av to ikke-komplementære oligonukleotider, hvor det ene fargestoffet fra donor-akseptorparet er koblet til 3'-enden av den ene og til 5'-enden av det andre oligonukleotidet. Hvis begge oligonukleotidene binder seg til en enkelt DNA-streng i umiddelbar nærhet, kan en Förster-resonansenergioverføring etter donoreksitasjon observeres gjennom en reduksjon i donorfluorescens og en økning i akseptorfluorescens. En modifisering av denne metoden består i bruk av hybridiseringsprober, som består av gjensidig komplementære DNA-tråder. De tillater også å bestemme konsentrasjonen av et mål-DNA, hvor en reduksjon i energioverføring blir observert på grunn av konkurranse mellom mål-DNA og komplementær streng av sonden etter hybridisering.
Molekylære fyrtårn brukes også i sammenheng med hybridiseringsanalyser . Disse består av en sløyfestamstruktur med en selvkomplementær stamme i 3'- og 5'-endene, hvor et donor-fluorescerende fargestoff eller en slukker er lokalisert, og en sløyfe som er komplementær til mål-DNA. En reduksjon i energioverføring kan observeres gjennom en økning i donorfluorescens etter eksitasjon som et resultat av hybridisering av sonden med et komplementært mål-DNA og oppløsning av den tertiære strukturen til de molekylære fyrene.
Polymerase kjedereaksjon (PCR)
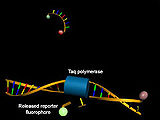
Spesielt i sammenheng med kvantitativ sanntids-PCR blir DNA-oligonukleotidbaserte prober brukt til å bestemme konsentrasjonen av det syntetiserte DNAet mens de analyserer Förster-resonansenergioverføringen. I tillegg til hybridiseringsprober og molekylære beacons brukes spesielt hydrolysesonder (TaqMan-sonder). Disse består av korte DNA-oligonukleotider som er komplementære til mål-DNA og hvis 5'- og 3'-ender er koblet til et donor-fluorescerende fargestoff eller en slukker. Mens donorfluorescensen undertrykkes i fravær av tilstrekkelige mengder komplementært mål-DNA takket være Förster-resonansenergioverføringen, øker den takket være 5'-exonukleaseaktiviteten til Taq- polymerase etter hybridisering med spaltning av det donorkoblede 5'-terminale nukleotidet .
Den kvantitative sanntids-PCR-en som bruker Scorpion-primere, er også basert på bruk av Förster-resonansenergioverføring . I likhet med molekylære fyrtårn består disse av et donorlysstofffargestoff og slukkekoblet sløyfestamstruktur i kombinasjon med en PCR-grunning . I motsetning til andre FRET-prober er Scorpion-primere inkorporert i det syntetiserte DNA som en del av polymerasekjedereaksjonen. Som med bruken av molekylære fyrtårn, kan det observeres en reduksjon i energioverføring på grunn av en økning i donorfluorescens etter eksitering som et resultat av inkorporering av primeren og hybridisering av loop-stammestrukturen med mål-DNA med oppløsning av den tertiære strukturen med Scorpion-primere.
litteratur
- Theodor Förster: Intermolecular Energy Migration and Fluorescence , Ann. Fysikk 6 (2): 55, 1948. doi : 10.1002 / andp.19484370105
- Joseph R. Lakowicz : Prinsipper for fluorescensspektroskopi . Plenum Publishing Corporation, 2. utgave, 1999.
- Oppføring på Förster-resonans-energioverføring (FRET) . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.FT07381 Versjon: 2.3.1.
weblenker
- Olympus: Applikasjoner i konfokal mikroskopi: Fluorescens Resonance Energy Transfer (FRET) Microscopy. Arkivert fra originalen 9. mai 2015 ; åpnet 13. juli 2016 .
- Interaktiv veiledning for optimalisering av fluorescensmikroskopiske måleforhold fra produsenten Nikon (engelsk)
- FLIM FRET Imaging (opplæring av Becker & Hickl, nettside)
Individuelle bevis
- ^ A b S. E. Braslavsky: Ordliste brukt i fotokjemi, 3. utgave (IUPAC-anbefalinger 2006) . I: Ren og anvendt kjemi . teip 79 , nr. 3 , 1. januar 2007, ISSN 1365-3075 , doi : 10.1351 / pac200779030293 .
- ↑ a b Förster T: Intermolekylær energimigrasjon og fluorescens . I: Ann. Fysikk . 437, 1948, s. 55. doi : 10.1002 / andp.19484370105 .
- ↑ a b Stryer L: Fluorescens energioverføring som spektroskopisk linjal . I: Annu. Pastor Biochem. . 47, 1978, s. 819-46. doi : 10.1146 / annurev.bi.47.070178.004131 . PMID 354506 .
- ^ Clegg, Robert M.: Historien om FRET . I: Lakowicz, Joseph R.; Chris D. Geddes (red.): Anmeldelser i fluorescens 2006 . Springer, Berlin 2006, ISBN 0-387-29342-6 , s. 1-46.
- ↑ Cario G, Franck J: Om nedbrytningen av hydrogenatomer av eksiterte kvikksølvatomer . I: Z. Fysikk . 11, 1922, s. 161-166.
- ↑ Perrin J: Fluorescens et induksjonsmolekylær par resonans . I: CR Hebd. Seances Acad. Sci. . 184, 1927, s. 1097-1100.
- ↑ a b Perrin F: Théorie des transferts d'activation entre molécules de méme espèce . I: Ann. Chim. Phys. (Paris) . 17, 1932, s. 283-314.
- ↑ Kallmann H, London F: Om kvantemekanisk energioverføring mellom atomsystemer . I: Z. Fysikk. Chem. B . 2, 1928, s. 207-243.
- ^ Förster T: Energimigrasjon og fluorescens . I: Naturvitenskapene . 6, 1946, s. 166-175.
- ↑ a b Marullo S, Bouvier M: Resonans energioverføring tilnærminger i molekylær farmakologi og videre . I: Trender Pharmacol. Sci. . 28, nr. 8, august 2007, s. 362-365. doi : 10.1016 / j.tips.2007.06.007 . PMID 17629577 .
- ↑ a b Demchenko AP: Förster Resonance Energy Transfer . I: Introduksjon til fluorescerende sensing . Springer, Berlin 2008, ISBN 1-4020-9002-1 , s. 91-99.
- ^ Dexter DL: En teori om sensibilisert luminescens i faste stoffer . I: J Chem Phys . 21, 1953, s. 836. doi : 10.1063 / 1.1699044 .
- ↑ a b c Robert M. Clegg: Forster resonans energioverføring - FRET hva er det, hvorfor gjør det og hvordan det gjøres . I: Theodorus WJ Gadella (red.): FRET og FLIM-teknikker . Elsevier, Amsterdam 2009, ISBN 0-08-054958-6 , s. 1-58.
- ↑ Demchenko AP: Förster Resonance Energy Transfer . I: Mekanismer for signaltransduksjon . Springer, Berlin 2008, ISBN 1-4020-9002-1 , s. 249-298.
- ↑ Bazin H, Trinquet E, Mathis G: Tidsoppløst forsterkning av kryptatutslipp: en allsidig teknologi for å spore biomolekylære interaksjoner . I: Rev. Mol. Biol . 82, nr. 3, januar 2002, s. 233-250. doi : 10.1016 / S1389-0352 (01) 00040-X . PMID 11999692 .
- ↑ Mekler VM: En fotokjemisk teknikk for å forbedre følsomheten ved påvisning av fluorescensresonans energioverføring . I: Photochem. Fotobiol. . 59, desember, s. 615-620. doi : 10.1111 / j.1751-1097.1994.tb09665.x .
- ↑ Laible PD et al. : Detaljert balanse i Förster-Dexter Excitation Transfer og dens anvendelse på fotosyntese . I: J. Phys. Chem. B . 102, nr. 9, 1998, s. 1641-1648. doi : 10.1021 / jp9730104 .
- Ê Kê, Bacon: fotosystem II . I: Fotosyntese: fotobiokjemi og fotobiofysikk . Kluwer Academic, 2001, ISBN 0-7923-6791-X , s. 199-322.
- ↑ a b Kendall JM, Badminton MN: Aequorea victoria bioluminescens beveger seg inn i en spennende ny æra . I: Trends Biotechnol . . 16, nr. 5, mai 1998, s. 216-24. PMID 9621461 .
- ↑ Yang X, Neher D: Scherf U, Miillen K (ed.): Organic light emitting enheter: Synthesis, Properties and Applications . Wiley-VCH, Weinheim 2006, ISBN 3-527-31218-8 , s. 333-368.
- ↑ Kappaun S, Slugovc C, List EJ: Fosforescerende organiske lysemitterende enheter: arbeidsprinsipp og iridiumbaserte emittermaterialer . I: Int J Mol Sci . 9, nr. 8, august 2008, s. 1527-1547. doi : 10.3390 / ijms9081527 . PMID 19325819 . PMC 2635741 (fri fulltekst).
- ↑ a b Truong K, Ikura M: Bruk av FRET-bildemikroskopi for å oppdage protein-protein-interaksjoner og proteinkonformasjonsendringer in vivo . I: Curr. Opin. Struktur. Biol . 11, nr. 5, oktober 2001, s. 573-8. PMID 11785758 .
- Its Gaits F, Hahn K: Kaster lys over cellesignalering: tolkning av FRET biosensorer . I: Sci. STKE . 2003, nr. 165, januar 2003, s. PE3. doi : 10.1126 / stke.2003.165.pe3 . PMID 12527820 .
- ↑ Boute N, Jockers R, Issad T: Bruken av resonans energioverføring i high-throughput screening: BRET versus FRET . I: Trender Pharmacol. Sci. . 23, nr. 8, august 2002, s. 351-354. PMID 12377570 .
- ^ Cooper MA: Fremskritt innen screening og analyse av membranreseptorer . I: J. Mol. Anerkjennelse. . 17, nr. 4, 2004, s. 286-315. doi : 10.1002 / jmr.675 . PMID 15227637 .
- ↑ Goddard JP, Reymond JL: Nylige fremskritt innen enzymanalyser . I: Trends Biotechnol. . 22, nr. 7, juli 2004, s. 363-370. doi : 10.1016 / j.tibtech.2004.04.005 . PMID 15245909 .
- ↑ Giepmans BN, Adams SR, Ellisman MH, Tsien RY: Den fluorescerende verktøykassen for å vurdere proteinplassering og funksjon . I: Vitenskap . 312, nr. 5771, april 2006, s. 217-24. doi : 10.1126 / science.1124618 . PMID 16614209 .
- ↑ Pfleger KD, Eidne KA: Opplysende innsikt i protein-protein-interaksjoner ved bruk av bioluminescensresonans energioverføring (BRET) . I: Nat. Metoder . 3, nr. 3, mars 2006, s. 165-74. doi : 10.1038 / nmeth841 . PMID 16489332 .
- ^ Griffin BA, Adams SR, Tsien RY: Spesifikk kovalent merking av rekombinante proteinmolekyler i levende celler . I: Vitenskap . 281, nr. 5374, juli 1998, s. 269-72. PMID 9657724 .
- ↑ Miyawaki A, Griesbeck O, Heim R, Tsien RY: Dynamiske og kvantitative Ca2 + målinger ved bruk av forbedrede kameleoner . I: Proc. Natl. Acad. Sci. USA . 96, nr. 5, mars 1999, s. 2135-40. PMID 10051607 . PMC 26749 (fulltekst).
- ↑ Ponsioen B, Zhao J, Riedl J, et al. : Påvisning av cAMP-indusert Epac-aktivering ved fluorescensresonans energioverføring: Epac som en ny cAMP-indikator . I: EMBO Rep . 5, nr. 12, desember 2004, s. 1176-80. doi : 10.1038 / sj.embor.7400290 . PMID 15550931 . PMC 1299185 (gratis fulltekst).
- J Allen JE, McLendon GL: Tryptofan og tyrosin til terbium fluorescensresonans energioverføring som en metode for å "kartlegge" aromatiske rester og overvåke docking . I: Biochem. Biophys. Res. Kommun. . 349, nr. 4, november 2006, s. 1264-8. doi : 10.1016 / j.bbrc.2006.08.165 . PMID 16979582 .
- ↑ a b c Didenko VV: DNA-prober som bruker fluorescensresonans energioverføring (FRET): design og applikasjoner . I: BioTechniques . 31, nr. 5, november 2001, s. 1106-16, 1118, 1120-1. PMID 11730017 . PMC 1941713 (fri fulltekst).
- ^ Morrison LE, Halder TC, Stols LM: Løsningsfasedeteksjon av polynukleotider ved bruk av interagerende fluorescerende merker og konkurransedyktig hybridisering . I: Anal. Biochem. . 183, nr. 2, desember 1989, s. 231-44. PMID 2624314 .
- ^ Tyagi S, Kramer FR: Molecular beacons: sonder som fluorescerer ved hybridisering . I: Nat. Bioteknologi. . 14, nr. 3, mars 1996, s. 303-8. doi : 10.1038 / nbt0396-303 . PMID 9630890 .
- ↑ Whitcombe D, Theaker J, Guy SP, Brown T, Little S: Påvisning av PCR-produkter ved hjelp av selvsonderende amplikoner og fluorescens . I: Nat. Bioteknologi. . 17, nr. 8, august 1999, s. 804-7. doi : 10.1038 / 11751 . PMID 10429248 .