Kjemiluminescens
I chemiluminescence ( engelsk : chemiluminescence ) eller chemiluminescence fenomen er referert til er det en prosess der ved en kjemisk reaksjon elektromagnetisk stråling i området ultrafiolett og synlig lys sendes ut. Hvis luminescensen finner sted i det infrarøde området, brukes begrepet infrarød kjemiluminescens .
Den Bioluminesens er et spesialtilfelle av chemiluminescence i biologiske systemer, for eksempel ildfluer .
oppdagelse
Allerede i 1000 f.Kr. De første tesene om bioluminescerende organismer ble beskrevet i Kina. Den første kjemiluminescensreaksjonen ble oppdaget ved et uhell i 1669 av Hamburg- alkymisten Heinrich Hennig Brand ( Fosfor Mirabilis , glød av fosfordamp når det oksyderes av atmosfærisk oksygen eller vann). Han mistenkte at det var gull i menneskelig urin , hvorpå han fordampet noen tusen liter og reduserte det med kull . Fosfatet som var tilstede i urinen ble redusert til fosfor og deretter fikk det til å lyse gjennom påfølgende oksidasjon. Eilhard Wiedemann skapte begrepet chemiluminescence i 1888 .
basis

Den emisjon av lys i kjemiluminescensen er en konsekvens av overgangen av et elektron fra en eksitert tilstand til en energimessig lavere tilstand, eventuelt i grunntilstanden . I motsetning til fluorescens eller fosforesens oppnås denne eksiterte tilstanden i kjemiluminescens gjennom en kjemisk reaksjon.
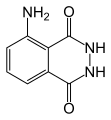
Utgangsmaterialene for kjemiluminescensreaksjoner kalles luminoforer . Den mest kjente er 3-aminoftalsyrehydrazid ( luminol ). Under peroksyoksalat menes reaksjoner av hydrogenperoksyd med derivater av oksalsyre i nærvær av sensibiliserende stoffer . Mange luminoforer er 1,2- eller 1,4-dikarbonylforbindelser slik som oksalsyreestere (f.eks. Difenyloksalat og dets derivater ) og luminol .
Difenyloksalat , en 1,2-dikarbonylforbindelse
3-aminoftalsyrehydrazid ( luminol ), en 1,4-dikarbonylforbindelse
I de fleste kjemiluminescerende reaksjoner mottas først et dannet ustabilt mellomprodukt med en peroksidbro , hvis høyenergiforfallsprodukt et ladetransferkompleks med et fargestoffmolekyl mottas sensibilisatoren ( engelsk sensibilisator ; et molekyl med et antall dobbelt- eller trippelbindinger ) og kraft til dette gir seg. Det eksiterte fargestoffmolekylet avgir deretter et lyskvantum , hvis bølgelengde avhenger av strukturen til fargestoffet som brukes.
Under visse betingelser kan en oscillerende kjemiluminescens også genereres, f.eks. B. ved å kombinere Orban-oscillatoren med luminol.
applikasjoner
Sannsynligvis er den mest kjente kjemiluminescensreaksjonen oksidasjon av luminol av hydrogenperoksid i nærvær av jern- eller manganioner , som brukes i rettsmedisin for å synliggjøre spor av blod ( blodpigmenthemoglobinet inneholder Fe 2+ ioner). Det oksyderte luminolmolekylet fungerer også som sensibiliserende middel.
I gassanalyse brukes kjemiluminescens i oksidasjon av nitrogenmonoksid til nitrogendioksid for å påvise nitrogenmonoksid. Hvis nitrogendioksid reduseres katalytisk i analysatoren før oksidasjon, kan begge nitrogenoksider påvises.
Plastrør er kommersielt tilgjengelig som avgir intenst, langvarig lys når de er bøyd ( glødestenger ). Dette lyset genereres også av kjemiluminescens. Det er tre kjemiske komponenter i rørene: en oksalsyreester , et fargestoff , hvis utslipp bestemmer fargen på lyset, og et glassrør med hydrogenperoksid. Hvis røret brytes med hydrogenperoksid, starter peroksykoksalatkjemiluminescensen .
Kjemiluminescensen til 1,2-dioksetaner brukes i biokjemi og i medisinsk diagnostikk . Det gjør at du pålitelig kan oppdage de minste sporene av enzymer ned til individuelle molekyler . I tillegg til andre luminoforer som luminol , akridiniumester eller luciferiner , konsentrasjonene av antistoffer og er antigener bestemmes i kjemiluminescens- immunoanalyse . I tillegg kan ATP og NADH bestemmes i biologiske medier ned til svært lave konsentrasjoner. Sensitive deteksjonssystemer er utviklet for mange underlag assosiert med ATP.
litteratur
- S. Albrecht, H. Brandl, Th. Zimmermann: Chemiluminescence . Hüthig Verlag, Heidelberg 1996
- Aldo Roda: Kjemiluminescens og bioluminescens . Royal Society of Chemistry 2011; ISBN 978-1-84755-812-1
Individuelle bevis
- ^ Duden : Stavekontroll: kjemiluminescens .
- ↑ Oppføring på kjemiluminescens . I: IUPAC Compendium of Chemical Terminology ("Gullboken") . doi : 10.1351 / goldbook.C01045 Versjon: 2.3.1.
- ↑ Eilhard Wiedemann: Om fluorescens og fosforescens I. Treatise. I: Annaler for fysikk og kjemi. 270, 1888, s. 446-463, doi : 10.1002 / andp.18882700703 .
- ^ MM Rauhut, kjemiluminescens fra samordnede peroksidnedbrytningsreaksjoner, iht. Chem. Research, 2, 80-87 (1969).
- ↑ AG Hadd, A.Seeber og JW Birks: Kinetics of Two Pathways i peroxyoxalates Chemiluminescence , Journal of Organic Chemistry, 65, (2000), 2675-2683.
- ^ University of Jena : Peroxyoxlate chemiluminescence .
- ^ University of Jena: Kjemiluminescensen til 1,2-dioksetaner .
- ^ S. Albrecht, H. Brandl, W. Adam: kjemiluminescensreaksjoner, kjemi i vår tid, bind 24, 1990, nr. 5, s. 227-238.
weblenker
- Vis eksperimenter med luminol, oscillerende kjemiluminescens og oksalsyreestere (produksjon er også på siden)
- Kjemisk lys - eksperimenter med kjemiluminescens Videoopptak av en forelesning. Fra TIMMS, Tübingen Internet Multimedia Server ved Universitetet i Tübingen .