Kalsiumkarbid
| Krystallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
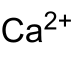 | |||||||||||||||||||
| Generell | |||||||||||||||||||
| Etternavn | Kalsiumkarbid | ||||||||||||||||||
| andre navn |
|
||||||||||||||||||
| Forholdsformel | CaC 2 | ||||||||||||||||||
| Kort beskrivelse |
fargeløse krystaller |
||||||||||||||||||
| Eksterne identifikatorer / databaser | |||||||||||||||||||
| |||||||||||||||||||
| eiendommer | |||||||||||||||||||
| Molarmasse | 64,10 g mol −1 | ||||||||||||||||||
| Fysisk tilstand |
fast |
||||||||||||||||||
| tetthet |
2.22 g cm −3 |
||||||||||||||||||
| Smeltepunkt |
2160 ° C |
||||||||||||||||||
| kokepunkt |
2300 ° C |
||||||||||||||||||
| løselighet |
Kalsiumkarbid er ikke helt løselig i noe løsemiddel |
||||||||||||||||||
| sikkerhetsinstruksjoner | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,14 mg m −3 |
||||||||||||||||||
| Termodynamiske egenskaper | |||||||||||||||||||
| ΔH f 0 |
−59,8 kJ / mol |
||||||||||||||||||
| Så langt som mulig og vanlig, brukes SI-enheter . Med mindre annet er angitt, gjelder oppgitte data standardbetingelser . | |||||||||||||||||||
Kalsiumkarbid , og kalsium acetylid , en kalsium - saltet av etyn og et acetylid . I ren tilstand er det et hvitt fast stoff.
historie
Kalsiumkarbid ble først presentert av Edmund Davy i 1836 og av Friedrich Wöhler i 1862 og beskrevet i detalj av Marcellin Berthelot i 1862 . Laboratoriekalsiumkarbidproduksjonen i den elektriske ovnen ble utført i 1892 av Thomas Willson i Amerika og av Henri Moissan i Paris. Den industrielle ekstraksjonen av kalsiumkarbid begynte i 1895 i aluminiumsindustrien AG i Neuhausen i Sveits; den ble inkludert i Norge og Tyskland ( Aluminium Industrie Aktiengesellschaft i Rheinfelden i Baden ) i 1898 . I USA startet produksjonen omtrent samtidig i Union Carbides forgjengereorganisasjoner , som Willson solgte patentet til i 1895, og i Canada gjennom selskaper grunnlagt av Willson. Årsproduksjonen falt fra 10 millioner tonn på 1960-tallet til 2 millioner tonn i 2010.
Produksjon
Teknisk oppnås kalsiumkarbid i smeltereduksjonsovner (en spesiell form for lysbueovnen ) ved 2000 til 2300 ° C fra kalsiumoksid (kalk) og koks . På grunn av det høye strømforbruket til disse ovnene er produksjonen veldig kostnadskrevende. Drift er derfor bare lønnsomt der både råvarer og strøm kan skaffes billig, for eksempel fra vannkraftverk i vannrike regioner.
De resulterende brune klumpene inneholder 80 til 85 prosent kalsiumkarbid, resten består av urenheter som kalsiumoksid, kalsiumfosfid , kalsiumsulfid , kalsiumnitrid eller silisiumkarbid .
En prosess utviklet i 2010 tar sikte på å erstatte en del av kull og koks som brukes med plastavfall (KBK) som en sekundær råvare i fremtiden .
Renere kalsiumkarbid kan oppnås ved å reversere reaksjonen for å danne kalsiumcyanamid eller ved å varme opp en blanding av kalsiumcyanamid og karbon i høyt vakuum.
Representasjonen fra elementene er også mulig ved 1250 ° C.
eiendommer
Fysiske egenskaper
I ren tilstand er kalsiumkarbid en fargeløs, krystallinsk masse. Det er to modifikasjoner , tetragonal og en ansiktssentrert kubisk modifikasjon av pyritt- typen, som dannes ved oppvarming over 440 ° C.
Kalsiumkarbidet på markedet er farget grått til gråsvart på grunn av tilsatte karbonkomponenter eller brunt på grunn av jernoksidurenheter ; I tillegg inneholder det noe kalsiumoksyd , kalsium-fosfid , kalsium- sulfid , ferrosilisium , magnesium-nitrid og silisium-karbid på grunn av sin fremstilling , slik at det i gjennomsnitt den bare har en CaCl 2 -innhold på 82%.
Kjemiske egenskaper
Kalsiumkarbid tilhører gruppen karbider til acetylidene, da det formelt er avledet fra etyn . Kalsiumkarbid er ikke løselig i noe løsemiddel (uendret). Hvis det kommer i kontakt med vann , spaltes det i en kraftig reaksjon (hydrolyse) til etyn og kalsiumhydroksid .
Den ubehagelige "karbid" lukten i denne reaksjonen er ikke forårsaket av gassetynen, men skyldes gasser som monofosfin , ammoniakk og hydrogensulfid , som dannes når urenhetene reagerer med vann. Slik dannes monofosfin gjennom hydrolyse av kalsiumfosfid Ca 3 P 2 inneholdt i kalsiumkarbid :
Ved temperaturer over 905 ° C reagerer det med nitrogen og danner kalsiumcyanamid , trykkhydrogenering tilfører kalsiumhydrid ; dets reduserende egenskaper brukes også teknisk.
bruk
I vanlig språkbruk blir karbid vanligvis likestilt med kalsiumkarbid . I gassgeneratoren reagerer den med vann og danner etin (vanlig navn: acetylen), som brukes til forskjellige bruksområder.
- Tidligere ble kalsiumkarbid blandet med vann i karbidlamper , som det reagerte for å danne brennbart etyn ; etinet ble tent og brent med en lys flamme. Denne metoden ble spesielt brukt i gruvelampene i underjordisk gruvedrift. Karbidlamper foretrekkes fortsatt av speleologer i dag fordi de gir et spesielt vakkert lys og flammen kan brukes til å markere overflater med sot .
- Produksjon av kalsiumcyanamid
- Syntese av ethyne, drift av karbidutviklere (bare viktig i fremvoksende land i dag)
- For avsvovling av råjern og flytende stål i stålindustrien
- Fra rundt 1900 til langt ut på 1930-tallet ble også hardmetallamper spesielt produsert for dette formålet brukt som sykkellys. Disse sykkellampene i karbid skinte langt lysere enn tilsvarende olje- eller stearinlys.
- Dannelsen av etin brukes til å bestemme restfuktigheten i jord- eller betongprøver . Her fylles prøven i en standardisert stålflaske sammen med en ampulle kalsiumkarbid og fire stålkuler og forsegles med et trykkmålerhode. Flasken ristes, noe som ytterligere knuser prøven og bryter kalsiumkarbidampullen. Gasstrykket som følge av reaksjonen av kalsiumkarbid og fuktighet kan avleses på manometerhodet og omdannes til fuktighetsinnholdet. Denne prosessen er kjent som karbidmetoden (CM) . Metoden brukes for eksempel etter at gulvet er lagt, for å bestemme om toppdekningen allerede kan legges.
- Kalsiumkarbid brukes som en aktiv ingrediens i avstøtningsmidler for å avskrekke vol og mol . Gassblandingen som oppstår ved kontakt med jordfuktigheten driver dyrene bort uten å drepe dem.
Karbidskyting
Hvis du legger noen kalsiumkarbidbiter i en melkedunk og dryss dem med litt vann, dannes en eksplosiv gassblanding av etin og oksygen i volumet som er forseglet med et lokk eller en fotball . Gassblandingen antennes deretter gjennom et tidligere boret hull i bakken. Eksplosjonen kan kaste lokket eller fotballen opp til 70 m. I motsetning til potetkanonen er retningen mindre forutsigbar. Tradisjonen med karbidskyting dyrkes hovedsakelig i Nederland og i noen deler av Nord-Tyskland og Nord-Bayern av unge menn ved bryllup, nyttårsaften og nyttårsaften. I Øvre Lusatia er det kjent som påskeskyting . I det østfrisiske området i Tyskland og de østlige delene av Nederland er karbidskyting en integrert del av tradisjonelle nyttårsaften. I Kärnten (Østerrike) foregår karbidskyting som påskeskikk fra matvelsignelsen på lørdag til oppstandelsesfeiringen påskedag om morgenen.
Karbidfiske
Det samme prinsippet ble brukt av fattige i sultperioden etter andre verdenskrig , for å kunne drepe og rydde mange fisk raskt i fiskevann , til tross for forbudet mot dynamittfiske, ved å eksplodere en karbidbokse som var lett tilgjengelig på den tiden.
Drivstoffgass for sveising
Karbid ble brukt i stor grad fram til rundt 1960 for å generere høgenergi drivstoffgass acetylen (etyn) i karbidutviklere ved lavt trykk, som - i kombinasjon med oksygen - er unikt bra for sveising ( gassfusjonssveising ) av stål på grunn av dets spesielt høy flamtemperatur ( jernlegeringer ), for eksempel egnet for produksjon av rørledninger i gass / vann / oppvarmingssektoren. Større gassgeneratorer ble permanent installert i verksteder, mens mindre ble brukt på byggeplasser. Karbid måtte lagres i blikkbokser, for eksempel beskyttet mot inntrengning av vanndamp.
Denne prosessen med å generere acetylen på stedet var nødvendig fordi hvis acetylen ble komprimert for lagring i en gassflaske, ville den spaltes katastrofalt mens den frigjorde varme.
Bare med den tekniske utviklingen av acetylenflasken , der denne gassen trygt kan lagres under middels trykk oppløst i et løsningsmiddel, kunne gassforsyningen omdannes til sylindere og forenkles for brukeren. I lang tid inneholdt acetylenflasker kreftfremkallende asbest og er fremdeles tunge og følsomme for støt og varme på grunn av løsemidler og porøs støtte.
Se også
Individuelle bevis
- ↑ a b Oppføring av kalsiumkarbid. I: Römpp Online . Georg Thieme Verlag, åpnet 10. november 2014.
- ↑ a b c d datablad kalsiumkarbid (PDF) fra Carl Roth , åpnet 14. desember 2010.
- ↑ a b Oppføring av kalsiumkarbid i GESTIS stoffdatabase til IFA , åpnet 1. februar 2016. (JavaScript kreves)
- ↑ Oppføring av kalsiumacetylid i klassifiserings- og merkelisten til European Chemicals Agency (ECHA), tilgjengelig 1. februar 2016. Produsenter eller distributører kan utvide den harmoniserte klassifiseringen og merkingen .
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . 90. utgave. (Internett-versjon: 2010), CRC Press / Taylor og Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, s. 5-20.
- ↑ M. Binnewies et alii: Allgemeine und Anorganische Chemie . 2. utgave. Spectrum, 2010, ISBN 3-8274-2533-6 , pp. 383 .
- ↑ Produksjon av karbid med plastavfall ( Memento fra 8. juni 2016 i Internet Archive ), BINE Informationsdienst - Projektinfo 08/2011.
- ↑ a b c Georg Brauer (red.), Med samarbeid mellom Marianne Baudler og andre: Handbook of Preparative Inorganic Chemistry. 3., reviderte utgave. Volum II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s. 931-932.
- ^ Siegfried Hauptmann : Organic Chemistry , 2. utgave, VEB Deutscher Verlag für Grundstoffindindustrie, Leipzig 1985, ISBN 3-342-00280-8 , s. 263.
- ↑ CSB utsteder sikkerhetsbulletin, utgir funn og anbefalinger i 2005 Acetylene Services Company (ASCO) Eksplosjon som drepte tre i Perth Amboy, NJ. US Chemical Safety and Hazard Investigation Board , 26. januar 2006, åpnet 5. februar 2021 .
- ↑ Andreas Vietmeier: Voles ( vann voles) i hagen. I: www.landwirtschaftskammer.de . Landbrukskammer i Nordrhein-Westfalen , plantebeskyttelsestjeneste, åpnet 19. mars 2016.
- ↑ Godkjenningsrapport for Prontox volggass. Federal Office for Consumer Protection and Food Safety, åpnet 19. mars 2016.
- ↑ Robert Mohr, Timo Sager: "Enheten" lar den rippe ordentlig. I: Ostfriesen-Zeitung . 31. desember 2018, åpnet 29. desember 2019 .
weblenker
- Carbide produksjon ( minnesmerke fra den 24 juli 2012 i nettarkivet archive.today ) i Piesteritz i det 20. århundre, tysk kjemi Museum Merseburg












